陈敏珊 郑 娟 李 平
(广州薇美姿实业有限公司,广东 广州 510665)
人体口腔环境是由多种微生物集合形成的复杂的微生物系统,口腔中的微生物包括:细菌、真菌、原虫、支原体、病毒等,口腔中的细菌种类超过700种。口腔微生物通过共生、竞争、拮抗等相互作用达到一个口腔微生态的平衡。只有微生物群落之间与微生物群落与宿主之间维持生态平衡才能保持口腔健康。当有外来微生物进入口腔或者口腔环境中固有的某些微生物在口腔中过量生长,逐渐成为优势菌群,打破了口腔微生态的平衡,进而导致口腔疾病的发生。
在20世纪后期,尤其是在发达国家,主要采用口服抗生素的化学疗法来治疗细菌感染性疾病。但是长期服用抗生素不仅会破坏口腔生态平衡,同时也会加剧细菌耐药性问题的严重性。
随着关于益生菌方面研究的逐渐开展,研究者已经证实了益生菌可以用于防治肠道感染、泌尿系统感染等方面,同时这种防治疾病的方式也逐渐被应用到口腔医学领域。益生菌疗法不仅可以通过不同机制抑制致病菌的生长,同时还能维持正常的口腔微生态菌群,保障口腔健康。
微生态系是指在宿主一定结构的空间内,正常微生物群以宿主组织和细胞及其代谢产物为环境,在长期进化过程中形成的能独立进行物质、能量及基因相互交流的统一的生物系统。人是由自己的细胞和微生物细胞组成的,人类与许多细菌保持着永久的和亲密的关系。在人体内部的表面上寄居者数以万计的细菌,这些寄住在人体各特殊部位或表面的生物群被称为正常菌丛(normal flora),或称为固有菌丛。正常菌丛中的成员可称之为常居菌或固有菌。迄今尚无关于人体内固有菌丛精确数量的报道,据保守估计,其总数多于人体细胞的总数,人体细胞数约为1013个,而人体内细菌数约为1014个。这些常居菌的大多数寄居在口腔、肠道中,口腔正常菌丛之间以及它们与宿主之间的相互作用成为口腔生态系(oral ecosystem)。许多正常菌丛和其宿主之间呈动力的平衡状态(dynamic equilibrium),这些共生微生物通过抵抗病原体而有助于宿主健康,维持体内平衡并调节免疫系统[1]。
1.1 口腔微生态的组成
口腔微生态作为微生态学的一个重要分支,主要由宿主固有口腔环境和口腔微生物构成。口腔是一个复杂而完整的微生态系统。口腔固有环境主要包括口腔的物理化学特征,如口腔温度、湿度、pH值等,以及口腔各部位的解剖形态及组织结构。定植于口腔的微生物主要包括细菌、真菌、螺旋体、支原体、病毒及原虫等,这些微生物在口腔的不同部位共栖、竞争和拮抗,与口腔固有环境共同构成了口腔微生态系统,形成一种动态平衡关系。
1.1.1 固有口腔环境
1.1.1.1 物理化学特征
口腔环境的物理化学特征包括:口腔温度、湿度、pH值、营养物质的代谢等。口腔温度约为37℃,口腔细菌大多属嗜温微生物,这为细菌的生长提供了适宜的温度条件。口腔环境潮湿,这可能是口腔微生物复杂的条件之一。大多数口腔细菌都生长在pH值为7的中性环境中,而口腔可提供一个相对恒定的中性pH值环境,这为口腔中细菌的定植生长提供了良好的基础,但口腔与外环境相通,其pH值易受到外源性物质干扰而改变, 从而对口腔微生态产生影响。此外,营养物质代谢产酸,在某些口腔疾病的发生发展过程中也起重要作用。
1.1.1.2 口腔各部位的解剖形态及组织结构
口腔的特殊解剖形态及组织结构参与了口腔微生态的组成。口腔中存在着各种不同的表面,并且各有特征,如黏膜表面就有舌、牙龈上皮、龈沟上皮、颊上皮和腭上皮等几种不同类型;
硬组织有牙釉质、牙本质、牙骨质和用于修复的各种不同的材料等几种不同的类型。由于结构不同,造成口腔不同部位的氧含量有很大差异,如舌背和颊黏膜主要为有氧环境,牙周袋内为乏氧环境,这导致了口腔不同部位菌群分布的差异。同时口腔分泌唾液,会影响口腔pH值,唾液中含有的酶和抗体等,也构成口腔微生态的一部分。这些部位的局部解剖、组织结构和表面化学对于细菌在口腔中的定植选择起着很大的作用。
1.1.2 口腔微生物
美国国立卫生研究院(NIH)启动了人类微生物组计划(HMP),以表征人类微生物组更完整并确定关联微生物组变化与健康/疾病之间的关系。口腔微生物是人类微生物组的重要组成部分之一,尤其是人类口腔中的微生物。口腔被认为是人体中第二大复杂的微生物群,仅次于结肠[2]。口腔微生物组高度多样化,研究发现,定植于口腔的微生物,主要以细菌为主,目前从口腔中分离和鉴定的细菌种类已经超过700多种(AaS,2005),分属11个不同的菌属,是人体最复杂的微生物集群之一[3]。其中,大约有54%的菌株已经被培养和命名,有14%的菌株被培养但未命名,还有32%的菌株被称为未培养的系统型(来自人类口腔微生物组数据库)。越来越多的研究表明,口腔微生物群在许多口腔和全身性疾病的发病和发展中起着至关重要的作用。
Miller首次提出关于龋齿发生的“化学细菌学说”,他认为牙菌斑生物膜由微生物组成。根据发生部位与龈缘的关系,牙菌斑可分为龈上菌斑和龈下菌斑,龈上菌斑以革兰阳性链球菌为优势细菌,构成了牙齿平滑面的微生物群落。龈下菌斑以革兰阴性厌氧菌为优势菌,它们在牙周袋内形成群落并可导致牙周病[4]。
口腔微生态系的平衡和失调与口腔的健康和疾病密切相关[5]。一般正常菌群对机体也具有双重作用,在一定环境中,当机体与正常菌丛之间保持着相互平衡的状态时,正常菌丛显示对宿主起着有益的作用;
但当环境中的某些因素干扰了这个平衡状态时,如放射线照射、过量激素的应用、抗生素的长期使用等而导致菌群失调,这就为正常菌群提供了显示其有害作用的机会,这些原来无致病性的或毒力很弱的细菌,遂成为机会致病菌而引起内源性感染疾病,如长期服用抗生素所致的葡萄球菌假膜肠炎、口腔中的念珠菌病。
2.1 龋齿
龋齿是最常见的口腔疾病之一,是导致口腔疼痛和牙齿脱落的主要原因。龋齿是由产酸细菌和可发酵碳水化合物之间的复杂相互作用引起的。通常情况下,大量碳水化合物的摄入会导致细菌产酸增加,唾液缓冲能力降低和低pH值的口腔环境。环境酸化是龋齿发展过程中微生物菌群表型和基因型变化的主要原因[6]。其中变形链球菌和乳杆菌经深入研究,被认为是龋齿中的特定病原体。然而,最近的研究表明,变形链球菌不仅在龋齿的早期以高水平存在,而且在一些健康的个体中也存在[7,8]。而且在一些患者中,变形链球菌和乳杆菌在一些龋齿样本中含量低或不存在[9]。这些结果表明,龋齿病变的发生和发展不能完全归因于这些微生物,龋齿是一种细菌性疾病,是由复杂的群落而不是单一的病原体引起的。Aas等报道了维永氏菌属、乳杆菌属、双歧杆菌属、丙酸杆菌属、变形链球菌、放线菌属和拟南芥属在龋齿进展中也起着关键作用[10]。除产酸细菌外,某些细菌还可以从精氨酸和尿素中产生氨,从而提高pH值,从而影响口腔生物膜的pH稳态,并可能减缓龋齿的发生和发展[11]。
2.2 牙周疾病
牙龈炎是成年人中最常见和最普遍的牙周疾病,是由牙龈边缘形成的细菌菌斑引起的可逆性炎症疾病。如果不加以控制,牙龈炎将发展为牙周炎。牙周炎是一种慢性、不可逆的炎症性疾病,在此过程中,免疫细胞的慢性浸润导致结缔组织破坏,血管增生和肺泡骨破坏[12]。微生物群落组成的变化导致宿主-微生物相互作用发生变化,从而引发破坏性炎症和骨质流失。牙龈卟啉单胞菌(P.gingivalis),牙垢螺旋体(T. denticola)和连翘坦氏菌(T. forsythia)在历史上被定义为“红色复合物”,尽管这些细菌在健康个体中可能很少见,但它们被认为与牙周炎的发生和发展密切相关。
2.3 复发性口疮性口炎
复发性口疮性口炎(RAS)是最常见的口腔粘膜疾病,约占总人口的20%[13]。该疾病的特征是极度疼痛的复发性口腔溃疡。越来越多的证据表明,RAS与粘膜和唾液微生物群的营养不良有关。
Marchini等[14]发现普雷沃氏菌仅存在于RAS患者的粘膜微生物群中,而不存在于健康受试者中。Seoudi等对黏膜微生物群的研究发现,与健康对照组相比,RAS患者中放线菌属,尤其是罗思氏菌属的水平更高[15]。
2.4 口腔肿瘤
越来越多的证据表明口腔微生物群可能在口腔肿瘤的发展中起作用。口腔鳞状细胞癌(OSCC)是口腔表皮的最常见的恶性肿瘤。
Nagy等用培养依赖性法检查了同一患者的口腔肿瘤和健康粘膜表面,发现口腔肿瘤表面具有大量的需氧和厌氧菌[16]。口腔微生物组中的这些可观察到的差异可能具有作为监测口腔肿瘤的发生、发展和复发的生物标志物的潜力。口腔微生物群在口腔癌发病机理中的作用尚不明确,专家们目前推测了几种机制。首先,细菌可以引起慢性炎症反应,在该过程中产生的慢性炎性介质引起或促进细胞增殖、诱变、致癌基因激活和血管生成;
其次,细菌可能通过使用3型或4型分泌系统(T3SS / T4SS)分泌细菌效应蛋白而直接影响癌症的发病机制,这可能会影响细胞增殖、细胞骨架重排、NF-KB的活化以及对细胞的抑制细胞凋亡;
第三,细菌可能产生某些致癌物质,例如细菌将乙醇转化为乙醛(一种公认的致癌物)。
3.1 糖尿病
糖尿病和牙周炎之间存在双向关系。牙周炎被认为是糖尿病控制不力的并发症之一。已有多项研究探索了糖尿病对口腔微生物群的影响。
Hintao等[17]报道指出,与非糖尿病受试者相比,糖尿病受试者的龈上菌斑具有较高的齿垢密螺旋体、尼古拉斯暴食杆菌、血链球菌、口头链球菌和中间链球菌水平。在另一项研究中,糖尿病患者和非糖尿病患者的龈下微生物群存在显着差异[18]。另外,牙周炎相关细菌增加了血糖控制的难度。牙龈卟啉单胞菌(一种主要的牙周炎病原体)产生的脂多糖(LPS)可以通过刺激某些炎症细胞因子的产生来介导胰岛素抵抗并损害胰岛素活性[19]。
3.2 心血管疾病
微生物感染是心血管疾病的重要危险因素,与牙周病原体密切相关。
Koren等人的研究结果表明,动脉粥样硬化斑块中韦荣菌和链球菌的丰度与其在口腔中的丰度有关[20]。在动脉粥样硬化斑块中还检出了一些口腔微生物,包括牙龈卟啉单胞菌、放线杆菌集合杆菌、连翘肠杆菌、核小肠弯曲杆菌和直弯曲菌[21,22]。近年来已经有专家提出了几种可能的机制来解释牙周炎和心血管疾病之间的关系。通常,宿主长时间接触牙周病原体是主要原因。微生物通过口腔组织进入循环系统,并进入动脉分泌LPS和炎性介质,从而导致心血管并发症,如血管内皮损伤、血小板聚集、平滑肌增殖和脂质沉积[23]。
3.3 远处器官的肿瘤
口腔微生物也参与其他器官肿瘤的发生。口腔微生物引起的细胞因子和其他炎性介质的增加可能与癌症发展的免疫相关机制有关。
Shiga等有报道称,链球菌(S. anginosus)感染可能与头颈部鳞状细胞癌的发生和发展有关[24]。
Narikiyo等。用与培养无关的分子方法检查了唾液,发现口腔牙周病螺旋体T. denticola,链霉菌和链球菌与食管癌有关[25]。此外,胰腺癌患者和健康对照者之间的长条状奈瑟氏球菌和链霉菌比例明显不同[26]。
考虑到口腔微生物在口腔和全身性疾病的病因和发病机制中的作用,其关键是改善口腔对病原体的保护并维持口腔微生态的动态平衡。研究微生物群落之间的相互作用是对抗口腔病原体的关键。如果在营养利用或环境管理中没有粘附受体并且没有合适的伴侣细菌进行代谢合作,则可能会排除掉潜在的病原体。另一方面,某些特定的微生物,例如牙龈卟啉单胞菌,被定义为关键病原体,可以改变环境,改变生态内其他微生物的比例。
4.1 机械清创术
当前的疗法主要旨在通过机械方法减少病原微生物的数量。自行清除牙菌斑,例如刷牙,可以改善牙菌斑的控制水平。专业去除斑块,包括洗牙、根部计划和牙周手术,可以减少病原细菌的数量和比例,并重新建立口腔菌群的生态平衡。通常,在牙周治疗后,与深度大于4mm的囊袋相关的微生物会降低到非常低的水平,甚至无法检测到。机械清创后,牙周炎患者的牙周病原体,如牙龈卟啉单胞菌,连翘坦氏菌(T. forsythensis),齿状坦索菌和密螺旋体也明显减少了[27]。但是,牙齿解剖结构的复杂性和手术区域的局限性为彻底清除牙菌斑带来了挑战和困难。机械手段是非特异性的,因此也可以去除有益细菌。更重要的是,机械清创后微生物丰富度和生物多样性显着降低,从某种意义上说,这对口腔健康是不利的。
4.2 抗生素使用
抗生素旨在针对动物和人类中的特定病原细菌。在牙科领域使用抗生素的适应症是有限的,因为大多数口腔疾病可以通过手术干预和口腔卫生措施得到最佳控制。在牙科领域中,局部使用抗生素通常比全身使用更可取,因为它可以大大增加和持续增加沟液中的药液浓度,并减少全身性不良副作用。抗生素常被用作机械治疗牙周炎的辅助手段,特别是在常规治疗失败和治疗发病较快的疾病的情况下。但是,应该注意的是,牙科实践中使用抗生素的特征是基于临床和细菌流行病学因素的经验处方,导致短期内仅使用非常窄范围的广谱抗生素,这种方法导致了多种微生物的抗药性的发展,并导致了常用抗生素的无效。据报道,在使用阿莫西林的幼儿中,对阿莫西林耐药的口腔细菌的数量明显高于未使用阿莫西林的儿童。有效使用抗生素可能需要对患者口腔微生物组进行基因组分析,以鉴定目前的微生物并确定它们是否会对特定治疗产生反应。
4.3 益生菌和益生元
为了克服这些传统干预方法的局限性,目前已经有了新的口腔微生物群调节方案,例如益生菌和益生元。益生菌在促进健康方面是众所周知的,并已得到广泛研究。国际科学协会已将“益生菌”一词定义为“当以适当量施用时,对宿主具有健康益处的活微生物”[28]。关于益生菌的作用机制,主要有以下几种观点:益生菌能够分泌有机酸、过氧化氢和细菌素等多种抗菌物质,从而抑制致病菌的生长;
它还能够与致病菌竞争黏膜表面的结合位点,减少致病菌的定植;
可通过调整pH值和氧化-还原反应电位,改变微生态环境,使之维持在适宜的范围内;
还有可能通过刺激非特异性的免疫反应和调节体液免疫与细胞免疫,来发挥其益生作用。通过实验研究还发现,除鼠李糖乳杆菌外,唾液乳杆菌、双歧杆菌、罗伊氏乳杆菌、动物双歧杆菌、副干酪乳杆菌和干酪乳杆菌已被证实能够减少致龋菌的数量,从而预防龋齿。
越来越多的研究支持益生菌疗法预防或治疗牙龈炎和牙周炎。Krasse等有报道称食用含罗伊氏乳杆菌的口香糖可以减少牙龈出血并减少牙龈炎;
Iniesta等人进一步评估了罗伊氏乳杆菌。在患牙龈炎的情况下,发现龈下微生物群中的牙龈卟啉单胞菌数减少;
对于牙周炎,罗伊氏乳杆菌可降低牙龈指数、牙菌斑指数、探查囊袋深度和临床附着水平,并降低牙周病原体(A.放线菌,中间媒介和齿龈假单胞菌)的水平[29]。另外,干酪乳杆菌、鼠李糖乳杆菌、唾液乳杆菌和某些芽孢杆菌属菌种也被评估为牙周病的益生菌。
益生元是不易消化的低聚糖,并已被证明可以辅助益生菌治疗口腔疾病。益生元可以刺激有益细菌的生长和活性,同时抑制潜在有害细菌的生长和活性。它们还可以改善粘膜屏障功能、宿主免疫力并增强短链脂肪酸的产生。乳糖、菊粉、低聚果糖、半乳糖低聚糖和木糖均是肠道中广泛使用的常见益生元,而口腔中使用的益生元的研究却非常有限。糖和膳食纤维被认为是肠道乳酸菌的益生元,不适合口腔环境。一些潜在的口服益生元,如木糖醇和阿拉伯糖可以抑制变形链球菌的生长,但也被用于某些乳酸菌菌株的生长。鉴于缺乏一些完美的口服益生元,越来越多的研究试图鉴定新的益生元。一些口腔微生物,例如加氏乳杆菌、唾液乳杆菌、发酵乳杆菌和双歧杆菌在健康的口腔生态系统中更为流行。因此,被认为促进这些微生物生长的益生元方法也可以促进牙周健康。益生菌和益生元可能是预防和治疗细菌性疾病的更好方法,因为它们可以在早期阶段恢复生态平衡或恢复口腔微生物群的生物多样性[30]。但是,重要的是要了解口服微生物组与益生菌之间的相互作用,以及口服益生菌的确切作用方式。此外,需要进行更多的研究来评估益生菌在口腔中的功效和安全性。
4.4 其他调节方式
除上述方法外,还有其他一些口腔微生物群调节方案的研究。基因工程产生的无毒变形链球菌已在体外进行了研究,并被认为可用于控制龋齿。在最近的研究中,Ren等人描述了一种靶向葡糖基转移酶的化合物,葡糖转移酶是变形链球菌的主要毒力因子,在体外和体内均可抑制生物膜的形成和变形链球菌的致龋性[29]。噬菌体是一种病毒,可以通过侵染细菌细胞,破坏其新陈代谢并引起裂解来特异性靶向并破坏引起疾病的细菌。目前已有研究提出使用噬菌体来控制产酸细菌,例如嗜酸乳杆菌(L.acidophilus),以抵抗龋齿的发展。此外,已经设计和开发了许多靶向治疗系统来治疗口腔疾病,例如纤维、条、薄膜和纳米颗粒。结合这些新型药物的治疗方法,对口腔微生物群的调节将是非常有希望更有效地治疗口腔疾病。
总体而言,口腔微生态作为人体微生态系统的一个重要组成部分,在维持人类健康方面起着至关重要的作用。口腔微生物群的改变可能与口腔疾病和全身性疾病密切相关。目前对口腔微生态的研究还处在萌芽状态,关于口腔微生物群在疾病发生和发展中的作用的研究还远远不够。未来准确确定健康和疾病中关键口腔微生物群的研究将有助于更好地开发有效的口腔微生物群调节工具。虽然已经探索和开发了许多用于调节口腔微生物群的新兴策略。即使这样,仍需要进行更多的研究来评估这些方法的有效性和安全性。
近年来,越来越多的研究发现,益生菌不仅可以调节肠道菌群,而且还能够改善口腔菌群,从而在口腔健康的维护、口腔疾病的预防和治疗方面都发挥积极的作用。1985 年,Ishihara 等发现,发酵乳杆菌、唾液乳杆菌等乳酸菌的胞外水溶性成分能够在体外有效抑制口腔致病菌变异链球菌的生长[31]。随后的研究证实,包括乳酸乳球菌、唾液链球菌、双歧杆菌在内的多株乳酸菌都具有类似的口腔菌群调节功能。这些研究均为益生菌在口腔健康维护上发挥更重要作用提供了可能。目前研究已经证明,益生菌通过对致病菌的抑制可预防牙周炎、龋齿、口臭等多种疾病。
5.1 人体口腔益生菌筛选
5.1.1 口腔益生菌种类
目前,口腔中的益生菌主要有乳酸杆菌(Lactobacillus)、双歧杆菌(Bifidobacterium)和肠球菌(Enterococcus),其中双歧杆菌为专性厌氧菌在口腔中的应用研究相对较少。乳酸杆菌多为兼性厌氧菌,适合在口腔中存活定植也是被研究得最多的益生菌种类,主要有植物乳杆菌(L. lantarum)、唾液杆菌(L. salivarius)、发酵乳杆菌(L. fermentum)、鼠李糖乳杆菌(L. rhamnosus)、嗜酸乳杆菌(L. acidophilus)、副干酪乳杆菌(L. paracasei)和罗伊氏乳杆菌(L. reuteri)。此外,屎肠球菌在口腔中也有相关研究。
5.1.2 口腔益生菌选择条件
目前,国内外的益生菌制品种类繁多并形成了产业规模,尤其是日本和欧盟,在中国的发展也是日新月异。应用方面,在食品、保健品、药品等领域已有多种益生菌制剂问世,其中在食物中的应用更为广泛,利用益生菌防治口腔疾病的研究正逐渐成为国内外研究热点。理想的口腔用益生菌需具备特定的性能,如图1所示,根据这些特点可在众多益生菌制剂中选择适宜的益生菌,用于口腔护理产品研究开发。

图1 理想口腔益生菌应具备特性
随着对益生菌制剂的深入研究,科学家发现活菌制剂存在一些潜在的安全隐患,如:菌体突变,菌体可能因变异而产生一定的毒性;非正常部位转移,菌体可能离开肠道、口腔等正常的定植部位,进入机体的其它部位进行繁殖(血液、胸腔等),引起病变;
抗药性基因转移,可能会增加致病菌杭药性的危险。尤其对一些免疫力低下的病人而言,服用活茵制剂很容易引起病理反应。国际微生物学会联合会(IUMS)通过临床资料解释和推断,乳杆菌及其相关微生物依然存在一定的危险性,见表1[32]。与此同时,由于需要维持一定数量的活菌,活茵制剂的生产保存均较为困难,质量稳定性不高。为此,本文在后续的功效评价模型和产品开发中所采用的益生菌均为灭活的益生菌冻干粉。

表1 益生菌的安全性
5.2 益生菌对口腔致病菌生长抑制作用评价模型建立
益生菌的作用机制主要有①黏附机制:益生菌通过黏附占据口腔黏膜上的结合点,从而减少口腔致病菌在口腔环境中的定植;
②聚集和生物膜的形成机制:益生菌通过自聚集、共聚集与形成生物膜从而抑制致病菌的生长、形成阻止致病菌定植和感染的屏障;
③免疫调节机制:益生菌的产物及其菌体成分能够激活免疫应答,当益生菌进入宿主中,宿主免疫系统的淋巴细胞和巨噬细胞等多种效应细胞被激活,使其释放出多种细胞因子,从而提高机体自身等防御功能。
5.2.1 实验材料
①灭活的益生菌冻干粉;
②口腔厌氧致病菌:牙龈卟啉单胞菌、变异链球菌以及具核梭杆菌。
5.2.2 口腔厌氧致病菌生长曲线的测定
①口腔厌氧致病菌活化:牙龈卟啉单胞菌、具核梭杆菌、变异链球菌-20℃菌种(10mL西林瓶)→4℃溶解(约30min可融化)→2mL一次性无菌注射器吸取少量菌液(几滴)滴在BHIA平板, 37℃厌氧培养48h。
②吸光度测量:挑取平板上单菌落接种到10mL BHI试管中,37℃厌氧培养一定时间段,取样,于紫外可见分光光度计600nm波长条件下测量吸光度;
③生长曲线绘制:以培养时间为横轴,以对应吸光度值为纵轴绘制曲线。
5.2.3 益生菌对口腔致病菌生长抑制作用测定
①益生菌吸光度调整:益生菌液灭活后,取10mL菌液经4000rpm,15min离心分离收集菌体,用2mL PBS洗涤两次后于10mL PBS中重悬;
适当稀释调整菌悬液吸光度A600为0.20~0.30范围内。
②将已调整吸光度的益生菌液与处于对数生长期的致病菌液等量混合,分别在0h、2h、4h、6h、20h、24h,使用吸光度法测定致病菌的生长曲线,以△OD表示。△OD增长越慢,抑制作用越强。实验以没有添加益生菌的致病菌的为对照组。
5.2.4 益生菌A和益生菌B对口腔致病菌生长抑制作用

图2 灭活益生菌对变异链球菌生长抑制作用
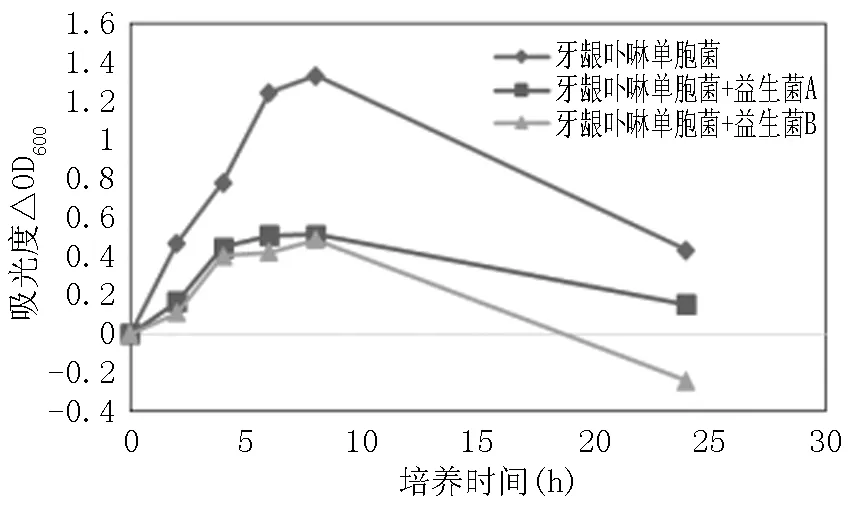
图3 灭活益生菌对牙龈卟啉单胞菌生长抑制作用
从图2及图3可以看出,益生菌A和B对两种致病菌的生长均有明显抑制作用。
5.3 口腔益生菌对口腔致病菌凝集作用评价方法建立
5.3.1 实验材料
①灭活益生菌;
②口腔厌氧致病菌:牙龈卟啉单胞菌、变异链球菌以及具核梭杆菌。
5.3.2 口腔厌氧致病菌生长曲线的测定
①口腔厌氧致病菌活化:牙龈卟啉单胞菌、具核梭杆菌、变异链球菌-20℃菌种(10mL西林瓶)→4℃溶解(约30min可融化)→2mL一次性无菌注射器吸取少量菌液(几滴)滴在BHIA平板,37℃厌氧培养48h。
②吸光度测量:挑取平板上单菌落接种到10mL BHI试管中,37℃厌氧培养一定时间段,取样,于紫外可见分光光度计600nm波长条件下测量吸光度;
③生长曲线绘制:以培养时间为横轴,以对应吸光度值为纵轴绘制曲线。
5.3.3 益生菌对口腔致病菌凝集作用测定
①益生菌吸光度调整:益生菌液灭活后,取10mL菌液经4000rpm,15min离心分离收集菌体,用2mLPBS洗涤两次后于10mLPBS中重悬;
适当稀释调整菌悬液吸光度A600为0.20~0.30范围内。
②将已调整吸光度的益生菌液与处于平台期的致病菌液等量混合,分别在4h和24h,使用吸光度法测定致病菌的上清液浊度变化,以△OD表示。
△OD为负值,表示细胞发生了聚集,△OD数值越小,表示共聚集作用越强。
益生菌存在自凝集作用,测定益生菌自凝集数据用于校正。实验以没有添加益生菌的致病菌的为对照组。
5.3.4 唾液乳杆菌A和B对口腔致病菌凝集作用
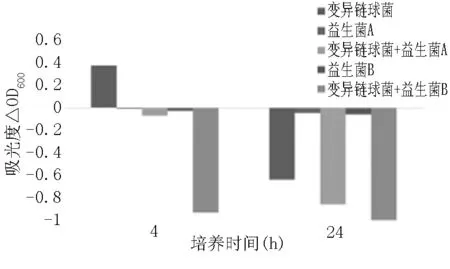
图4 灭活益生菌对变异链球菌的共聚集作用
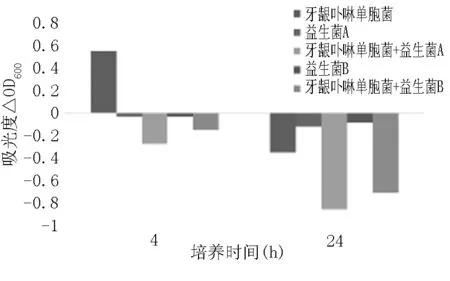
图5 灭活益生菌对牙龈卟啉单胞菌的共聚集作用
选取灭活的益生菌A和B两种益生菌,采用上述凝集作用测试方法,测试其与牙龈卟啉单胞菌以及变异链球菌的共聚集作用,结果如图4、图5所示。
从图4、图5看出,静置4小时后致病菌上清液浊度增加,而添加益生菌的致病菌中,上清液浊度明显下降,即发生了共聚集作用。静置24小时后,致病菌上清液的浊度下降,而添加益生菌的致病菌上清液浊度下降程度更大。说明灭活益生菌对两种致病菌均有较强的凝集作用。
5.4 益生菌牙膏抑菌作用评价方法
5.4.1 实验材料
①菌种:牙龈卟啉单胞菌(ATCC 33277)和变异链球菌(ATCC25175)。
②培养基:胰蛋白胨大豆琼脂培养基(TSA),胰蛋白胨大豆培养基(TSB)。
③仪器耗材:生物安全柜(HR-II-A2)、立式压力蒸汽灭菌锅(LT-CPS38D)、微量移液器(NPX-1000、NPX-100)、漩涡混合器(XW-80A)、一次性塑料培养皿(9×1.5 cm)、恒温培养箱(SPX-250B-Z)、牛津杯(10×8×6 mm)、玻璃试管(15×150 mm)、玻璃推棒等;
④益生菌牙膏(采用二氧化硅体系的牙膏配方制备的牙膏)。
5.4.2 菌悬液的准备
①将细菌接种在TSA斜面培养基上于37℃培养24 h,连续转接2次;
②用1mL灭菌生理盐水(0.85%)将上述斜面洗脱,装于10mL灭菌离心管中,作为初始菌液(100),4℃保藏备用。
③用微量移液器吸取菌悬液1mL于9mL无菌生理盐水中,振荡混匀,此稀释倍数为1∶10。用移液器吸取10倍稀释菌液1mL于9mL无菌生理盐水中,此即100倍稀释。其余以此类推,稀释到10~12梯度;
④选取合适的梯度,按照《化妆品卫生规范(2007版)》分别进行细菌计数。
5.4.3 牛津杯的准备
①牛津杯若干个,置于100mL血清瓶中,于121℃,灭菌20min,烘干;
②使用前,将牛津杯置于玻璃皿中,加入少许无水乙醇,进行灼烧,冷却,备用。
5.4.4 样品的制备
①牙膏样品按照牙膏∶水=1∶4的比例稀释混匀。
②益生菌粉均配置成不同浓度的水溶液。
5.4.5 试验菌接种及加样
①将约15mL 50℃左右的TSA培养基倒入平皿中,冷却;
用微量移液器吸取0.1mL合适浓度(107~108 CFU/mL)的菌悬液于冷却的平板中央,用无菌推棒小心涂布均匀,重复3次,盖好皿盖,置室温干燥。
②用无菌镊子取牛津杯放于平板表面,作好起点标记,逆时针放置4个牛津杯,各牛津杯中心之间相距25 mm以上,与平板的周缘相距15 mm 以上;
在平板上用杜氏小管打孔,控制好中心距离。
③向每个牛津杯中加入200 μL制备好的样品;
向每个孔中滴加2~3滴样品,使样液表面与培养基表面平齐。
④小心移动上述平板,置37℃恒温培养箱中,培养16~18h。
5.4.6 评价标准
用游标卡尺测量抑菌圈的直径并记录,抑菌圈直径大于8mm判为有抑菌作用,直径越大,抑菌效果越强。
5.5 益生菌定量检测方法开发
5.5.1 实时荧光定量PCR操作流程
由于市场上益生菌制品的质量监管和认证,尤其实在定性、定量检测和鉴定方面缺乏科学、合理、快速的方法,菌种滥用、鱼目混珠的现象时有发生,严重影响产品质量。因此,开发一种快速高效的益生菌定性及定量检测方法对产品质量保证具有重要意义。实时荧光定量PCR是在PCR定性技术上发展起来的核酸定量技术,可利用该技术对牙膏样品中益生菌进行定性及定量分析,有效支撑产品功效及宣称。具体操作流程如图6所示。
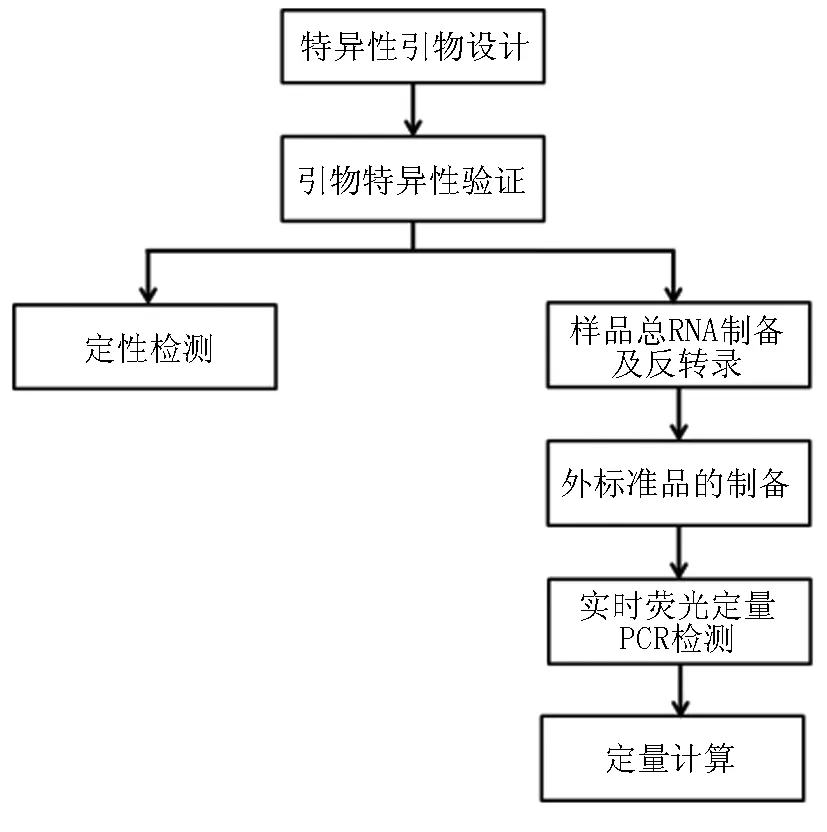
图6 荧光定量PCR操作流程
5.5.2 牙膏中益生菌含量检测
牙膏产品一般由磨擦剂、保湿剂、胶黏剂、发泡剂、香料、调味剂、功效成分等组成,牙膏发泡剂目前广泛使用的以阴离子表面活性剂月桂醇硫酸钠为主,也有添加一些辅助表面活性剂如月桂醇肌氨酸钠、CAB等。发泡剂的存在可能对牙膏中益生菌含量检测造成一定干扰,分别对以下三组牙膏进行实时荧光定量PCR检测,考察表活对定量结果影响,结果如下表2所示。

表2 Q-PCR检测牙膏中益生菌C含量结果
从表2中可以看出,Q-PCR方法检测益生菌数量与理论添加益生菌数差异无显著差异,该方法可较准确实现益生菌定量检测。牙膏体系中表活的存在对定量结果影响较小,在允许误差范围内。
当前,益生菌作为一种新的健康维护的概念引发越来越多的关注,益生菌对人类口腔健康的促进及调节作用也已逐渐被认知。采用益生菌调节口腔生态,制约口腔致病菌的生长,为各种口腔疾病的防治提供了一个新的思路,已成为非常有前景的生物干预手段。大量研究证实,大多数情况下益生菌对人体是安全的,其致病的可能性非常低。尽管如此,益生菌潜在的风险也不容忽视。为了保证益生菌的安全使用,仍需对益生菌的有效性和安全性进行长期深入研究。
本研究概述口腔的微生态研究进展,并对益生菌的典型功效模型进行了基础研究。目前益生菌对口腔微生态的研究还处在萌芽状态,虽然已经有一些新技术新方法开始应用于益生菌对口腔微生态的研究,但这些技术方法仍然存在许多不足,不能完全满足对口腔微生态的研究。相信,随着科学技术的进步,不久的将来将会有更多更好的技术方法应用于口腔微生态的研究。
猜你喜欢致病菌链球菌益生菌链球菌感染与银屑病相关性探究皮肤病与性病(2021年3期)2021-07-30益生元和益生菌促进猪生长和健康猪业科学(2018年5期)2018-07-17益生菌别贪多幸福(2017年18期)2018-01-03神奇的小小肠道益生菌饲料与畜牧(规模养猪)(2017年9期)2017-10-16SSEL结合多重PCR同时快速检测生菜中4种食源性致病菌上海农业学报(2017年4期)2017-04-10中国益生菌网中国乳品工业(2017年1期)2017-02-20变形链球菌蛋白质组学研究进展中华老年口腔医学杂志(2016年6期)2017-01-15食品中致病菌快速检测方法的探讨现代食品(2016年24期)2016-04-28缺血性脑卒中患者龈下菌斑中牙周致病菌检测中华老年口腔医学杂志(2016年5期)2016-03-01肺炎链球菌表面蛋白A的制备与鉴定中国医药生物技术(2015年4期)2015-12-26