努尔满古力·肉孜,彭 敏,张 玲
(广元市中心医院,广元 628000)
恶性增殖是肿瘤的基本特征,肿瘤细胞可能改变物质代谢谱式,以提供细胞增殖所需的原料,调整能量短缺状态[1]。肿瘤细胞代谢重编程(tumor metabolic reprogramming)学说认为,肿瘤细胞代谢调控可能是一种颠覆性的代谢调整,一方面获得必要的能量供应,另一方面平衡能量供应和生物大分子合成,以实现细胞群体的快速增殖[2]。代谢重编程的前提是细胞内基因表达调控,以此引起细胞信号转导途径功能及参与代谢调控的关键酶活性发生相应变化,调整细胞代谢状态,影响代谢网络中营养物质和能量的流向和流量[3]。肿瘤细胞的侵袭转移、逃避免疫和抵制细胞凋亡为肿瘤细胞代谢重编程提供微环境[4]。宫颈癌癌前病变到宫颈癌过程是以人乳头瘤病毒(human papillomavirus,HPV)16型和18型等高危型HPV持续感染加快其病变感染过程,其检出率高达90%以上[5]。按组织病理学分类,宫颈癌分为鳞状细胞癌、腺癌、腺鳞癌及其他少见类型归类,其中80%以上为鳞状细胞癌,15%~20%属于腺癌[6]。宫颈鳞癌的常见感染类型为HPV16,宫颈腺癌的常见感染类型为HPV18[7]。本团队前期研究中采用高分辨魔角核磁共振及超高效液相色谱联合质谱等高通量技术,对宫颈癌、癌前病变组织进行代谢组学研究,明确宫颈鳞癌发生及HPV16感染与肿瘤组织细胞内代谢紊乱有关,其中糖酵解、脂肪酸-β氧化和谷氨酰胺氧化代谢增强,筛选出12种代谢标志物[8-9]。可见,肿瘤发生伴有细胞代谢调控网络发生明显改变,表现为细胞内小分子代谢物水平上发生“微调”,是肿瘤早期预警的重要标记。但是,从HPV感染水平上研究肿瘤细胞代谢调控的研究甚少。本研究通过探讨HPV感染与肿瘤细胞内小分子化合物代谢调控的关系,为诠释宫颈癌发病机制及早期预警提供依据。
1.1 主要仪器设备及试剂 600M核磁共振波谱仪(VARIAN,美国),核磁共振波谱仪工作站(Inova 600M,美国),荧光倒置显微镜(DMI6000B LEICA,德国),倒置显微镜(AE31,中国),共聚焦激光显微镜(C2尼康,日本),Real time RT-PCR SYBR Green1试剂盒(TAKARA,日本),RevertAid First Strand cDNA Synthesis Kit(Thermo公司,美国),SiHa宫颈癌细胞(HPV16阳性)由中国科学院上海生物化学研究所细胞库提供,DMEM培养基、胎牛血清(FBS),双抗(青霉素和链霉素)和胰蛋白酶;
Trizol试剂(DP405北京天根生物公司),氯仿(上海生工),异丙醇、乙醇(上海生工),聚酰胺(新疆恒博鑫业),旋转蒸发仪(Heidolph,德国),二氧化碳培养箱(HERAEUS,日本),生物安全柜(KS-18,Hereaus,德国)。
1.2 HPV16编码基因E6和E7的RNAi载体构建 根据HPV16编码基因E6或E7在线数据库序列,设计2对shRNA寡核苷酸片段,其中一对为E6特异性片段,另一对为E7基因特异性片段,见表1。通过RNAi寡核苷酸双链的生成反应、质粒表达载体链接(克隆)、测序鉴定等过程,小规模制备用于转染哺乳动物细胞的质粒。

表1 HPV16编码基因相应的RNAi寡核苷酸单链信息
1.3 建立HPV编码基因RNAi细胞模型 在常规细胞培养条件下,用含10%胎牛血清、100μg/mL链霉素的DMEM全培养基培养SiHa宫颈癌细胞。细胞融合度达80%时,用胰蛋白酶(0.25%)消化收集细胞。选择3μL X-tremeGENE HP DNA Transfection Reagent(Roche公司)添加至1μg质粒DNA/100μL DMEM培养基,分别制备表达E6和E7 shRNA片段的RNAi细胞模型。分组:Control组(未转染组),仅以含10%胎牛血清的DMEM细胞培养液培养人宫颈癌SiHa细胞,在转染步骤加无血清无抗生素DMEM;
pGFP载体组(空白对照组),转染表达pGFP的空载体;
pRNAi载体组,加pRNAi载体,转染HPV16-E6-siRNA和HPV16-E7-siRNA载体并表达GFP的载体,又分为E6-pRNAi载体组,E7-pRNAi载体组,每组设3复孔。
1.4 激光共聚焦显微镜转染效率的观察 空载体携带绿色荧光蛋白质(GFP),SiHa细胞转染24h后,转染成功的细胞在荧光倒置显微镜或激光共聚焦显微镜下观察看到绿色荧光。
1.5 RNAi抑制HPV16编码基因表达水平的RT-PCR分析 转染后48h,分别收集各组细胞,提取细胞总RNA,以逆转录试剂盒在20μL体系中逆转录成cDNA,以此cDNA为模板,用SYBR Green I嵌合荧光法对E6和E7基因转录水平进行Real-time PCR分析。每组设3个复孔,实验重复3次。
1.6 基于RNAi模型的核磁共振代谢谱分析 样品取出,室温解冻,取450μL加入重水配制的DSS缓冲溶液50μL(0.045mol/L NaH2PO4和0.045mol/L K2HPO4)。1H-NMR采用NOESYPRESAT-ID脉冲序列进行氢谱测定,DSS作为内标,其化学位移定为0ppm。采用预饱和方式抑制水峰,饱和时间2s,采样点数32k,谱宽10000Hz,扫描128次,采样时间均为1.64s,测试温度为25℃。所有1H-NMR谱进行相位和基线校正,并用增宽因子为0.5Hz的指数窗函数进行处理。每一个1H-NMR谱的δ9.0~0.5ppm范围以每段为δ0.003ppm分成2668段进行分段积分并进行归一化处理,同时水分的信号范围δH=4.70~4.95ppm移除掉。数据用SIMCA-P+11软件进行OPLS-DA分析。
代谢物在不同组(实验组、空白对照组和空载体组等)的差异性采用OPLS-DA分析中获得的变量重要性参数(variable importance in the projection,VIP)值确定。VIP>1的代谢物被认为是两组中具有差异性的代谢物,而代谢物含量变化的方向采用OPLS-DA分析中的变量相关系数(correlation coefficient,r)判断。

2.1 E6-shRNA和E7-shRNA干扰宫颈癌细胞模型的建立 参照NCBI数据库提供的HPV16基因组序列,设计一系列E6和E7 mRNA特异性小干扰发夹RNA(small hairpin RNA),并选择同步表达报告基因GFP(绿色荧光蛋白质)和shRNA的pcDNA3质粒载体,构建HPV16-E6-shRNA和HPV16-E7-shRNA表达载体。转染SiHa宫颈癌细胞(HPV16阳性),通过不同载体的抑制效率筛选,建立E6-shRNA和E7-shRNA干扰宫颈癌细胞模型。激光共聚焦成像观察,不同表达载体转染宫颈癌细胞后,均有细胞群体发出强烈的荧光,见图1。
RNAi片段表达水平与GFP报告基因表达同步,根据荧光观察数据,推断shRNA干扰效率较高。定量RT-PCR法结果显示,sh-RNA干扰后,E6和E7 mRNA两种由HPV16编码基因的表达水平降低,见表2。提示shRNA表达后,可能影响细胞内相对应的目标mRNA稳定性,引起mRNA片段降解。
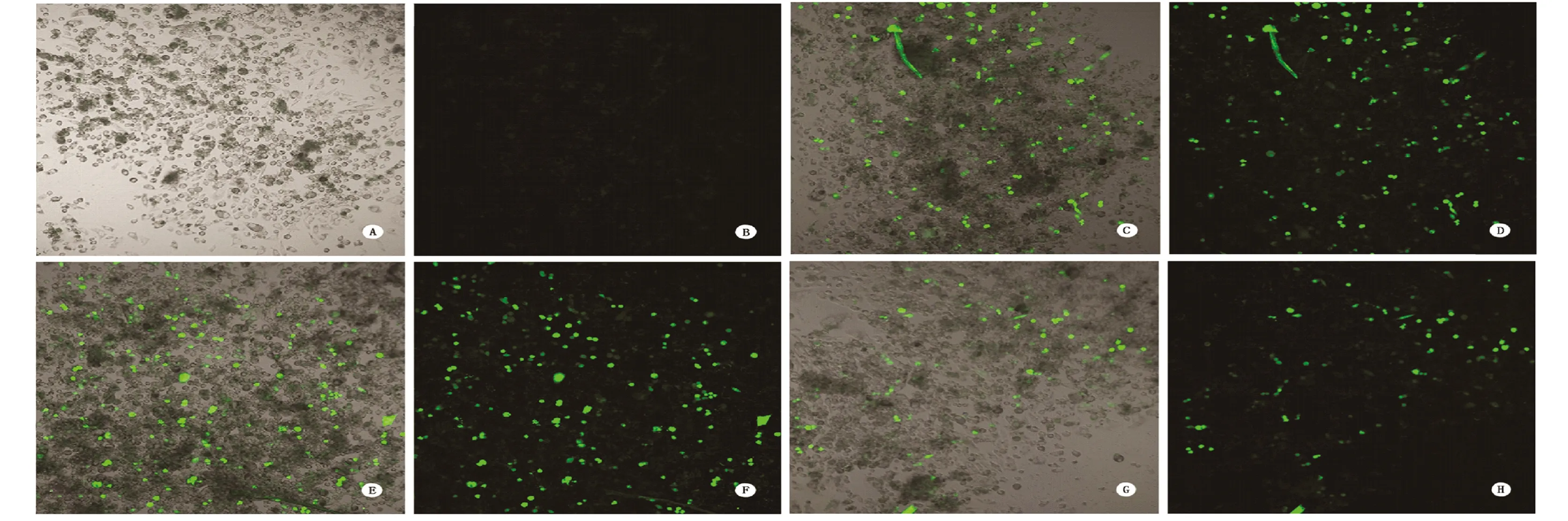
图1 RNA干扰前后SiHa宫颈癌细胞内GFP(绿色荧光蛋白)激光共聚焦成像(10×10)

表2 RNAi抑制对SiHa宫颈癌细胞内E6和E7基因表达水平的影响
2.2 HPV16编码蛋白表达对宫颈癌细胞代谢谱的影响 CPMG图谱分析结果显示,7.80~0.50ppm范围内,1H-NMR检测出13种小分子化合物表达水平存在差异,其峰值未发生重叠,满足进一步数据分析的条件。
对1H-NMR谱进行CPMG分段积分及积分值OPLS-DA分析,获得二维主成分得分图(scores plots)和三维空间分布图(3D plots)。选择性抑制HPV16 E6及E7表达可能影响细胞内代谢调控,引起代谢谱发生变化,与空白对照或GFP空载体转染组比较,包括上述小分子化合物在内的代谢谱发生明显差异,但在空白对照与GFP空载体组未发生明显变化。
在OPLS-DA分析基础上,计算13种代谢物的相关系数表,正值表示代谢物含量降低,负值表示代谢物含量升高,见表3。选择性抑制HPV16编码的E6和E7蛋白表达,宫颈癌细胞内异亮氨酸(Ilu)、亮氨酸(Leu)、缬氨酸(Val)、酪氨酸(Tyr)和苯丙氨酸(Phenylalanine)等多种氨基酸以及α-、β-葡萄糖(α-and β-glucose)、β-羟丁酸(β-hydrocxy butyrate)、乙酸(acetate)含量显著升高,乳酸(Lactate)、丙氨酸(Ala)、甲酸(formate)、甲基组氨酸(Methylhistidine)含量显著降低,提示抑制HPV16编码蛋白质表达后,恢复氨基酸代谢,抑制肿瘤细胞内糖的有氧酵解(aerobic glycolysis)等可能在很大程度上逆转HPV16感染引起的细胞代谢异常。

表3 抑制HPV编码基因表达与宫颈癌细胞代谢1H-NMR谱的关系——OPLS-DA相关系数
Warburg效应是指绝大多数肿瘤细胞为满足快速增长的能量需求而在有氧条件下进行的糖酵解[10]。乳腺癌发生伴有磷脂代谢异常,雌激素受体阳性和阴性乳腺癌组织之间可能有多种氨基酸表达差异[11]。早期和晚期结肠癌组织可能发生脂代谢模式转换[12]。本课题组前期研究显示,HPV16感染可能引起宫颈癌组织中α和β-葡萄糖、酪氨酸、苯丙氨酸、乙酸含量显著下降,而乳酸、异亮氨酸、丙氨酸、甲基脯氨酸和低密度脂蛋白含量显著上升,涉及糖脂和氨基酸代谢异常,但是E6和E7基因表达对细胞内代谢的影响尚未见报道[8]。本研究对HPV16阳性宫颈癌细胞进行RNA干扰,明确抑制E6和E7基因表达,通过代谢组学研究,发现13种小分子化合物水平变化,其中α和β-葡萄糖、乙酸、异亮氨酸、亮氨酸、缬氨酸、苯丙氨酸含量显著上升,而乳酸、丙氨酸、甲酸含量下降,提示HPV感染影响细胞内糖脂和氨基酸代谢,其中E6和E7蛋白质可能扮演重要角色。
HPV感染与子宫颈癌发生发展密切相关[13]。几乎所有宫颈癌及绝大部分癌前病变(宫颈上皮内瘤变)组织检出高危型HPV16和18,其主要感染形式是病毒与宿主基因组整合[14]。HPV16编码的E5、E6和E7蛋白可能干扰p53和pRB介导的DNA损伤修复、细胞周期调控网络或免疫监视,是一种较公认的HPV致病、致癌及免疫逃逸机制[15]。据现有研究,HPV16编码的E6蛋白可能促进细胞糖酵解,抑制氧化磷酸化,呈典型的Warburg效应[16]。头颈部肿瘤与HPV感染的关系密切,其组织葡萄糖和核酮糖表达下降也是较典型的Warburg效应[17]。E6和E7表达激活PI3K/Akt/mTOR信号转导通路,促进能量代谢[18]。本研究中,抑制E6或E7蛋白表达后,α和β-葡萄糖含量显著增加,乳酸含量下降,提示宫颈癌细胞内可能存在上述有氧糖酵解过程。肿瘤组织内氨基酸含量变化异常可能是双刃剑,对于其促进或抑制肿瘤细胞增殖存在分歧[19]。肿瘤组织可能极力动用体内游离氨基酸,弥补迅速增长所需的蛋白质合成原料,并以氨基酸分解为代价,解决能量代谢紧张状态[20]。由上述分析,可推断HPV编码的E6和E7蛋白质表达可能促进肿瘤细胞内有氧糖酵解过程,此伴有脂代谢和氨基酸代谢重编程,以维持肿瘤快速生长相关的蛋白质生物合成和能量需求。
猜你喜欢 代谢物氨基酸宫颈癌 阿尔茨海默病血清代谢物的核磁共振氢谱技术分析现代临床医学(2022年4期)2022-09-29一株红树植物内生真菌Pseudallescheria boydii L32的代谢产物*中山大学学报(自然科学版)(中英文)(2022年4期)2022-08-05硫利达嗪抗宫颈癌的潜在作用机制昆明医科大学学报(2022年3期)2022-04-19鹅掌柴蜂蜜氨基酸组成识别研究食品安全导刊(2021年21期)2021-08-30中老年女性的宫颈癌预防中老年保健(2021年12期)2021-08-24宫颈癌护理及心理护理在宫颈癌治疗中的作用及应用中华养生保健(2020年10期)2021-01-18预防宫颈癌,筛查怎么做中国生殖健康(2020年7期)2021-01-18环孢素A代谢物的研究概况Δ中国医院用药评价与分析(2020年3期)2020-05-29噻虫嗪及其代谢物噻虫胺在冬枣中的残留动态研究农药科学与管理(2019年5期)2019-08-13月桂酰丙氨基酸钠的抑菌性能研究中国洗涤用品工业(2019年4期)2019-05-11