马莉萍,马生龙,李云霞,聂莹莹,左显维
(1.甘肃省科学院传感技术研究所,甘肃 兰州 730000; 2.甘肃省传感器与传感技术重点实验室,甘肃 兰州 730000)
汞(Hg)是一种重金属元素,生活中的汞污染主要源自化工、电子、冶金、医药、轻工等行业,Hg2+浓度低至20 nmol/L时便可产生毒性,长期饮用含有微量Hg2+的水会引起蓄积性中毒,严重危害人体的神经系统,因此许多国家及组织都制定了饮用水中Hg2+的最高限量标准[1-2],发展灵敏度高、选择性好的Hg2+检测方法具有重要意义。传统的微量Hg2+检测方法有原子吸收法[3]、荧光法[4]、质谱法[5]和电化学方法[6]等,但这些检测方法对实验人员的技术专业性要求较高且耗时长,且检测设备庞大不便携,无法对突发重金属污染事件做出快速响应。随着重金属污染情况的发展及其严重危害性的不断显现,除了要从源头避免重金属污染,发展快速、便携、低成本的重金属检测技术也显得尤为重要。
随着各学科的不断发展,检测技术也逐渐变得多元化,学科间的相互结合逐渐被应用到检测中。如利用生物酶、核酸适配体、抗原抗体构建的生物传感器,均成功实现了水中Hg2+的检测。核酸适配体是通过SELEX技术从随机的寡核苷酸库中筛选得到的寡核苷酸单链,由20~60个核苷酸组成。与传统的抗原-抗体相比,核酸适配体不仅具有良好的亲和性和选择性,而且易于化学合成和功能化修饰,为构建新型传感器提供了新的思路和平台。目前核酸适配体技术已经广泛应用于核酸[7]、蛋白质[8]、金属离子检测[9]、靶向和生物成像[10-11]等相关领域。
有研究表明,Hg2+与胸腺嘧啶(T)共价结合形成稳定的 T-Hg2+-T配位结构[12-13],T-Hg2+-T结构的发现为深入研究Hg2+检测技术提供了新的思路。基于这种特殊的T-Hg2+-T配位作用,科研工作者们发展了多种新型生物传感器以用于Hg2+高灵敏度和特异性的检测,其中包括电化学生物传感器[14-17]、荧光生物传感器[18-19]、光纤生物传感器[20]等。这些方法都具有便捷、高灵敏、低成本等显著优点,在Hg2+快速检测中被广泛应用。
研究利用 Hg2+与T形成 T-Hg2+-T 结构这一特性,采用无标记的适配体荧光生物传感器检测Hg2+。该方法操作简便,并为Hg2+的快速、高灵敏检测提供了新思路。
1.1 材料
(1) 试剂 Hg2+适配体链ssDNA Ⅰ(5’-TTC TTT TCT CGC TTG TTT GTT TTT-3’),Hg2+适配体互补链ssDNA Ⅱ(5’-AAA AAC AAA CAA GCG AGA GAA GAA-3’)均由上海生工生物科技有限公司合成。荧光染料10 000×SYBR Green Ⅰ(SGⅠ),购自北京美莱博医学有限公司。汞标准溶液,购自北京北方伟业计量技术研究院。Tris、AgNO3、CaCl2、CuSO4、FeSO4均购自美国Sigma公司,实验用水为超纯水。核苷酸储备液和缓冲溶液在使用前均在4 ℃冰箱储藏柜中保存,所有溶液和缓冲液均用超纯水配制。
1×SGⅠ溶液:将10 000×SGⅠ用Tris缓冲液(0.02 mol/L,pH值7.6 )溶液稀释至100×SGⅠ作为储存液,-20 ℃下避光保存。再用超纯水将其逐级稀释为1×SGⅠ溶液备用。
100 μmol/L Hg2+溶液:取1 003 μL Hg单元素溶液标准物质(100 μg/mL),用超纯水稀释定容至5 mL,即得100 μmol/L Hg2+溶液作为储备液,后续根据实验需求进行稀释。
(2) 仪器 FS5荧光光谱仪(爱丁堡公司,英国);
pH计(上海仪电科学仪器,上海);
H1850 离心机(湘仪,湖南);
超纯水:Barnstead,NANOpureDlamond,≥18.2 MΩ·cm。
1.2 Hg2+检测原理
SGⅠ是高灵敏的核酸荧光染料,其与双链DNA(dsDNA)的亲和力非常高,结合dsDNA后荧光会显著增强,其与dsDNA结合时发出的荧光强度是其与单链DNA(ssDNA)结合时荧光强度的800~1 000倍,并且荧光信号稳定,不会明显受到pH值、温度及作用时间等因素的影响。据此,实验设计了一种基于SGⅠ和适配体技术的新型荧光生物传感器,其检测Hg2+的原理如图1所示。由图1可知,当体系中没有Hg2+时,适配体ssDNA Ⅰ与其特异的互补链ssDNA Ⅱ杂交形成双链结构,加入SGⅠ后发出较强荧光;
当体系中存在Hg2+时,适配体ssDNA Ⅰ能被Hg2+竞争结合形成复配结构,ssDNA Ⅰ的构象由无规则卷曲状态到发卡结构,随后加入适配体互补链ssDNA Ⅱ和SG I,由于ssDNA Ⅰ不能和ssDNA Ⅱ杂交形成双链,导致荧光值低。因此,荧光强度与Hg2+的浓度呈负相关,通过测量SGⅠ的荧光值强度的变化可定量分析Hg2+浓度。
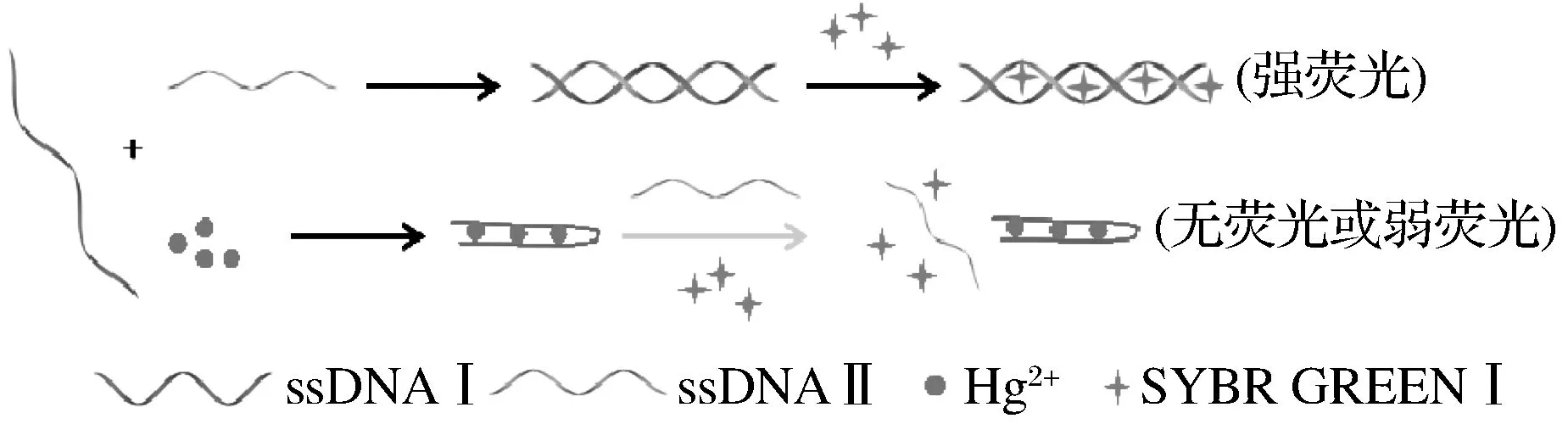
图1 适配体荧光传感器对Hg2+的检测原理Fig.1 Detection principle of label-free aptamer biosensor for Hg2+
1.3 实验方法
(1) 荧光发射光谱表征 分别考察在SGⅠ体系和ssDNA Ⅰ+ssDNA Ⅱ体系下加入不同浓度Hg2+的荧光强度。
(2) Hg2+适配体生物传感器SGⅠ用量研究 取10 μL浓度为1 μmol/L的 ssDNA Ⅰ与等体积浓度为1 μmol/L的ssDNA Ⅱ 避光反应10 min,随后加入不同体积的1×SGⅠ荧光染料,避光反应15 min。最后加入超纯水定容至500 μL,进行荧光测量。
(3) Hg2+的定量检测 在最优实验条件下,取10 μL浓度为1 μmol/L的ssDNA Ⅰ与不同浓度(1.2 μmol/L、1 μmol/L,800 nmol/L、600 nmol/L、400 nmol/L、200 nmol/L、100 nmol/L、10 nmol/L、1 nmol/L)的Hg2+溶液反应,避光反应10 min,然后加入10 μL浓度为1 μmol/L的ssDNAⅡ和10 μL 1×SGⅠ的避光反应15 min,最后加入超纯水定容至500 μL,对照组不加Hg2+,进行荧光检测,建立Hg2+检测标准曲线。
(4) 特异性研究 保持优化好的反应条件不变,分别以500 nmol/L Ca2+、Fe2+、Cu2+、Ni2+、Ag+等金属离子替代Hg2+,检测各金属离子的荧光强度,以相同浓度Hg2+荧光强度为对照,考察该传感器对Hg2+检测的特异性。
(5) Hg2+的加标回收试验 用自来水配制100~800 nmol/L不同浓度梯度的Hg2+样品溶液,检测加入Hg2+后自来水样品的荧光强度,检测结果与标准曲线的荧光值进行对比,计算样品加标回收率。
(6) 荧光测量 荧光光谱测量条件为:激发波长和发射波长分别为:492 nm、525 nm,狭缝宽度为1.5 nm,扫描范围505~600 nm。上述所有实验均在室温下进行。
2.1 荧光发射光谱表征
为验证该实验设计的合理性,考察了各体系的荧光信号,荧光强度检测如图2所示。图2中曲线a为体系中只存在SGⅠ,荧光信号非常弱;
曲线b为体系中没有Hg2+存在,适配体ssDNA Ⅰ与其互补链ssDNA Ⅱ 结合形成双螺旋结构,加入SGⅠ后,dsDNA与SGⅠ结合,荧光信号迅速增强;
曲线c、d为体系中分别加入200 nmol/L Hg2+和600 nmol/L Hg2+,Hg2+能竞争结合在ssDNA Ⅰ上形成复合体,阻碍了ssDNA Ⅰ与其互补链的杂交,此时在体系中加入适配体互补链ssDNA Ⅱ和SGⅠ后,随着Hg2+浓度的增加荧光强度逐渐减小。这表明Hg2+能够与本次实验设计的ssDNA Ⅰ结合,形成局部配位结构,减弱了适配体与其互补链之间的结合,导致形成的双链DNA减少,从而使体系的荧光强度变弱,并且随着加入的Hg2+浓度越高,荧光强度越弱,证明了检测Hg2+的可行性。

图2 荧光发射光谱表征Fig.2 Phenogram of fluorescence spectra of solution inthe presence and absence of Hg2+
2.2 Hg2+检测条件的优化
(1) Hg2+适配体生物传感器SGⅠ用量研究 SGⅠ荧光染料用量的优化结果如图3所示。由图3可知,在适配体及其互补链浓度恒定不变的情况下,加入不同体积的1×SGⅠ荧光染料,随着SGⅠ 加入量的增加,荧光强度也不断增加,当加入8 μL的SGⅠ时体系荧光强度达到最高,此后,随着SGⅠ的增加,荧光强度增加较小,因此后续研究选择8 μL为最优1×SGⅠ量。
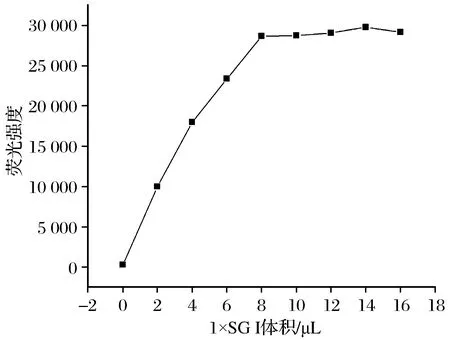
图3 SGⅠ用量与荧光强度变化Fig.3 Variation diagram of fluorescence intensitywith the volumes of SGⅠ
(2) 检测体系pH值优化 缓冲液pH值是决定体系荧光强度的一个重要因素,对检测的灵敏度和重现性具有显著影响。实验分别考察了不同pH值的Tris缓冲溶液对500 nmol/L Hg2+检测荧光强度的影响(见图4),结果表明pH值为7.6的Tris缓冲液检测效果最佳。

图4 不同pH值对500 nmol/L Hg2+荧光检测信号的影响Fig.4 Effect of pH value on Hg2+ fluorescence intensityof solution in the presence of 500nmol/L
2.3 Hg2+的定量检测
研究了该适配体生物传感器对Hg2+检测的线性范围,在最优的实验条件下,向体系中加入不同浓度的Hg2+,荧光强度检测如图5所示。随着Hg2+浓度的增加,与Hg2+结合的适配体ssDNA Ⅰ就越多,导致与ssDNA Ⅱ互补识别的ssDNA Ⅰ减少,因此荧光强度逐渐变弱。

图5 不同浓度Hg2+的荧光光谱Fig.5 Fluorescence spectra of different concentrations of Hg2+
在10 nmol/L~1 μmol/L范围内,Hg2+浓度与荧光强度比值(F/F0)呈线性关系(见图6),其线性方程为y=-0.000 446 8x+0.881 5,相关系数(R2)为0.99,Hg2+的检出限为1 nmol/L。
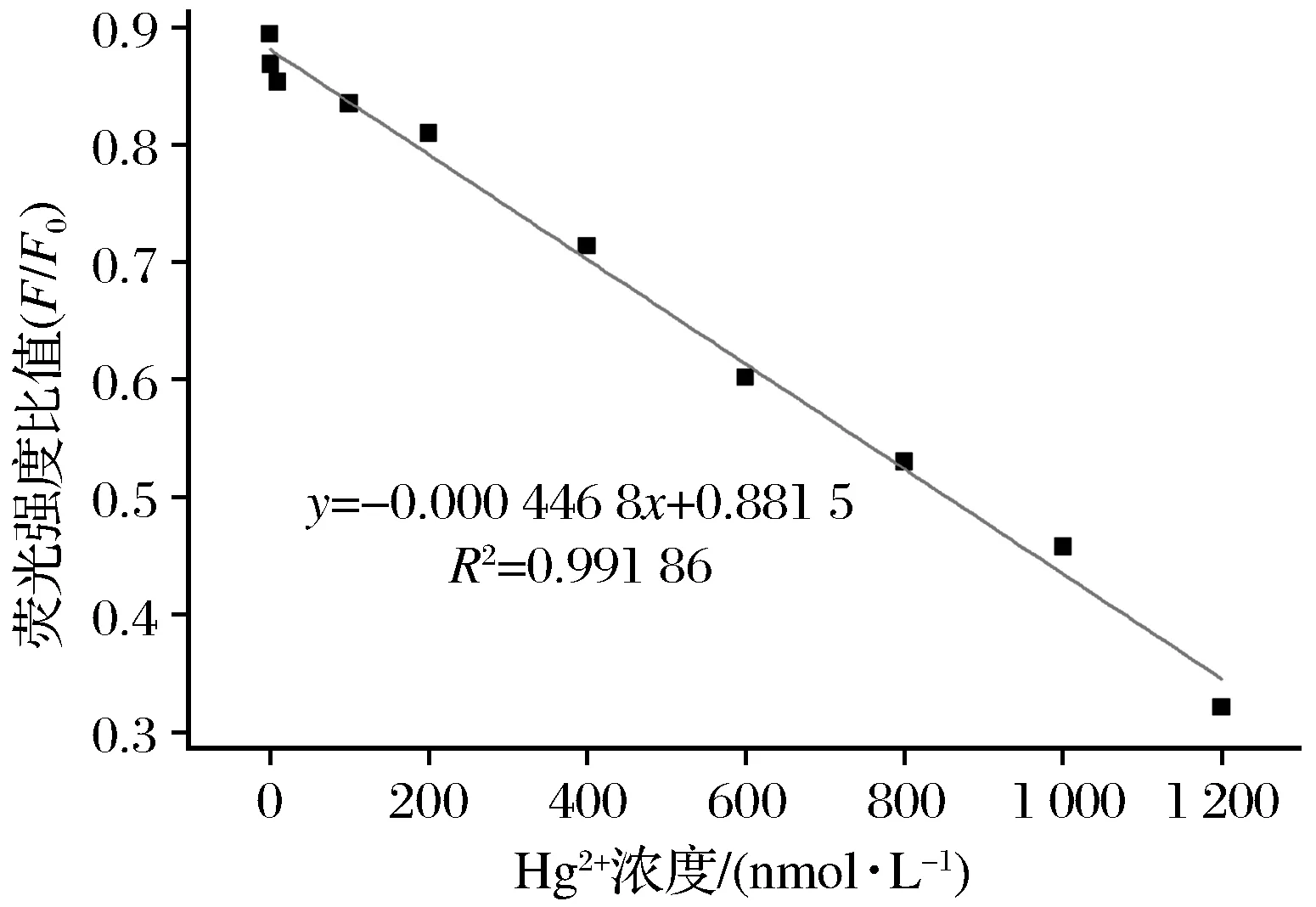
图6 荧光信号与Hg2+浓度的线性关系Fig.6 Linear relationship between fluorescence intensityand Hg2+concentrations
2.4 特异性研究
为了证实传感器对 Hg2+检测的特异性,测定了其他离子的干扰实验。在其他试剂和反应条件不变的条件下,以100 nmol/L Hg2+作为对照组,向样品溶液中分别加入500 nmol/L Ca2+、Fe2+、Cu2+、Ni2+、Ag+、Hg2+,检测不同金属离子的荧光强度,并与对照组进行比较,结果如图7所示。图7显示:加入Hg2+的体系荧光强度比值(F/F0)最小,而加入其他金属离子的体系F/F0变化不大,表明传感器对Hg2+测定有较好的特异性。

图7 传感器检测Hg2+特异性实验结果Fig.7 Specific experiment results of Hg2+detected by sensor
2.5 样品Hg2+加标回收检测
为验证该方法在实际样品检测中的可行性,利用该传感器检测自来水样品中Hg2+。向自来水样中分别加入不同浓度(200 nmol/L、400 nmol/L、600 nmol/L)的Hg2+,对比荧光检测结果与标准曲线的荧光信号,结果见表1。由表1可知,Hg2+在自来水样品中的回收率分别为87.74%、100.68%、99.05%,平均回收率为95.8%,结果表明该方法可用于实际样品分析。

表1 自来水中不同浓度Hg2+的检测结果Table 1 Detection results of different concentrations of Hg2+ in tap water
基于核酸适配体错配结合Hg2+的原理,结合特异性双链荧光染料SGⅠ,构建了一种基于SGⅠ的新型适配体荧光生物传感器,以此建立了高灵敏度、快速、便携的Hg2+荧光检测方法。该方法的检测灵敏度可达1 nmol/L,检测Hg2+的线性范围为10 nmol/L~1 μmol/L。在自来水样的Hg2+加标回收检测中,Hg2+平均回收率达到95.8%。与传统的检测方法相比,其具有操作简便、灵敏度高、特异性好的优点,在水体Hg2+含量的检测中具有较好的应用前景。
猜你喜欢超纯水特异性荧光Synthesis of new non-fluorous 2,2"-bipyridine-4,4"-dicarboxylic acid esters and their applications for metal ions extraction in supercritical carbon dioxide中南民族大学学报(自然科学版)(2022年3期)2022-05-08小水量超纯水制备系统的最佳工艺选择节能与环保(2022年3期)2022-04-26干式荧光发光法在HBV感染诊疗中应用价值昆明医科大学学报(2021年8期)2021-08-13高荧光量子产率BODIPY衍生物的荧光性能研究中央民族大学学报(自然科学版)(2018年3期)2018-11-09精确制导 特异性溶栓中国医疗保险(2017年5期)2017-05-17BOPIM-dma作为BSA Site Ⅰ特异性探针的研究及其应用三峡大学学报(自然科学版)(2016年6期)2016-04-16重复周围磁刺激治疗慢性非特异性下腰痛的临床效果中国康复理论与实践(2015年10期)2015-12-24儿童非特异性ST-T改变现代电生理学杂志(2015年1期)2015-07-18杂铜冶炼厂超纯水管路系统的设计中国有色冶金(2014年6期)2014-08-10Sartorius arium pro 超纯水系统上海计量测试(2012年2期)2012-04-14