贺章敏,钟雯婕,高翔,宋锦璘
过氧化物酶体与线粒体的氧化还原相互作用及其在疾病中的研究进展
贺章敏,钟雯婕,高翔,宋锦璘
重庆医科大学附属口腔医院正畸科 口腔疾病与生物医学重庆市重点实验室 重庆市口腔生物医学工程重点实验室,重庆 401147
过氧化物酶体与线粒体是活性氧调控的关键细胞器,二者相互作用维持细胞内氧化还原稳态,但其机制尚不明确。二者的相互作用异常与细胞器生物发生缺陷相关疾病、衰老及病毒感染等的发生发展相关。本文综述过氧化物酶体与线粒体在氧化还原稳态调控中的相互作用及机制研究进展,并阐述这种氧化还原相互作用异常在疾病中的作用,为深入研究过氧化物酶体与线粒体的氧化还原在疾病发生发展中的作用及疾病的诊断与治疗提供新思路。
过氧化物酶体;
线粒体;
活性氧;
氧化还原
活性氧(reactive oxygen species,ROS)是指超氧阴离子(O2·-)、过氧化氢(H2O2)、羟自由基等含有氧的活性物质[1]。过量ROS堆积会改变细胞氧化还原状态,导致氧化应激,是多种疾病发生发展的危险因素。过氧化物酶体和线粒体是调节ROS生成和清除动态平衡的主要细胞器,二者具有相应的氧化还原系统。过氧化物酶体和线粒体的相互作用对维持细胞氧化还原稳态具有重要意义,近年来备受学者关注。
过氧化物酶体是高度动态的单层膜细胞器,执行超长链脂肪酸的氧化、H2O2的产生与分解及磷脂合成等多种功能,对维持细胞氧化还原稳态至关重要[2]。其氧化与还原相关酶见表1。
2.1 氧化系统
过氧化物酶体是细胞内ROS的主要合成场所之一。在肝脏,过氧化物酶体产生的H2O2是细胞总产量的35%[3]。过氧化物酶体还可生成O2·-,后者可转化为H2O2,进一步增加细胞内H2O2含量。H2O2在Fe2+存在的条件下,通过芬顿反应生成毒性更强的羟自由基,导致细胞脂质过氧化及DNA断裂,诱导细胞发生铁死亡[4]。
2.2 还原系统
经上述途径生成的H2O2主要由过氧化物酶体中含量最丰富的抗氧化酶即过氧化氢酶(catalase,CAT)介导[5]。此外,可消除H2O2的酶还有过氧化物还原酶5和谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)[6]。O2·-可经超氧化物歧化酶催化[7],尽可能多地转化为H2O2进而被清除。

表1 过氧化物酶体的氧化还原系统
线粒体通过氧化磷酸化产生三磷酸腺苷(adenosine triphosphate,ATP)维持细胞的能量供应,保证细胞正常功能。在这一过程中,线粒体ROS(mitochondrial reactive oxygen species,mtROS)作为副产物被生成。与过氧化物酶体类似,线粒体也可清除ROS以避免氧化应激导致的病理改变,见图1。
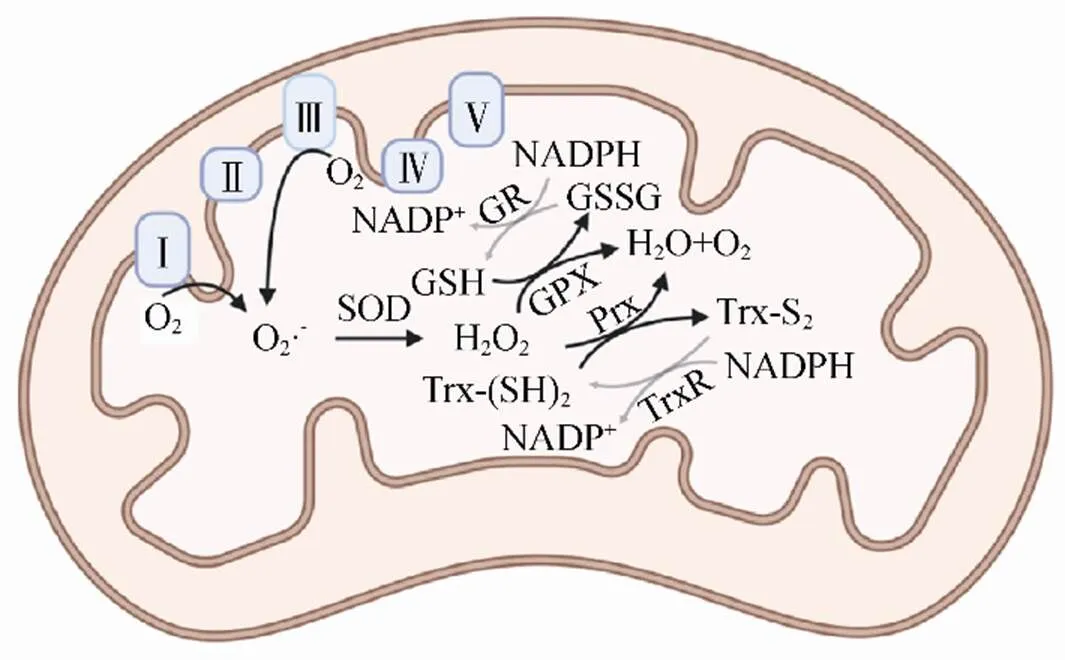
图1 线粒体的氧化还原系统
注:SOD为超氧化物歧化酶;
GSH为还原型谷胱甘肽;
GSSG为氧化型谷胱甘肽;
GPX为谷胱甘肽过氧化物酶;
GR为谷胱甘肽还原酶;
Prx为过氧化物还原酶;
Trx-(SH)2为还原型硫氧还蛋白;
Trx-S2为氧化型硫氧还蛋白;
TrxR为硫氧还蛋白还原酶;
NADPH为还原型烟酰胺腺嘌呤二核苷酸磷酸;
NADP+为烟酰胺腺嘌呤二核苷酸磷酸
3.1 氧化系统
细胞进行生物氧化时,生物大分子产生的还原型辅酶Ⅰ或还原型黄素腺嘌呤二核苷酸被转运至线粒体呼吸链,电子在呼吸链中依次传递,消耗O2并生成ATP。然而,少量电子可漏出呼吸链,直接与O2结合形成O2·-。线粒体含有至少10个ROS产生位点,主要位于复合体Ⅰ和Ⅲ,也有复合体Ⅱ产生H2O2的报道[8]。O2·-进一步转化为H2O2、羟自由基等毒性更强的ROS,严重损伤细胞。
3.2 还原系统
线粒体O2·-的清除主要依赖线粒体基质中的锰超氧化物歧化酶和膜间隙中的铜/锌超氧化物歧化酶,将O2·-转化为H2O2和O2[9]。哺乳动物线粒体缺乏CAT(心脏与肝脏除外),其主要H2O2清除酶是GPX和硫氧还蛋白系统[10]。
过氧化物酶体和线粒体是调节氧化还原稳态的核心细胞器。多数研究表明,在哺乳动物细胞中,线粒体是过氧化物酶体的下游细胞器,对过氧化物酶体中ROS改变十分敏感。
过氧化物酶体中的CAT是联系过氧化物酶体与线粒体的重要分子。通过过氧化物酶体靶向ROS诱导剂增加过氧化物酶体中ROS产生,可导致线粒体破碎、mtROS增加甚至细胞死亡,将CAT过表达至线粒体可抵消此细胞毒性,说明过氧化物酶体导致的线粒体损伤可能由线粒体H2O2增多引起[11]。此外,CAT的水平、活性或输入过氧化物酶体的数量降低,均迅速增加mtROS,导致线粒体膜电位降低和电子传递链效率下降[12]。
过氧化物酶体的生物发生及动力学也可影响线粒体功能。表现在:①过氧化物酶体增殖物激活受体辅助活化因子PGC-1α不仅调节过氧化物酶体生物发生,也在线粒体的生物发生、抗氧化保护及ATP合成中发挥作用[13];
②过氧化物酶体生物合成相关分子Pex5敲除细胞中出现线粒体异常堆积和呼吸效率下降[14];
③Pex3下调影响过氧化物酶体生物发生,增加线粒体分裂[15]。此外,近期发现线粒体外膜蛋白Miro1/2负向调控依赖于DRP1的分裂以调节过氧化物酶体大小和形态,确保后者正常行使代谢功能[16]。
过氧化物酶体与线粒体间氧化还原信号的传递依赖相关信使分子,后者包括ROS/活性氮(reactive nitrogen species,RNS)、ROS/RNS相关分子及脂肪酸代谢产物[17],通过以下机制介导两种细胞器间的氧化还原相互作用。
5.1 信使分子扩散
H2O2可从过氧化物酶体中自由扩散,直接诱导线粒体氧化应激或调节其他非线粒体途径,以影响线粒体的氧化还原功能。某些水溶性代谢物如过氧化物酶体β-氧化产物,则可经过氧化物酶体膜通道蛋白转运至细胞质,调控线粒体氧化还原功能。PXMP2是首个被发现的过氧化物酶体膜通道蛋白,在哺乳动物中普遍表达,可形成直径约1.4nm的非选择性通道,允许分子量上限为300~600Da的化合物扩散至细胞质[18]。
5.2 膜接触位点
膜接触是细胞器间常见的通信方式,这种细胞器间的近距离接触与通过细胞质的分子扩散相比更加快速、精确。膜接触位点(membrane contact site,MCS)发挥作用需要栓系结构,它由细胞器膜蛋白与相对细胞器膜蛋白或脂质相互作用形成,使两种细胞器膜靠近但不融合。研究表明,含有ACBD2/ECI2栓系结构的过氧化物酶体-线粒体MCS在小鼠间充质肿瘤细胞中参与类固醇生物合成相关代谢物的转运[19]。
Esposito等[20]近期在酵母中发现过氧化物酶体Pex11(生物发生相关)与线粒体Mdm34蛋白相互作用,形成过氧化物酶体-线粒体MCS。其中Pex11直接与二者共同的分裂蛋白FIS1作用,推测其可能通过调节细胞器动力学在ROS动态平衡中发挥作用。酵母中Fzo1(人线粒体融合蛋白同源物)与Pex34(哺乳动物Pex16同源物)过表达增加线粒体与过氧化物酶体之间MCS的数量[21]。Fzo1同时定位于线粒体与过氧化物酶体,可作为栓系结构促进细胞器之间β-氧化产物的转运[22]。Pex34是一种在MCS处富集的过氧化物酶体膜蛋白,可促进乙酰辅酶A从过氧化物酶体向线粒体转运[23]。然而,尽管Fzo1与Pex34参与潜在信使分子在过氧化物酶体与线粒体间的交流,但其对细胞器间氧化还原调控的影响仍不明确。
5.3 囊泡运输
近年来,研究发现线粒体与过氧化物酶体间的新联系——线粒体衍生囊泡(mitochondrial-derived vesicles,MDV)。MDV是由线粒体分泌的直径70~100nm的囊泡,可选择性携带货物,并部分与过氧化物酶体融合[24]。线粒体可通过MDV将嵌入性膜脂质和可溶性膜蛋白运输到过氧化物酶体。研究表明,MDV是氧化应激的早期反应[25]。ROS诱导含线粒体锚定蛋白连接酶的MDV生成,后者被运输到过氧化物酶体中,可通过调节过氧化物酶体的形态影响其生理功能[26]。
线粒体和过氧化物酶体共享细胞器膜分裂的关键蛋白。有学者推测,MDV可能将这些蛋白(如FIS1和MFF)从线粒体转运至过氧化物酶体,调节过氧化物酶体形态和功能,但此假说存在争议[27]。由于线粒体可能参与过氧化物酶体的起源,也有学者推测线粒体与过氧化物酶体之间通过MDV的物质转运在过氧化物酶体的形成中发挥重要作用[28]。过氧化物酶体也可能产生囊泡,并将其靶向至线粒体,但支持该现象的实验证据尚不存在。
综上,过氧化物酶体与线粒体氧化还原相互作用的信使分子及作用机制可归纳如图2。尽管已有一定认识,但二者氧化还原相互作用的机制仍有待深入探究。
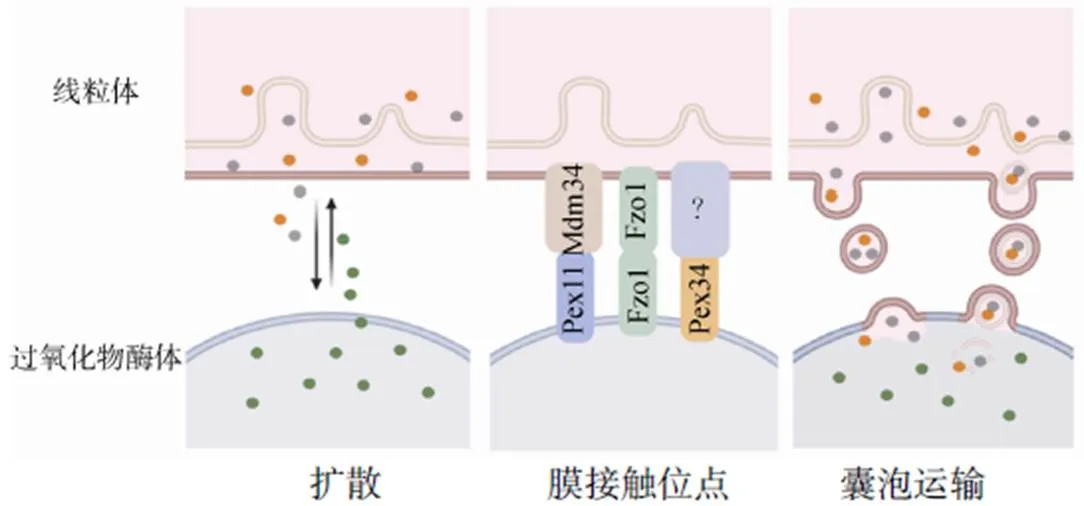
图2 过氧化物酶体与线粒体相互作用的机制
过氧化物酶体和线粒体的氧化还原相互作用紊乱可促进氧化应激相关病理状态,与细胞器生物发生缺陷相关疾病和衰老的发生发展相关。二者还共同参与病毒感染的免疫反应。
6.1 细胞器生物发生缺陷相关疾病
过氧化物酶体或线粒体生物发生缺陷和(或)细胞器内功能蛋白质突变会导致严重甚至致命的遗传性疾病[29-30]。过氧化物酶体生物发生缺陷病指过氧化物酶体生物发生出现异常,细胞内功能性过氧化物酶体缺乏,主要由关键调控基因PEX突变引起。该病患者大多数代谢途径受到影响,代谢功能和神经系统发育严重障碍[31]。某些过氧化物酶体疾病中可发现线粒体超微结构改变和功能障碍,如在过氧化物酶体相关神经退行性变患者中发现线粒体氧化呼吸链障碍、氧化磷酸化异常、ROS增加,导致线粒体肌病。其中,脑肝肾综合征是一种典型过氧化物酶体生物发生缺陷病,通常导致线粒体继发性功能障碍,患儿多系统受累,伴有黄疸、肝功能障碍、严重的肌张力减退、频繁癫痫发作和颅面畸形,通常在出生第1年内死亡[32]。线粒体生物发生缺陷对过氧化物酶体的影响仍有待研究。
6.2 衰老
传统观点认为,衰老是线粒体功能障碍导致氧化还原失衡、ROS堆积造成损伤的结果,且多种衰老相关疾病(糖尿病、帕金森病、特发性肺纤维化等)中均发现线粒体功能紊乱[33-35]。事实上,过氧化物酶体也发生衰老相关改变。在衰老细胞中,受损过氧化物酶体堆积,酶活性特别是CAT活性明显降低,氧化还原失衡,ROS增加,进一步促进衰老。
在衰老及其相关疾病中,过氧化物酶体也可作为线粒体的上游调控后者。在传代晚期的人二倍体成纤维细胞中恢复CAT向过氧化物酶体的输入,可逆转线粒体去极化并延迟衰老相关标志物β-半乳糖苷酶的出现[36]。增加过氧化物酶体增殖及过氧化物酶体抗氧化活性可恢复海马神经元受β-淀粉样蛋白诱导的线粒体功能障碍和神经毒性[37]。
6.3 病毒感染
过氧化物酶体和线粒体在宿主细胞的先天免疫反应中协同对抗病毒感染。哺乳动物免疫细胞表面表达模式识别受体,可识别病毒进入生物体后产生的病原相关分子模式,继而诱导干扰素等产生,形成抗病毒感染的第一道防线。随后,病毒蛋白和线粒体膜间相互作用促进ROS产生,触发宿主抗病毒的先天免疫反应。线粒体抗病毒信号蛋白(mitochondria antiviral signaling protein,MAVS)最初在线粒体中被发现,它的CARD结构域可与RIG-1(一种模式识别受体)N端的caspase招募结构域相互作用,激活干扰素调节因子3和NF-κB通路,诱导Ⅰ型干扰素(type 1 interferon,IFN-1)表达[38]。MAVS也定位于过氧化物酶体中,在病毒感染时诱导快速短暂的依赖于IFN-1的免疫反应[39]。在人类免疫缺陷病毒、仙台病毒、登革热病毒和胞质细菌感染中,过氧化物酶体还可诱导IFN-3型反应,作为IFN-1型反应的补充[40]。因此,过氧化物酶体和线粒体协作在病毒感染及其诱导的氧化应激中发挥作用。
过氧化物酶体和线粒体是细胞内氧化还原调控的关键细胞器,过氧化物酶体可影响线粒体氧化还原状态,二者在ROS相关疾病中协同加重氧化应激损伤。然而,目前学术界对过氧化物酶体与线粒体氧化还原的相互作用仍知之甚少,探究线粒体氧化还原失衡对过氧化物酶体的影响、二者氧化还原相互作用的机制及如何恢复二者间的氧化还原代谢紊乱,对未来相关疾病的防治具有重要意义。
[1] HUANG M Z, LI J Y. Physiological regulation of reactive oxygen species in organisms based on their physicochemical properties[J]. Acta Physiol (Oxf), 2020, 228(1): e13351.
[2] LODHI I J, SEMENKOVICH C F. Peroxisomes: A nexus for lipid metabolism and cellular signaling[J]. Cell Metab, 2014, 19(3): 380–392.
[3] TITORENKO V I, TERLECKY S R. Peroxisome metabolism and cellular aging[J]. Traffic, 2011, 12(3): 252–259.
[4] SIMUNKOVA M, BARBIERIKOVA Z, JOMOVA K, et al. Antioxidant vs. prooxidant properties of the flavonoid, kaempferol, in the presence of Cu(Ⅱ) ions: A ROS-scavenging activity, fenton reaction and DNA damage study[J]. Int J Mol Sci, 2021, 22(4): 1619.
[5] FUJIKI Y, BASSIK M C. A new paradigm in catalase research[J]. Trends Cell Biol, 2021, 31(3): 148–151.
[6] ANIK M I, MAHMUD N, MASUD A A, et al. Role of reactive oxygen species in aging and age-related diseases: A review[J/OL]. ACS Appl Bio Mater. (2022–08–31) [2023–02–10]. https://pubmed.ncbi.nlm.nih.gov/ 36043942/.
[7] WANG Y, BRANICKY R, NOE A, et al. Superoxide dismutases: Dual roles in controlling ROS damage and regulating ROS signaling[J]. J Cell Biol, 2018, 217(6): 1915-1928.
[8] ZHAO R Z, JIANG S, ZHANG L, et al. Mitochondrial electron transport chain, ROS generation and uncoupling (review)[J]. Int J Mol Med, 2019, 44(1): 3–15.
[9] FRYE K A, SENDRA K M, WALDRON K J, et al. Old dogs, new tricks: New insights into the iron/manganese superoxide dismutase family[J]. J Inorg Biochem, 2022, 230: 111748.
[10] MURPHY M P. Mitochondrial thiols in antioxidant protection and redox signaling: Distinct roles for glutathionylation and other thiol modifications[J]. Antioxid Redox Signal, 2012, 16(6): 476–495.
[11] WANG B, VAN VELDHOVEN P P, BREES C, et al. Mitochondria are targets for peroxisome-derived oxidative stress in cultured mammalian cells[J]. Free Radic Biol Med, 2013, 65: 882–894.
[12] WALTON P A, PIZZITELLI M. Effects of peroxisomal catalase inhibition on mitochondrial function[J]. Front Physiol, 2012, 3: 108.
[13] HALLING J F, PILEGAARD H. PGC-1α-mediated regulation of mitochondrial function and physiological implications[J]. Appl Physiol Nutr Metab, 2020, 45(9): 927–936.
[14] PEETERS A, SHINDE A B, DIRKX R, et al. Mitochondria in peroxisome-deficient hepatocytes exhibit impaired respiration, depleted DNA, and PGC-1alpha independent proliferation[J]. Biochim Biophys Acta, 2015, 1853(2): 285–298.
[15] TANAKA H, OKAZAKI T, AOYAMA S, et al. Peroxisomes control mitochondrial dynamics and the mitochondrion-dependent apoptosis pathway[J]. J Cell Sci, 2019, 132(11): jcs224766.
[16] COVILL-COOKE C, TONCHEVA V S, DREW J, et al. Peroxisomal fission is modulated by the mitochondrial Rho-GTPases, Miro1 and Miro2[J]. EMBO Rep, 2020, 21(2): e49865.
[17] DI MEO S, REED T T, VENDITTI P, et al. Role of ROS and RNS sources in physiological and pathological conditions[J]. Oxid Med Cell Longev, 2016, 2016: 1245049.
[18] LISMONT C, KOSTER J, PROVOST S, et al. Deciphering the potential involvement of PXMP2 and PEX11B in hydrogen peroxide permeation across the peroxisomal membrane reveals a role for PEX11B in protein sorting[J]. Biochim Biophys Acta Biomembr, 2019, 1861(10): 182991.
[19] FAN J, LI X, ISSOP L, et al. ACBD2/ECI2-mediated peroxisome-mitochondria interactions in leydig cell steroid biosynthesis[J]. Mol Endocrinol, 2016, 30(7): 763–782.
[20] ESPOSITO M, HERMANN-LE D S, DELAHODDE A. Contribution of ERMES subunits to mature peroxisome abundance[J]. PLoS One, 2019, 14(3): e0214287.
[21] LIAO Y, DONG Y, CHENG J. The molecular determinants of mitochondrial membrane contact with ER, lysosomes and peroxisomes in neuronal physiology and pathology[J]. Front Cell Neurosci, 2020, 14: 194.
[22] SHAI N, YIFRACH E, VAN ROERMUND C, et al. Systematic mapping of contact sites reveals tethers and a function for the peroxisome-mitochondria contact[J]. Nat Commun, 2018, 9(1): 1761.
[23] SCHRADER M, KAMOSHITA M, ISLINGER M. Organelle interplay-peroxisome interactions in health and disease[J]. J Inherit Metab Dis, 2020, 43(1): 71–89.
[24] POPOV L D. Mitochondrial-derived vesicles: Recent insights[J]. J Cell Mol Med, 2022, 26(12): 3323–3328.
[25] PENG T, XIE Y, SHENG H, et al. Mitochondrial- derived vesicles: Gatekeepers of mitochondrial response to oxidative stress[J]. Free Radic Biol Med, 2022, 188: 185–193.
[26] MOHANTY A, ZUNINO R, SOUBANNIER V, et al. A new functional role of mitochondria-anchored protein ligase in peroxisome morphology in mammalian cells[J]. J Cell Biochem, 2021, 122(11): 1686–1700.
[27] SCHUMANN U, SUBRAMANI S. Special delivery from mitochondria to peroxisomes[J]. Trends Cell Biol, 2008, 18(6): 253–256.
[28] 官伟康, 吕静, 杨朝鲜. 线粒体质量控制新途径: 线粒体衍生囊泡[J]. 解剖学报, 2021, 52(1): 152–156.
[29] WATERHAM H R, FERDINANDUSSE S, WANDERS R J. Human disorders of peroxisome metabolism and biogenesis[J]. Biochim Biophys Acta, 2016, 1863(5): 922–933.
[30] GOLPICH M, AMINI E, MOHAMED Z, et al. Mitochondrial dysfunction and biogenesis in neurodegenerative diseases: Pathogenesis and treatment[J]. CNS Neurosci Ther, 2017, 23(1): 5–22.
[31] FUJIKI Y, ABE Y, IMOTO Y, et al. Recent insights into peroxisome biogenesis and associated diseases[J]. J Cell Sci, 2020, 133(9): jcs236943.
[32] SALPIETRO V, PHADKE R, SAGGAR A, et al. Zellweger syndrome and secondary mitochondrial myopathy[J]. Eur J Pediatr, 2015, 174(4): 557–563.
[33] SATHISHKUMAR C, PRABU P, MOHAN V, et al. Linking a role of lncRNAs (long non-coding RNAs) with insulin resistance, accelerated senescence, and inflammation in patients with type 2 diabetes[J]. Hum Genomics, 2018, 12(1): 41.
[34] CHINTA S J, WOODS G, DEMARIA M, et al. Cellular senescence is induced by the environmental neurotoxin paraquat and contributes to neuropathology linked to Parkinson"s disease[J]. Cell Rep, 2018, 22(4): 930–940.
[35] CARDENES N, ALVAREZ D, SELLARES J, et al. Senescence of bone marrow-derived mesenchymal stem cells from patients with idiopathic pulmonary fibrosis[J]. Stem Cell Res Ther, 2018, 9(1): 257.
[36] KOEPKE J I, NAKRIEKO K A, WOOD C S, et al. Restoration of peroxisomal catalase import in a model of human cellular aging[J]. Traffic, 2007, 8(11): 1590–1600.
[37] NELL H J, AU J L, GIORDANO C R, et al. Targeted antioxidant, catalase-SKL, reduces beta-amyloid toxicity in the rat brain[J]. Brain Pathol, 2017, 27(1): 86–94.
[38] FERNANDEZ-RUIZ R, NIEWOLD T B. Type Ι interferons in autoimmunity[J]. J Invest Dermatol, 2022, 142(3 Pt B): 793–803.
[39] MEYER A, LAVERNY G, BERNARDI L, et al. Mitochondria: An organelle of bacterial origin controlling inflammation[J]. Front Immunol, 2018, 9: 536.
[40] ODENDALL C, DIXIT E, STAVRU F, et al. Diverse intracellular pathogens activate type Ⅲ interferon expression from peroxisomes[J]. Nat Immunol, 2014, 15(8): 717–726.
R363
A
10.3969/j.issn.1673-9701.2023.07.024
第66批中国博士后基金面上项目(2019M663893XB)
高翔,电子信箱:xiangg@hospital.cqmu.edu.cn
(2022–08–17)
(2023–02–11)
猜你喜欢细胞器过氧化物线粒体银纳米团簇的过氧化物模拟酶性质及应用黑龙江大学自然科学学报(2022年4期)2022-11-17Co3O4纳米酶的制备及其类过氧化物酶活性河北科技师范学院学报(2022年2期)2022-08-26棘皮动物线粒体基因组研究进展海洋通报(2021年1期)2021-07-23我国科学家绘制“生命暗物质”图谱科学24小时(2021年4期)2021-03-22线粒体自噬与帕金森病的研究进展生物学通报(2021年4期)2021-03-16——可作为磷酸盐库再利用!">植物细胞器DNA的新功能——可作为磷酸盐库再利用!蔬菜(2018年12期)2018-01-16过氧化物交联改性PE—HD/EVA防水材料的研究中国塑料(2016年3期)2016-06-15提高有机过氧化物热稳定性的方法华东理工大学学报(自然科学版)(2015年4期)2015-12-01NF-κB介导线粒体依赖的神经细胞凋亡途径癌变·畸变·突变(2014年1期)2014-03-01线粒体研究方法探讨河北医科大学学报(2010年12期)2010-03-25