周 华
代谢综合征(metabolic syndrome,MS)是一组以体内营养物质代谢障碍为特征的临床症候群,主要的临床表现为肥胖、血脂异常[三酰甘油(TG)升高、高密度脂蛋白胆固醇(HDL-C)降低]、高血压、糖尿病或葡萄糖耐量受损等,发病机制尚未明确,临床上尚缺乏根治性的治疗药物或治疗手段,该病的致死率、致残率极高,是危害全球的公共健康问题之一[1]。病人糖脂代谢异常导致的脂肪在内脏的异常堆积是代谢综合征最为关键的危险因素[2]。研究表明,动物体内的脂肪组织不仅可以产生游离的脂肪酸,参与机体能量的储存,而且还能分泌诸多脂肪细胞因子(ADS)参与炎症、胰岛素抵抗、物质代谢等病理过程[3]。脂肪细胞不仅能分泌多种炎性因子,增强炎性因子的表达,促进炎性介质的浸润,激活更大范围的炎性信号通路,增强脂肪组织中炎症性应激以及胰岛素受体底物1丝氨酸磷酸化水平,最终致使病人出现胰岛素抵抗,推动代谢综合征的发展[4]。匹伐他汀(冠爽)在临床上用于治疗高胆固醇症、家族性高胆固醇症等。临床观察发现,匹伐他汀能明显调控病人的血脂指标,影响病人的脂肪代谢[5]。过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor-α,PPAR-α)/核转录因子κB(nuclear factor κB,NF-κB)通路在多种与脂肪代谢相关的疾病及高脂性脂肪性肝炎、非酒精性脂肪肝等疾病中有重要作用[6]。研究表明,上调PPAR-α能明显减轻糖尿病大鼠因胰岛素抵抗而致的肾损伤[7]。本研究通过构建大鼠代谢综合征模型,从动物肝脏中糖脂代谢的角度,基于PPAR-α/NF-κB信号通路,探讨匹伐他汀对代谢综合征糖脂代谢的影响机制,以期为临床药物的开发利用提供实验基础。
1.1 实验动物 无特定病原体(SPF)级9~10周龄SD雄性大鼠60只,体质量200~250 g,购自湖南省安生美药物研究院有限公司,动物使用许可证号:SYXK(湘)2018-0005,根据我院实验动物管理办法,室温下标准饲料、自由饮水、分笼(4笼)适应性饲养1周后用于试验。
1.2 主要试剂与仪器 匹伐他汀(冠爽,规格:每片2 mg,华润双鹤药业有限公司,国药准字H20080737),二甲双胍缓释片(美哒灵,规格:每片0.5 g,上海上药信宜药厂有限公司,国药准字H20050699)。苏木素-伊红(hematoxylin and eosin,HE)染色试剂盒购自美国Selleck公司。组织裂解液、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、3,3′-二氨基联苯胺(3,3′-diaminobenzidine,DAB)化学发光试剂盒购自北京华夏远洋科技有限公司。PPAR-α、NF-κB抗体购自Santa公司。磷酸盐缓冲液(phosphate buffer solution,PBS)、酶联免疫吸附法检测用白细胞介素-6(interleukin 6,IL-6)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)试剂盒购自北京中杉金桥生物有限公司。空腹血糖(fasting plasma glucose,FPG)、血胰岛素(fasting insulin,FINS)、总胆固醇(total cholesterol,TC)、TG、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、HDL-C购自罗氏诊断产品(上海)有限公司。牛血清白蛋白(bovine serum albumin、BSA)、甲醇、丙酮、二甲苯、中性树胶购自武汉博士德生物有限公司。兔抗大鼠NF-κB、PPARα以及甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体购自美国Cell Signaling Technolohy公司。聚合酶链式反应(PCR)试剂盒、SYBR Green PCR 试剂盒、RNA提取试剂盒、逆转录试剂盒均购自德国Thermo公司。
罗氏Modular P800全自动生化分析仪(瑞士ROCHE公司),AP-960全自动酶联免疫分析仪(日本协和医药株式会社),苏净Airtech超净工作台(北京六一仪器厂),组织包埋机(德国Leica公司,型号:LEICAEG1150),Nikon Ti-U/Ti-s倒置荧光显微镜(日本三菱公司,型号:H-7650),5810R 型高速离心机(日本岛津公司),E-Gel Imager凝胶成像仪(美国Beckma公司)。
1.3 试验方法
1.3.1 模型构建与分组 按照随机数字表法将大鼠分为正常组、模型组、实验组、对照组,每组15只。正常组大鼠始终给予基础饲料喂养,模型组、实验组、对照组大鼠给予高脂、高盐、高糖饲料喂养12周建立代谢综合征动物模型[8]。基础饲料总热量为14.32 kJ/g,主要包括玉米面、小麦麸、大豆油、全麦次粉、豆粕、盐、氯化胆碱、必需氨基酸、矿质元素以及复合维生素等。高脂、高盐、高糖饲料总热量为20.56 kJ/g,主要包括56%基础饲料、15%蔗糖、15%动物脂肪、10%蛋黄等混合均匀后,再额外添加2%的食盐和2%的胆固醇。两种饲料均购自湖南大通农业科技有限公司。
12周后,检测大鼠动脉压,腹静脉采血测定其血糖、血脂水平判断建模是否成功。建模成功后,实验组和对照组大鼠分别给予匹伐他汀和二甲双胍缓释片100 mg/kg灌胃,每日1次;
模型组和正常组给予等剂量生理盐水灌胃,连续给药4周。模型组、实验组、对照组仍给予高脂、高盐、高糖饲料,正常组给予基础饲料喂养,所有大鼠均自由饮水,标准动物房饲养。
末次给药后,禁食12 h,称量各组大鼠体重,腹静脉采血2 mL,离心,留取上清液,低温冷藏待测。麻醉动物后,断头处死,无菌剥离大鼠的胰腺组织、肝脏组织、肾周脂肪组织,依次使用PBS、生理盐水清洗干净,无菌滤纸吸掉水分,称其质量,迅速以液氮封存,低温冷藏待测。大鼠胰腺的脏器系数=大鼠胰腺质量/大鼠体质量×100%,大鼠肝脏的脏器指数=大鼠肝脏质量/大鼠体质量×100%。
1.3.2 大鼠胰腺组织、肝脏组织病理变化的观察 分别取各组大鼠10%的胰腺组织和肝脏组织,生理盐水清洗,4%多聚甲醛固定,梯度乙醇脱水,二甲苯透明,常规切片、贴片、烤片,HE染色,中性树胶封片,显微镜下观察结果。
1.3.3 大鼠血清指标的检测 罗氏Modular P800全自动生化分析仪测定各组大鼠血清FPG、FINS、TC、TG、LDL-C、HDL-C水平,全自动酶联免疫分析仪检测各组大鼠血清中IL-6和TNF-α的含量。同时通过[FPG(mmol/L)× FINS(mU/L)]/22.5计算大鼠的胰岛素抵抗指数(HOMA-IR)[9]。
1.3.4 PCR检测各组大鼠肝脏中糖、脂代谢基因的mRNA表达 取20%的大鼠肝脏组织,常规提取各组细胞的总RNA,测定纯度和完整度,逆转录合成cDNA,PCR仪进行扩增。GAPDH作为内参;
以2-△△Ct表示基因的相对表达量[10]。糖原合成基因(GS2)、胰岛素诱导基因1(INSIG1)、胰岛素诱导基因2(INSIG2),脂肪酸合成的乙酰辅酶A羧化酶基因(ACC)、固醇调节元件结合蛋白基因(SREBP)、脂肪酸合成酶基因(FAS)以及GAPDH的正向序列和反向序列均由湖南润美基因科技有限公司设计完成。各目的基因的引物序列详见表1。

表1 糖、脂代谢基因及其引物序列
1.3.5 免疫组化法检测各组大鼠肝脏组织中NF-κB、PPARα含量 取10%大鼠肝脏组织,用10%的中性甲醛固定,包埋,切片,脱蜡,去除内源性过氧化物酶,PBS修复抗原,分别加一抗(1∶100)4 ℃过夜孵育,次日加入二抗(1∶500)室温孵育,DAB显色,苏木素复染,丙酮梯度脱水,二甲苯浸泡,中性树胶封片,镜检观察并记录实验结果;
用图像分析软件进行系统分析NF-κB、PPARα的阳性细胞比例。
1.3.6 蛋白免疫印迹法(Western Blot)检测各组大鼠脂肪组织NF-κB、PPARα蛋白表达水平 取10%大鼠脂肪组织,裂解后离心留取上清,测定总蛋白浓度后,取50 μg样品,进行电泳、转膜、封闭,加入一抗(均为1∶1 000),4 ℃孵育过夜,加入二抗,DAB显色,成像,Image软件分析各条带的灰度值,以GAPDH作为内参,获得蛋白的相对表达量。

2.1 代谢综合征大鼠的建模情况 基础饲料喂养大鼠(正常组)活动正常,反应机敏,皮毛顺滑有光泽,体重增加稳定;
高脂、高盐、高糖饲料喂养12周后,模型组、实验组、对照组大鼠反应逐渐迟钝,活动量减少,皮毛渐渐失去光泽,变得暗淡粗糙,饮水量明显增多。基础饲料喂养大鼠平均动脉压为(105.78±5.69)mmHg(1 mmHg=0.133 kPa),TG为(2.13±0.49)mmol/L,血糖为(0.85±0.55)mmol/L;
高脂、高盐、高糖饲料喂养大鼠平均动脉压为(131.37±6.71)mmHg,TG为(6.78±0.63)mmol/L,血糖为(2.83±0.66)mmol/L,高脂、高盐、高糖饲料喂养大鼠的平均动脉压、TG、血糖水平明显高于基础饲料喂养大鼠,差异均有统计学意义(P<0.05)。
2.2 各组大鼠胰腺组织、肝脏组织病理改变比较 HE染色结果显示,正常组大鼠肝脏组织结构完整,细胞规则,大小均匀,排列有序,肝细胞索呈放射状排列;
模型组大鼠肝脏组织损伤明显,肝细胞的界限模糊,细胞出现分布较多的脂肪空泡,肝细胞索失去正常结构,排列紊乱。实验组和对照组大鼠的肝脏组织损伤明显缓解,肝细胞排列趋于正常,细胞界限较模型组清晰可辨。详见图1。正常组大鼠的胰腺实质分叶清晰,胰腺组织结构完整,细胞规整排列,胰岛色浅,在胞浆内呈球状,腺泡上皮细胞呈锥形,核质界限清晰,线粒体以及其他细胞器规整地分散在胞核周围,胞浆呈现嗜碱性;
模型组大鼠胰腺组织失去正常形状,腺体内出现大量的空泡变性,结构完整的线粒体数量减少,核质界限不明显,核质固缩严重,细胞内容物明显减少,胰岛β细胞的结构不明,炎性细胞浸润明显;
实验组和对照组大鼠的胰腺组织损伤较模型组明显减轻,腺体内虽有空泡样变性以及少量的炎性细胞,但线粒体数量明显增多,核膜的结构区域正常。详见图2。

图1 各组大鼠肝脏组织病理变化(×400)
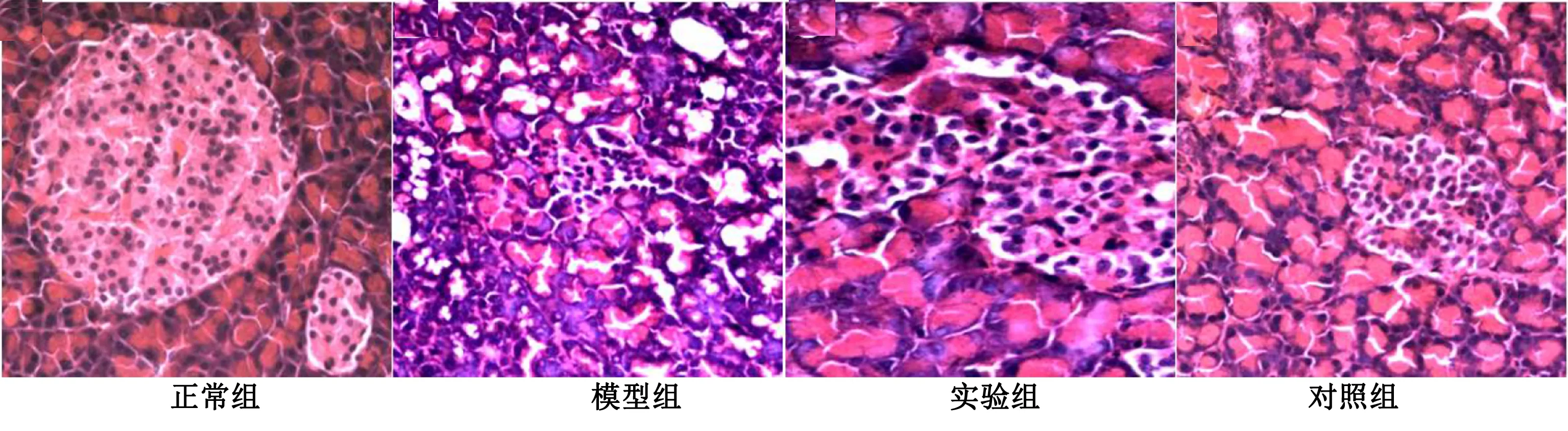
图2 各组大鼠胰腺组织病理变化(×400)
2.3 各组大鼠脏器指数比较 与正常组比较,模型组大鼠的肝脏系数明显升高、胰腺系数明显降低,差异均有统计学意义(P<0.05);
与模型组比较,实验组和对照组大鼠肝脏系数明显降低、胰腺系数明显升高,差异均有统计学意义(P<0.05);
实验组和对照组肝脏系数、胰腺系数比较,差异均无统计学意义(P>0.05)。详见图3。
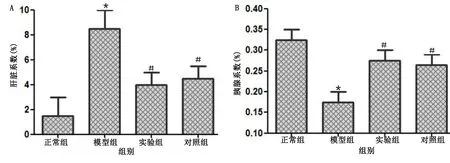
模型组与正常组比较,* P<0.05;
与模型组比较,# P<0.05。
2.4 各组大鼠血清指标比较 与正常组比较,模型组大鼠FPG、FINS、HOMA-IR、TC、TG、LDL-C、IL-6、TNF-α水平均明显升高,HDL-C明显下降,差异均有统计学意义(P<0.05);
与模型组比较,实验组和对照组大鼠FPG、FINS、HOMA-IR、TC、TG、LDL-C、IL-6、TNF-α水平均明显下降,HDL-C明显升高,差异均有统计学意义(P<0.05);
实验组和对照组以上指标比较,差异均无统计学意义(P>0.05)。详见图4。

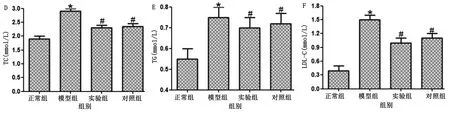
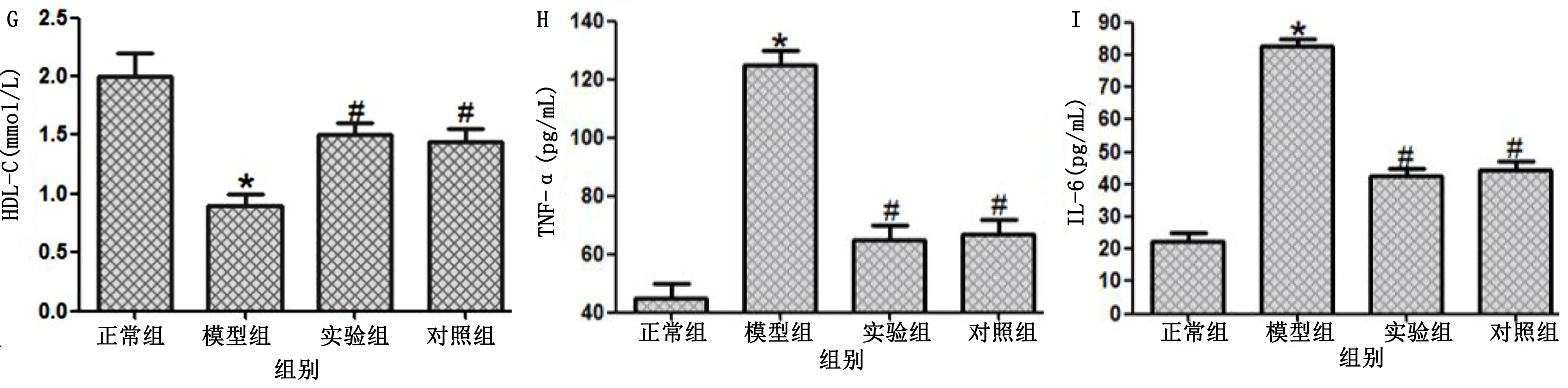
与正常组比较,* P<0.05;
与模型组比较,# P<0.05。
2.5 各组大鼠肝脏组织糖、脂代谢基因表达比较 与正常组比较,模型组大鼠肝脏组织糖代谢基因GS2、脂代谢基因ACC、SREBP、FAS的mRNA表达明显升高,糖代谢基因INSIG1、INSIG2的mRNA表达明显下降,差异均有统计学意义(P<0.05);
与模型组比较,实验组和对照组大鼠肝脏组织糖代谢基因GS2、脂代谢基因ACC、SREBP、FAS的mRNA表达明显下降,糖代谢基因INSIG1、INSIG2的mRNA表达明显升高,差异均有统计学意义(P<0.05);
实验组和对照组以上指标比较,差异均无统计学意义(P>0.05)。详见图5。
2.6 各组大鼠肝脏组织PPARα、NF-κB含量比较 与正常组比较,模型组大鼠肝脏组织中PPARα阳性细胞比例明显下降、NF-κB阳性细胞比例明显升高,差异均有统计学意义(P<0.05);
与模型组比较,实验组和对照组大鼠肝脏组织中PPARα阳性细胞比例明显升高、NF-κB阳性细胞比例明显下降,差异均有统计学意义(P<0.05);
实验组和对照组以上指标比较,差异均无统计学意义(P>0.05)。详见图6、图7。

模型组与正常组比较,*P<0.05;
与模型组比较,#P<0.05。

模型组与正常组比较,*P<0.05;
与模型组比较,#P<0.05。

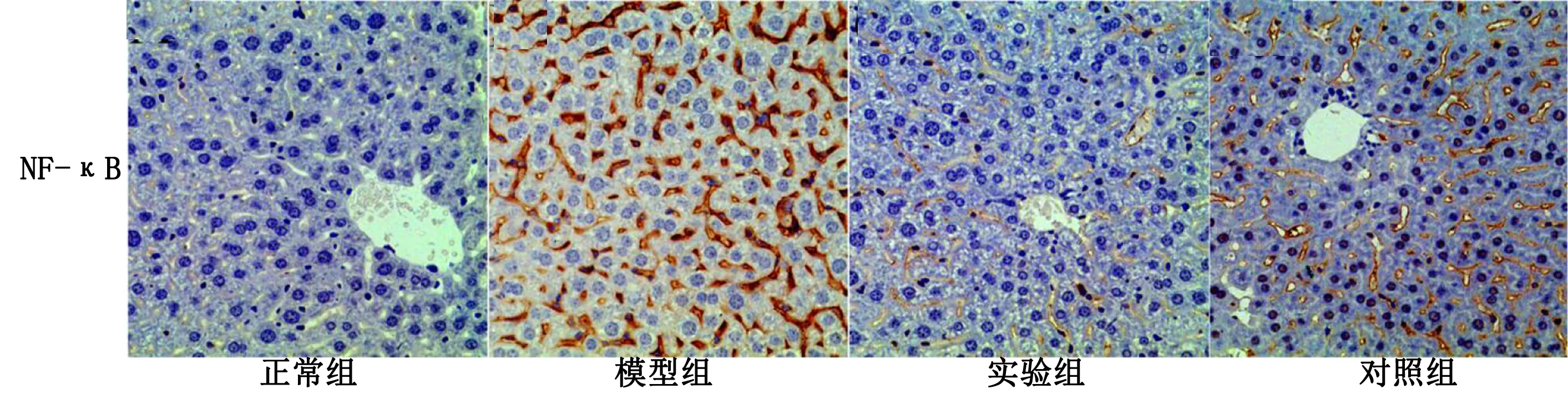
图7 各组大鼠肝脏组织PPARα、NF-κB含量免疫组化图(×400 )
2.7 各组大鼠脂肪组织PPARα、NF-κB蛋白表达比较 与正常组比较,模型组大鼠脂肪组织中PPARα蛋白表达明显下降、NF-κB蛋白表达明显升高,差异均有统计学意义(P<0.05);
与模型组比较,实验组和对照组大鼠脂肪组织中PPARα蛋白表达明显升高、NF-κB蛋白表达明显下降,差异均有统计学意义(P<0.05);
实验组和对照组以上指标比较,差异均无统计学意义(P>0.05)。详见图8、图9。

图8 各组大鼠脂肪组织PPARα、NF-κB蛋白表达条带图

模型组与正常组比较,*P<0.05;
与模型组比较,# P<0.05。
随着人们生活方式与饮食习惯的改变,代谢综合征受多种心血管疾病合并症如高血压、高血脂等的危险因素的影响,其发病率呈现逐年上升趋势[11]。目前,针对该病的临床干预往往倾向于疾病前状态,而忽略病人早期代谢异常的状态,以致难以全面干预疾病的发展,严重制约疗效以及影响病人的远期预后。
匹伐他汀是临床上广泛应用的强效降脂药物。药理学研究显示,匹伐他汀不仅具有较好的抗炎、稳定斑块的作用,还能阻断细胞内胆固醇的合成,调节机体内的血脂水平[12]。冯翔等[13]研究证实,在冠状动脉旁路移植术后使用匹伐他汀对病人进行强化降脂治疗,可明显降低LDL-C水平,且并未增加病人的肝、肾负担,是围术期降脂的理想药物。王丽娟等[14]临床研究表明,在治疗非酒精性脂肪性肝病中,匹伐他汀可降脂、抗炎及改善病人出现的胰岛素抵抗现象,并且对肝功能的影响较低。韩瑞芳[15]研究表明,在冠心病合并血脂升高的病人中长期服用匹伐他汀,能明显降低病人的血脂水平,但并不增加病人发生糖尿病的风险。Carmena等[16]研究显示,降血脂药物瑞舒伐他汀的副作用主要表现为对胃肠道的刺激症状、肌肉酸痛无力,可能导致内分泌失调,而将匹伐他汀应用到早发冠心病的治疗中,不存在上述副作用。司晓凤等[17]研究表明,在急性心肌梗死病人中应用匹伐他汀,能够全面改善病人的血脂水平,升高其脂联素水平,调控血糖水平。本研究在成功构建代谢综合征大鼠后,模型组大鼠出现类似人类的代谢综合征临床症状,采用匹伐他汀进行干预,实验组动物肝脏、胰腺组织损伤明显缓解,血清中血糖、血脂、炎性因子指标明显改善,肝脏组织中血糖、血脂代谢相关基因的表达趋于正常,证实了匹伐他汀对代谢综合征的治疗作用。
NF-κB是炎性应激的调控枢纽,炎性因子经NF-κB转录激活后表达,慢性炎性应激与脂肪在内脏中异常堆积是代谢综合征的基本病理改变[18]。研究表明,在高脂、高糖、高盐的诱导下,NF-κB激活TNF-α、IL-6等炎性因子的表达,而TNF-α、IL-6作为脂肪细胞因子,不仅干扰胰岛素受体的功能,使机体出现胰岛素抵抗状态,还能将炎性信号级联放大,诱发更剧烈的炎症性反应,使病人出现代谢综合征[19]。PPAR-α是一种核受体超家族的转录因子,主要在肝脏、心、肾以及脂肪组织中表达。PPAR-α在机体内主要参与调控糖脂代谢和抑制炎性应激[20]。华慧英等[21]研究表明,在代谢综合征小鼠模型中,PPAR-α不仅能激活多种糖、脂基因的表达,还能降低血脂、升高HDL-C,并且能够抑制炎症性反应的发展,改善小鼠的胰岛素抵抗。本研究中,实验组大鼠肝脏与脂肪组织中PPARα蛋白表达升高,NF-κB蛋白表达下降,推断匹伐他汀可能是通过调节PPAR-α/NF-κB信号来调控代谢综合征大鼠的糖、脂代谢。
综上所述,匹伐他汀能够调节代谢综合征大鼠的糖、脂代谢,可能与PPAR-α/ NF-κB信号有关。但是将匹伐他汀用于临床治疗代谢综合征时仍需进一步考察其远期疗效。
猜你喜欢匹伐他汀胰腺炎性同时多层扩散成像对胰腺病变的诊断效能中国医学影像学杂志(2021年6期)2021-08-13中西医结合治疗术后早期炎性肠梗阻的体会中华养生保健(2020年9期)2021-01-18匹伐他汀治疗高龄老年冠心病合并颈动脉粥样硬化斑块的疗效与安全性中国社区医师(2017年11期)2017-06-15术后早期炎性肠梗阻的临床特点及治疗中外医疗(2016年15期)2016-12-01匹伐他汀治疗糖尿病高胆固醇血症的疗效观察中国实用医药(2016年9期)2016-05-17炎性因子在阿尔茨海默病发病机制中的作用中华老年多器官疾病杂志(2016年9期)2016-04-28哪些胰腺“病变”不需要外科治疗肝胆胰外科杂志(2015年4期)2015-02-2718例异位胰腺的诊断与治疗分析西南军医(2014年5期)2014-04-25匹伐他汀和辛伐他汀治疗不稳定性心绞痛的效果及安全性比较中国当代医药(2014年7期)2014-04-18中西医结合治疗术后早期炎性肠梗阻30例中国中医药现代远程教育(2014年15期)2014-03-01