尹秋玉, 朱雅婷, 许文婷, 欧江华
(1新疆医科大学, 乌鲁木齐 830017;
2新疆医科大学附属肿瘤医院药学部, 3新疆医科大学附属肿瘤医院乳腺外科, 乌鲁木齐 830000)
在一项美国女性乳腺癌筛查中,乳腺癌以最常见的肿瘤,成为癌症第二大死亡原因[1]。三阴性乳腺癌(TNBC)是指雌激素受体(ER)、孕激素受体(PR)以及人表皮生长因子受体(HER2)表达全为阴性的乳腺癌,占乳腺癌类型的20%左右[2]。化疗成为TNBC唯一的全身治疗选择[3]。尽管以铂类为基础的化疗方案还未被批准为乳腺癌的标准治疗方案,但其临床治疗效果较为理想[4-5],然而长期用药发现,随着应用时间的延长,其显示出较为明显的耐药性和细胞毒性,是导致化疗失败的主要原因[6]。
有研究指出,FOXO蛋白有助于调节肿瘤细胞的敏感性和耐药性[7-8],通过多种途径影响肿瘤耐药。为了提供更多的基础理论支持,本实验构建顺铂耐药的TNBC细胞,了解叉头框基因O4(FOXO4)在顺铂耐药TNBC细胞中的作用,再通过构建FOXO4基因过表达细胞株,探讨FOXO4对TNBC耐药细胞顺铂敏感性的影响,为进一步研究FOXO4在乳腺癌顺铂耐药中的作用机制提供新的细胞模型和更多理论支持。
1.1 细胞与药品三阴性乳腺癌细胞(MDA-MB-231)购自武汉普诺赛生物细胞库,顺铂(货号MB1055)购自大连美仑生物技术有限公司,嘌呤霉素(货号A610593)购自上海生物工程股份有限公司。
1.2 主要试剂和仪器DMEM(高糖)培养基、L-15培养基、青霉素-链霉素双抗(10000U)、胰酶(0.25% Trypsin-EDTA)购自美国Gibco公司;
胎牛血清购自澳洲Excell Bio公司;
PBS磷酸盐缓冲液粉剂购自北京中杉金桥生物公司;
DMSO(二甲基亚砜)购自德国Sigma公司;
CCK-8细胞增殖/毒性检测试剂盒购自北京全式金生物技术有限公司;
病毒助感染试剂HitransG A、病毒助感染试剂HitransG P、LV-FOXO4-OERNA、阴性对照病毒、GV492载体,BamHI / AgeI 酶切均购自上海吉凯基因化学技术有限公司。
1.3 方法
1.3.1 耐药细胞株的建立 取人三阴性乳腺癌细胞株MDA-MB-231和BT549培养在含有10%胎牛血清和1%青霉素-链霉素双抗的混合DMEM高糖培养基中。在培养基加入2 μg/mL的DDP,置于37℃、5%CO2饱和湿度培养箱中培养48 h,弃含药培养基,加不含药物培养基,置于37℃、5%CO2饱和湿度培养箱中继续培养,待细胞生长至对数生长期,重复剂量诱导,剂量为2 μg/mL到64 μg/mL递增方式干预。期间需在不同时间段(每周)确定耐药指数(RI),当耐药指数达到4时,认为耐药细胞株建立成功。细胞诱导成功后,将细胞在无药物的培养基中培养3~4周,再进行各项实验。
1.3.2 目的基因片段的制备与慢病毒载体的构建 利用PCR技术扩增FOXO4基因(mRNA序列号:NM_005938)片段。FOXO4引物序列:5′-GCCAAGGTTATTGTCCGCTAAA,3′-GTCCCTCCCACCCTCAATGAAG。根据FOXO4基因全序列设计PCR引物,并在其上下游分别用限制性内切酶BamHI和AgeI酶切相应位点获得线性化载体,然后利用DNA琼脂糖凝胶电泳对PCR扩增产物进行鉴定并回收。将目的基因扩增片段与酶切产物进行连接反应,得到FOXO4基因的重组慢病毒连接产物LV-FOXO4。将连接产物进行转化,挑取单菌落进行质粒DNA提取与双酶切凝胶电泳鉴定。对鉴定正确的质粒进行测序验证,序列对比正确即表明重组慢病毒表达载体构建成功。
1.3.3 慢病毒包装以及滴度检测 采用载体质粒GV492、病毒包装辅助质粒pHelper 1.0和pHelper 2.0三质粒共转染293T细胞,转染48~72 h后收集细胞上清液。在4℃条件下,以4 000 r/min离心10 min。用0.45 μm滤器过滤上清液收集病毒浓缩液,根据荧光显微镜下荧光表达情况应用倍比稀释法检测病毒滴度。
1.3.4 预实验确定最佳感染条件 将培养好的耐药株用完全培养基制备2 mL密度为5×104个/mL的细胞悬液,在96孔板中每孔加入100 μL悬液,37℃培养24 h,至细胞汇合度达30%左右。从冰箱取出阴性对照病毒,冰上缓慢融化,用无血清培养基依次将病毒稀释至滴度为1×108TU/mL,1×107TU/mL,1×106TU/mL,各50 μL。吸掉各孔中上清液,加入病毒及相应助感液,混匀,继续培养。感染12 h后换回正常培养基,感染约48 h,当荧光表达丰度较高时,用显微镜观察荧光表达情况。将感染效率80%左右且生长状态良好的组所对应的感染条件和转染复数值(MOI)作为后续感染实验的依据。
1.3.5 确定嘌呤霉素最适剂量 取生长状态良好、汇合率达90%的耐药株细胞,用完全培养基制备成5×104个/mL单细胞悬液,接种至96孔板中(每孔100 μL,5个复孔)。接种24 h细胞贴壁后,将FOXO4过表达慢病毒在助转试剂A下转染后,使用不同浓度嘌呤霉素(0、0.5、1.5、2.5、5 μg/mL)干预72 h,后于显微镜下观察细胞生长状态,以绝大部分(约90%)细胞死亡所对应的嘌呤霉素浓度作为最佳筛选浓度。
1.3.6 病毒转染和稳转株的筛选 用完全培养基制备2 mL密度为5×104个/mL的细胞悬液,在96孔板中每孔加入100 μL悬液,37℃培养24 h。首先将GV492病毒冰上融化,根据预实验筛选的最佳MOI值和助感液类型进行相应稀释后备用。弃原培养液加入已稀释好的病毒和助感液,37℃、5%CO2恒温培养箱中培养。将实验细胞分为4组:MDA-MB-231组(Control组)、MDA-MB-231/DDP组(耐药组)、NC组(GV492-空载组)以及FOXO4-OERNA组(FOXO4-过表达组)。转染72 h后,NC组和FOXO4-OERNA组更换用含最适嘌呤霉素浓度的培养基培养,每隔3天更换新鲜的含有嘌呤霉素的培养基,待细胞稳定传代后收集细胞进行验证。
1.3.7 qRT-PCR检测FOXO4 mRNA 的表达量 收集转染前后生长状态良好的细胞,弃原培养基,加入1 mL Trizol消化细胞,后续实验按照qRT-PCR实验报告操作,用 2- ΔΔCt法计算FOXO4 mRNA的表达水平。
1.3.8 Western blotting检测目的基因表达 取4组细胞(Control组、耐药组、 NC组以及FOXO4-OERNA组)分别用磷酸缓冲盐溶液洗涤,然后于浓缩胶和分离胶中分别电泳,在4℃、300 mA恒流条件下电转150 min,将蛋白转移到 PVDF膜上。5%脱脂奶封闭,先后加入一抗和HRP标记的二抗,在室温下分别孵育2 h和1.5 h,洗膜、曝光后检测条带灰度值,分析各组细胞目的基因蛋白的相对表达量。
1.3.9 CCK-8法确定耐药指数 取对数期生长状态良好的Control组、耐药组和FOXO4-OERNA组细胞,用胰酶消化制成单细胞悬液,以每孔5×104个/mL密度接种于96孔板中,置于37℃、5%二氧化碳恒温培养箱中培养,加入配置好的10% CCK-8溶液避光培养,酶标仪测定450 nm处的吸光度值,通过计算顺铂半致死浓度(IC50)值确定细胞耐药指数RI和逆转指数,RI=各组耐药细胞系的IC50/敏感细胞系的IC50,逆转指数=IC50(耐药细胞) / IC50(耐药细胞+FOXO4-OERNA)。

2.1 顺铂耐药细胞株的构建通过小剂量浓度梯度法诱导MDA-MB-231细胞,构建MDA-MB-231/DDP顺铂耐药细胞株。与亲本株MDA-MB-231细胞相比,MDA-MB-231/DDP的抑制率更低,差异有统计学意义(P<0.05) (图1)。MDA-MB-231/DDP和MDA-MB-231的IC50值分别为28.344 μg/mL和5.418 μg/mL,RI=5.231。RI>4,表明耐药细胞株构建成功。

DDP concentration (μg/mL)
2.2 FOXO4在TNBC顺铂耐药细胞株中的表达qRT-PCR检测结果显示,目的基因FOXO4在耐药细胞株MDA-MB-231/DDP中的表达较亲本株MDA-MB-231显著降低,差异具有统计学意义(P<0.01)(图2),提示FOXO4可能与TNBC顺铂耐药具有显著相关性。
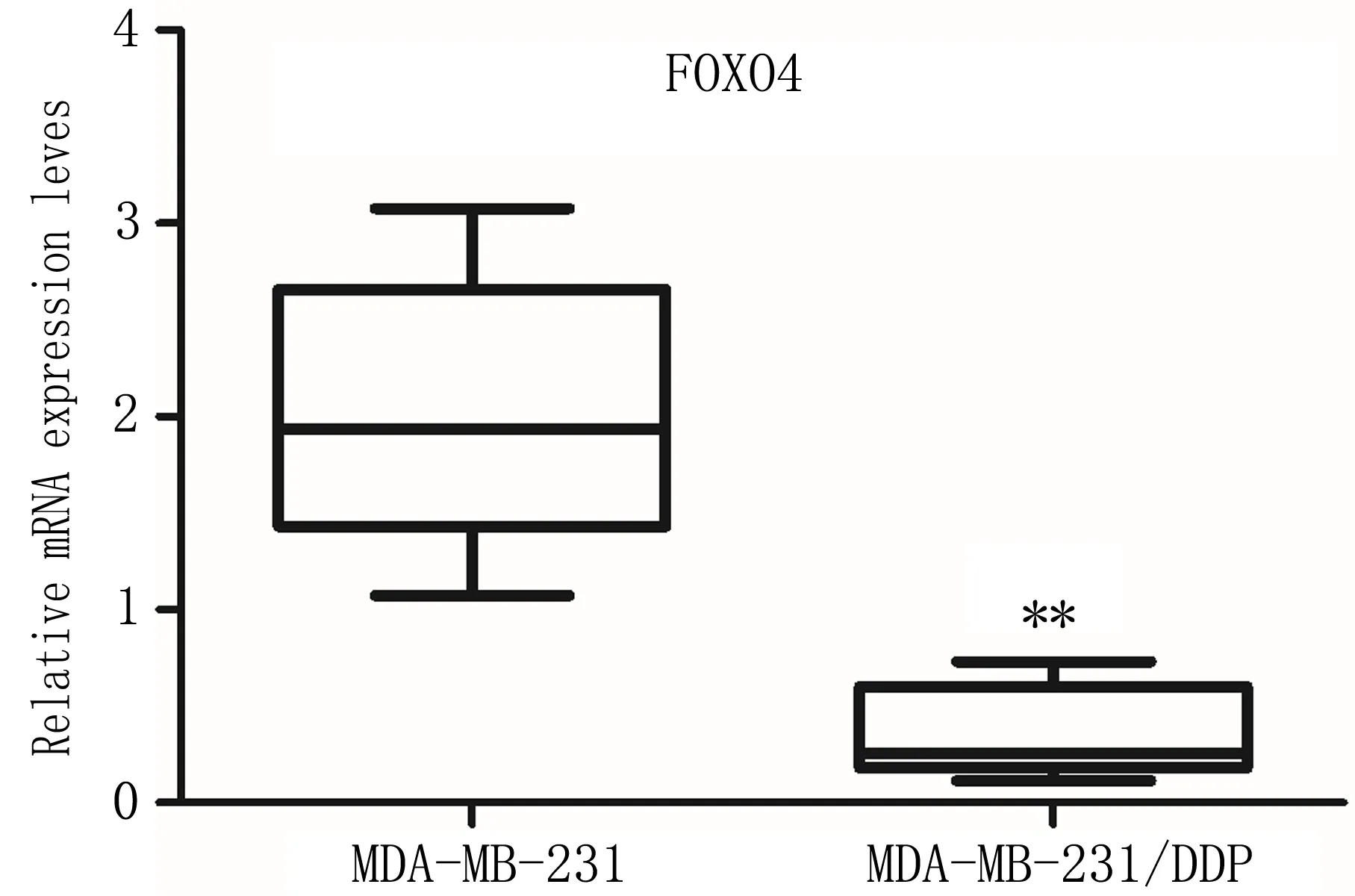
注:与MDA-MB-231组相比, **P<0.01。
2.3 FOXO4过表达稳转细胞株的构建
2.3.1 重组慢病毒质粒鉴定 重组慢病毒质粒LV-FOXO4经BamHI和AgeI双酶切后,进行琼脂糖凝胶电泳(图3),电泳结果可见一条1 500 bp左右的条带,与目的基因理论值1 559 bp相符。重组质粒测序结果见图4,质粒中插入的目的基因片段与FOXO4基因序列一致,表明FOXO4基因成功插入GV492载体中。

注:1,阴性对照(ddH2O);
2,阴性对照(空载自连对照组);
3,阳性对照(GAPDH);
4,转染组 5-12:
1-8号转化子。
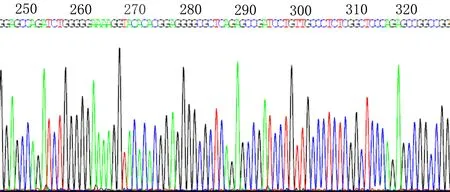
图4 重组慢病毒质粒FOXO4插入片段的部分测序图谱
2.3.2 病毒滴度检测与荧光表达情况 病毒滴度结果显示,FOXO4慢病毒的滴度为3.5×108TU/mL,NC组的滴度为1.0×108TU/mL。转染慢病毒后的LV-FOXO4细胞用嘌呤霉素培养基筛选出FOXO4稳定株,当细胞几乎无死亡现象时,表明细胞具有嘌呤抗性。对照组为未转染病毒的组,暗场观察不到荧光;
加入不同体积的慢病毒后,可明显观察到绿色荧光,表明目的基因慢病毒转染成功(图5)。

图5 荧光显微镜下观察各组细胞绿色荧光表达情况
2.3.3 转染最佳MOI值、助感染液的确定 在不同浓度病毒感染MDA-MB-231/DDP细胞48 h后,倒置显微镜下观察各组细胞荧光表达情况,将感染效率80%左右且生长状态良好的组所对应的感染条件和MOI值作为后续感染实验的依据。根据荧光表达结果显示(图6),确定MOI=100、HitransG A助感液为病毒最佳感染条件。
2.3.4 嘌呤霉素最适筛选浓度的确定 经不同浓度嘌呤霉素(0、0.5、1.5、2.5、5 μg/mL)干预72 h后,于显微镜下观察细胞生长情况(表1)。当嘌呤霉素浓度达到2.5 μg/mL时,细胞死亡率达到90%以上,且随着嘌呤霉素浓度的继续增加,细胞死亡率未见明显升高,差异无统计学意义(P>0.05)。因此,将2.5 μg/mL确定为嘌呤霉素最佳筛选浓度。

表1 不同浓度嘌呤霉素对MDA-MB-231/DDP细胞增殖的影响

图6 MDA-MB-231/DDP细胞感染荧光图片
2.4 qRT-PCR检测FOXO4表达情况qRT-PCR检测结果显示:NC组的基因表达量(1.034±0.302)较Control组(1.051±0.257)无明显差异。FOXO4-OERNA组的基因表达量(3.459±0.983)较Control组和NC组,表达量明显升高,差异具有统计学意义(P<0.05)。表明FOXO4过表达耐药细胞株构建成功,基因表达柱状图见图7。

注:与Control和NC组比较,*P<0.05。
2.5 Western blotting检测目的基因表达情况Western blotting结果显示,耐药组FOXO4蛋白表达明显低于Control组和FOXO4-OERNA组,且FOXO4-OERNA组蛋白表达明显高于NC组,差异具有统计学意义(P<0.05)(图8)。
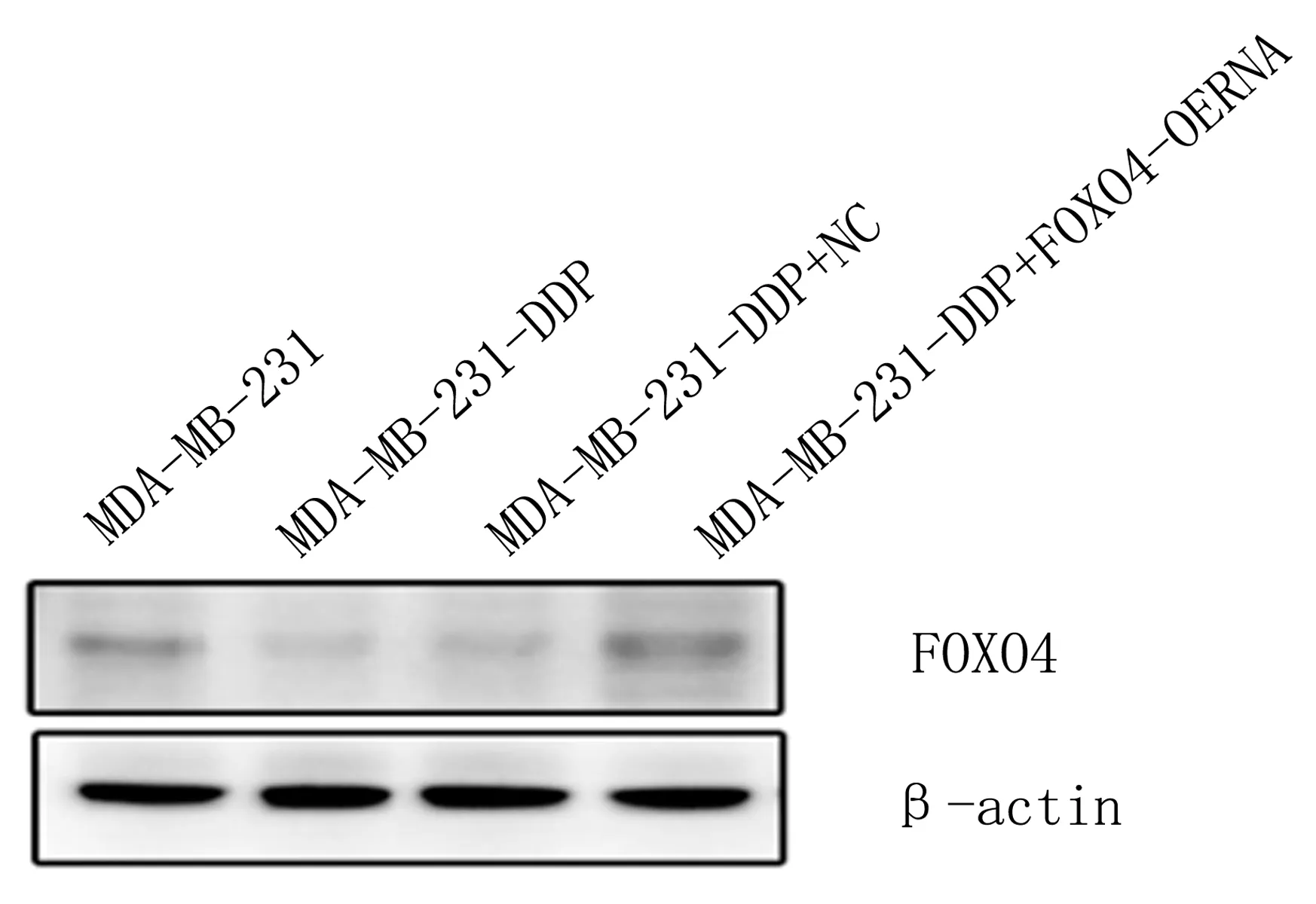
注:与Control组和FOXO4-OERNA组相比, *P<0.05;
与NC组相比,#P<0.05。
2.6 过表达FOXO4可逆转MDA-MB-231/DDP细胞对顺铂的耐药性CCK-8法检测显示, FOXO4-OERNA组对顺铂的IC50值为16.598 μg/mL,耐药指数RI=3.063,与转染前MDA-MB-231/DDP组RI值(5.231)相比,逆转指数达到1.708,差异具有统计学意义(P<0.05)(表2)。

表2 转染前后各组细胞耐药指数和逆转指数
以铂为基础的化疗在三阴性乳腺癌治疗中表现出较好的效果[2],但目前乳腺癌治疗有效率仍然不高,这与治疗过程中产生的耐药性有关,是治疗过程中的一个关键问题[9]。因此,尽快找到影响铂类耐药的有效分子靶点,是目前逆转乳腺癌顺铂耐药的关键。
叉头框基因FOXO4作为公认的肿瘤抑制因子,影响着多种癌症的发生发展[10]。Yu等[11]指出,迷迭香酸通过下调miR-6785-5p和miR-642a-3p以增加FOXO4的表达,从而增强胃癌SGC7901耐药细胞对5-FU的化疗敏感性。在结肠癌中,FOXO4的激活有利于减轻细胞对化疗药物的耐药性[12]。在鼻咽癌中, 上调miRNA-421通过靶向FOXO4的3′端非编码区抑制其转录活性,从而影响细胞增殖[13]。双硫仑由于其抗肿瘤特性,与铜联合疗法目前正在进行转移性乳腺癌患者的II期临床试验,Kaowinn等[14]指出,双硫仑通过诱导FOXO4转录因子的表达,使细胞周期停滞在G1期,从而增强顺铂等化疗药物的抗增殖作用。本实验通过qRT-PCR和Western blotting检测FOXO4在顺铂耐药株和病毒转染株中的表达差异,初步验证了FOXO4基因在顺铂耐药株MDA-MB-231/DDP中的表达量是降低的,与我们的前期研究结果一致:在顺铂耐药患者病理标本中FOXO4呈低表达状态。
逆转录病毒作为近年来使用较为广泛的载体,已被普遍应用于各种癌症的研究[15]。其包括三种类型的载体,分别是慢病毒、腺病毒以及腺相关病毒(AAV)载体。在病毒载体中,慢病毒载体作为肿瘤基因治疗中最有前途的基因传递系统之一,具有进入细胞并将遗传物质稳定运送到目的细胞的能力[16-17],目前广泛应用于过表达实验的研究。慢病毒DNA能够在病毒整合酶的作用下稳定地插入到宿主基因组中,从而将非增殖或缓慢增殖的细胞进行有效转导[18-19]。本研究通过将LV-FOXO4-OERNA慢病毒载体质粒成功转染入耐药细胞株MDA-MB-231/DDP中增强目的基因FOXO4的表达,在一定程度上恢复了TNBC对顺铂的敏感性。Shi等[20]综述了FOXO在卵巢癌铂类耐药的环境中表达量是降低的,这可能与PI3K/Akt/FOXO信号通路有关。本研究通过基因过表达实验,发现FOXO4具有逆转乳腺癌顺铂耐药性的作用,推测FOXO4可能是乳腺癌顺铂耐药的一个重要分子靶点,然而本实验仅局限于细胞方面的研究,缺乏相应的动物实验,其影响耐药的具体机制还需要进一步深入研究。
猜你喜欢细胞株质粒载体创新举措强载体 为侨服务加速跑华人时刊(2022年9期)2022-09-06坚持以活动为载体有效拓展港澳台海外统战工作华人时刊(2020年15期)2020-12-14短乳杆菌天然质粒分类食品科学(2018年10期)2018-05-23TiO_2包覆Al_2O_3载体的制备及表征广州大学学报(自然科学版)(2015年4期)2015-12-23重组质粒rAd-EGF构建并转染hDPSCs对其增殖的影响西南医科大学学报(2015年1期)2015-08-22稳定敲低MYH10基因细胞株的建立医学研究杂志(2015年11期)2015-06-10Rab27A和Rab27B在4种不同人肝癌细胞株中的表达中国当代医药(2015年16期)2015-03-01Survivin-siRNA重组质粒对人神经母细胞瘤细胞SH-SY5Y的作用中国当代医药(2015年9期)2015-03-01稳定抑制PAK2蛋白表达的HUH—7细胞株的建立中国医药导报(2015年27期)2015-02-28BAG4过表达重组质粒构建及转染结肠癌SW480细胞的鉴定西南军医(2015年6期)2015-01-23