李玎玎,刘朝霞
(1.黑龙江中医药大学,哈尔滨 150040;2.黑龙江中医药大学附属第一医院,哈尔滨 150040)
溃疡性结肠炎(ulcerative colitis, UC)以结肠黏膜慢性非特异性炎症为特征,临床表现为腹泻、腹痛和脓血便,病情呈逐渐进展,极易反复发作,为消化内科常见的难治性疾病[1]。UC肠黏膜反复的炎症反应不仅加重患者病情,也是导致其癌变的危险因素,缓解和控制炎症是UC临床治疗的重要方向[2]。目前常规的治疗方案包括抗生素、消炎药、糖皮质激素和免疫抑制剂等,这些药物在 UC急性期具有较好疗效,而长期使用可导致严重不良反应和感染风险[3]。穴位埋线是在传统针刺基础上发展而来的一种中医外治方法,能够通过对穴位的持久刺激发挥对机体的整体调节效果,受到了临床医师的广泛关注[4]。在临床试验和动物模型中发现穴位埋线对UC具有较好的治疗效果,能够有效恢复肠黏膜炎性损伤[5-6]。核因子κB(nuclear factor-κB, NF-κB)介导的炎症信号在UC的发病机制中扮演重要角色,近年研究发现沉默信息调节因子1(silent information regulator 1, SIRT1)的表达和激活可抑制 NF-κB信号的活化,降低肠黏膜炎症反应[7]。本研究通过葡聚糖硫酸钠(dextran sodium sulfate, DSS)法进行UC大鼠造模,通过SIRT1/NF-κB通路探讨穴位埋线疗法对大鼠肠黏膜炎症和屏障功能的影响,探究其发挥治疗作用的可能机制。
1.1 实验动物与方法
选取SPF级远交群(Sprague Dawley, SD)雄性大鼠42只,体质量180~220 g,由黑龙江中医药大学提供,动物许可证号SYXK黑2021-010。于温度(23±3)℃,相对湿度40%~70%,光照和黑暗12 h交替的SPF级实验动物房中适应性饲养1周。所有动物实验均经黑龙江中医药大学附属第一医院实验动物福利伦理委员会审核通过(伦理审批号20210203)。
1.2 主要试剂、材料与仪器
柳氮磺胺吡啶(Salazosulfapyridine, SASP)肠溶片(上海福达制药有限公司,批号 990608),葡聚糖硫酸钠(DSS)(美国MPBiomedicals公司,批号M8669);大鼠髓过氧化物酶(myeloperoxidase, MPO)酶联免疫吸附试验(enzyme- linked immunosorbnent assay,ELISA)检测试剂盒(深圳达科为生物技术有限公司,批号 20210522),抗 SIRT1、核因子-κB(nuclear factor-κB, NF-κB) p65 、 磷 酸 化 核 因 子 -κB p65(phosphorylated NF-κB p65)、核因子κB 抑制因子α(inhibitor kappa B alpha, IκBα)、磷酸化核因子κB抑制蛋白α(phosphorylated inhibitor kappa B alpha, p-IκBα)、IκB 激酶β(IκB kinaseβ, IKKβ)、磷酸化 IκB 激酶β(phosphorylated IκB kinaseβ,p-IKKβ)、乙酰化核因子κB-p65(acetylated nuclear factor- κB p65, AC-p65)一抗(美国 Santa Cruz 公司,批号 072301、051907、059208、052860、054061、053157),RNA提取、反转录试剂盒(日本TaKaRa公司,批号DR060A、D543A),基因上下游引物(上海捷瑞生物工程有限公司,货号 S0415);7号无菌埋线针(镇江高冠医疗器械有限公司),可吸收外科缝线(山东博达医疗有限公司);生物组织切片机(德国Leica公司,型号RM 2235),光学显微镜(德国Leica公司,型号DM750),酶标仪(瑞士 Tecan 公司,型号 GENIOSPLOS),电泳仪和蛋白转膜仪(美国 Bio-Rad公司,型号 EC3型),RCR仪(美国ABI公司,型号9902)。
1.3 造模和干预方法
在42只SD大鼠中随机抽取10只作为空白组,其余大鼠自由饮用3% DSS水溶液7 d以进行UC造模[8]。观察大鼠造模期间一般状况,7 d后随机抽取2只大鼠,解剖后取结肠组织,用苏木精-伊红(hematoxylineosin, HE)染色法观察结肠组织病理学变化。以出现腹痛、腹泻、脓血便等症状及肠黏膜糜烂、溃疡、炎性浸润等病理损伤为模型成功标准[9]。模型制备成功后,将UC大鼠按体质量随机分组为模型组、药物组和穴位埋线组,每组10只。药物组予柳氮磺胺吡啶(SASP)溶液(按每千克体质量 0.5 g)灌胃给药,每日1次,持续14 d;穴位埋线组予穴位简易埋线疗法,取双侧足三里、天枢、上巨虚和大肠俞穴,穴区脱毛备皮及常规消毒后,将0.5 cm羊肠线放入7号无菌埋线针内,推入上述腧穴(足三里和上巨虚穴采用直刺法,天枢和大肠俞穴从下方向上平刺),针刺达到皮下或肌层后退出针芯和针管,线头不外露,消毒干棉球按压针孔。每7 d治疗1次,共3次;空白组和模型组大鼠正常喂养,不予处理。
1.4 观察指标
1.4.1 疾病活动度指数(disease activity index,DAI)和黏膜损伤指数(colon mucosa damage index,CMDI)评分[10]
DAI以体质量、粪便性状和潜血情况为评分标准。体质量不变计0分,体质量较前减轻1%~5%计1分,体质量较前减轻 6%~10%计 2分,体质量较前减轻11%~15%计3分,体质量较前减轻>15%计4分。粪便性状无异常计0分,粪便松散、半稀疏状计2分,粪便稀疏而黏稠计4分。大便无潜血计0分,大便潜血阳性计2分,肉眼可见血便计4分。DAI评分为体质量、粪便性状和潜血3项评分的均值。
CMDI以结肠黏膜病变程度为评分标准。肠黏膜无损伤计0分;肠黏膜轻度充血、水肿,未见糜烂和溃疡者计1分;肠黏膜轻中度充血、水肿,可见糜烂和粘连计 2分;肠黏膜高度充血、水肿,可见坏死和溃疡(直径<1 cm)计3分;肠黏膜可见较大溃疡(直径≥1 cm)和全肠壁坏死计4分。
1.4.2 结肠组织病理学变化
干预后,大鼠经腹主动脉采血后处死,取大鼠部分结肠组织,于4%多聚甲醛溶液中固定48 h,经梯度乙醇溶液脱水,二甲苯浸泡透明后采用液体石蜡包埋,切片机作5 µm组织切片,经苏木精染色,盐酸乙醇分化,伊红染色后,再置于梯度乙醇中脱水,二甲苯透明,中性树脂封片,观察结肠组织病理形态改变并拍照,并对4组大鼠进行组织病理学评分。炎细胞浸润分为无0分、轻度1分、重度2分,浸润深度分为黏膜层1分、黏膜及黏膜下层2分、结肠全层3分,溃疡深度分为无0分、上皮1分、黏膜固有层2分、黏膜肌层3分,各项相加得总评分[11]。
1.4.3 血清和结肠组织中MPO水平
4组大鼠麻醉后经腹主动脉采血,置于无菌试管中,3 000 r·min-1速度离心(离心半径 4 cm)15 min,取上清,分装冻存备用;同时取结肠组织,加入预冷生理盐水后匀浆机研磨制成10%组织匀浆,3 000 r·min-1速度离心15 min取上清,冻存备用。血清及组织匀浆上清于室温环境平衡 1 h,3 000 r·min-1速度离心15 min,加入待测样品10 µL、酶标抗体100 µL和样品稀释剂 40 µL,同时作空白孔和标准孔,置于 37 ℃恒温箱中孵育1 h,随后洗板6次,加入底物溶液,37 ℃下避光孵育15 min,加入终止液,于酶标仪450 nm下检测各反应孔OD值。根据标准品浓度和OD值绘制标准曲线,代入样品孔 OD值,得出血清和组织匀浆样本中MPO的水平。
1.4.4 结肠组织中NF-κB p65的阳性表达
干预后,大鼠经腹主动脉采血后处死,取部分结肠组织,置于4%甲醛溶液中固定48 h,经梯度乙醇脱水,二甲苯浸泡透明后包埋,作5 µm厚石蜡切片。切片经脱蜡、透明和脱水后,滴加3%过氧化氢室温孵育20 min,于pH 6.0的枸橼酸缓冲液中加热煮沸,进行抗原热修复,滴加BSA封闭液孵育20 min,加入一抗4 ℃过夜,加入二抗,37 ℃反应 20 min,滴加 SABC,37 ℃反应20 min,滴加DAB显色,中性树脂封片后观察拍照,每例样本随机取5个视野,计数阳性表达细胞数。
1.4.5 结肠组织中SIRT1/NF-κB通路相关蛋白表达
治疗结束后,大鼠经腹主动脉采血后处死,取结肠组织100~200 mg,分装置于﹣80 ℃冰箱冻存。4组分别选取 5例样本,组织解冻后剪碎,匀浆机匀浆,加入RIPA裂解液,冰上裂解提取组织总蛋白,采用BCA法于562 nm波长下测定总蛋白浓度。分别上样10 µL蛋白样品,经凝胶电泳分离,PVDF转膜后加入 5%封闭液封闭 2 h,滴加 IκBα、p-IκBα、IKKβ、p-IKKβ、NF-κB p65、AC-p65和SIRT1一抗(1:1 000),于4 ℃冰箱过夜,次日 TBST清洗,滴加二抗(1:5 000),室温环境孵育2 h, TBST洗膜,滴加ECL显影剂,凝胶成像系统曝光成像,用Image J软件分析各条带灰度值,以GAPDH为内参计算SIRT1/NF-κB通路蛋白的相对表达量。
1.4.6 结肠组织中上皮钙黏附素(epithelial calcium-dependent cell adhesion molecule,E-cadherin)和紧密连接蛋白的闭合蛋白(occludin)的mRNA表达
干预后,大鼠经腹主动脉采血后处死,取结肠组织50 mg,分装保存于﹣80 ℃冰箱。4组分别选取5个样本,组织解冻后剪碎成若干块,用 Trizol一步法提取结肠组织总RNA,紫外分光光度法检测总RNA浓度,将组织 RNA逆转录得到 cDNA后,以 cDNA为模板检测E-cadherin和 occludin的 mRNA水平。E-cadherin正向引物 5’-CGTGAATGAAGCCCCCATCT-3’,反向引物3’-AAATGGCACCAGTCTCTGGG-5’。Occludin正向引物5’-TTGAAAGTCCACCTCCTTACAGA-3’, 反 向 引 物5’-CCGGATAAAAAGAGTACGCTGG-3’。GAPDH正向引物5’-AACTTTGGCATTGTGGAAGG-3’,反 向 引 物 5’-ACACATTGGGGGTAGGAACA-3’。95 ℃ 5 min预变性,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,40个循环后,72 ℃再延伸5 min,以GAPDH为内参,mRNA相对表达量采用 2﹣ΔΔCt法分析。
1.5 统计学方法
所有数据采用SPSS20.0统计软件进行分析。符合正态分布的计量资料用均数±标准差表示,组间两两比较采用 LSD-t检验,多组间比较采用单因素方差分析(one-way ANOVA)。以P<0.05表示差异具有统计学意义。采用GraphPad Prism 5.0软件制图。
2.1 4组大鼠DAI和CMDI评分及体质量比较
造模后,与空白组比较,其余3组大鼠DAI和CMDI评分明显升高(P<0.05),体质量明显减轻(P<0.05)。干预后,药物组和穴位埋线组大鼠DAI和CMDI评分与模型组比较均显著降低(P<0.05),体质量明显增加(P<0.01)。详见表1。
表1 4组DAI和CMDI评分及体质量比较(±s, n=10)

表1 4组DAI和CMDI评分及体质量比较(±s, n=10)
注:与空白组比较1)P<0.05;与模型组比较2)P<0.05。
组别 DAI/分 CMDI/分 体质量/g空白组 0.00±0.00 0.45±0.12 238.69±13.85模型组 3.02±0.431) 3.37±0.581) 193.16±17.611)药物组 1.28±0.311)2) 1.32±0.251)2) 221.96±19.171)2)穴位埋线组 1.44±0.261)2) 1.47±0.301)2) 217.85±16.431)2)
2.2 4组大鼠结肠组织病理形态比较
病理学检查结果可见,空白组大鼠结肠黏膜结构正常,腺体形态规则,杯状细胞排列整齐,未见水肿、溃疡及炎性浸润;模型组结肠黏膜可见明显坏死、糜烂和溃疡形成,腺体排列不规则,杯状细胞减少,黏膜下层较多炎性细胞浸润,病理学组织评分明显高于空白组(P<0.01);药物组和穴位埋线组经干预后,肠黏膜糜烂、溃疡较模型组明显减轻,腺体和杯状细胞数目增多,排列较规则,黏膜充血、水肿和炎性浸润显著改善,病理学评分明显低于模型组(P<0.01)。详见图1和图2。

图1 4组结肠病理组织学评分比较(±s, n=10)

图2 4组大鼠结肠组织病理形态比较
2.3 4组大鼠血清和结肠组织MPO活性比较
与空白组比较,模型组大鼠血清和结肠组织中MPO的水平明显升高(P<0.05);药物组和穴位埋线组经干预后,大鼠血清和结肠组织 MPO的水平较模型组明显降低(P<0.05)。详见表2。
表2 4组血清和结肠组织MPO活性比较(±s, n=10)单位:(ng·mL﹣1)

表2 4组血清和结肠组织MPO活性比较(±s, n=10)单位:(ng·mL﹣1)
注:与空白组比较1)P<0.05;与模型组比较2)P<0.05。
组别 血清MPO 结肠MPO空白组 12.15±2.43 1.26±0.58模型组 28.30±3.651) 5.73±1.061)药物组 16.68±1.871)2) 2.34±1.141)2)穴位埋线组 19.37±2.411)2) 2.92±0.871)2)
2.4 4组大鼠结肠组织NF-κB p65表达的比较
空白组大鼠结肠组织见少量 NF-κB p65表达;与空白组比较,模型组结肠组织细胞质着色较深,NF-κB p65的阳性细胞表达数显著增多(P<0.05);药物组和穴位埋线组大鼠经干预后,结肠组织细胞质阳性染色减弱,NF-κB p65阳性细胞表达数较模型组明显减少(P<0.05)。详见图3。
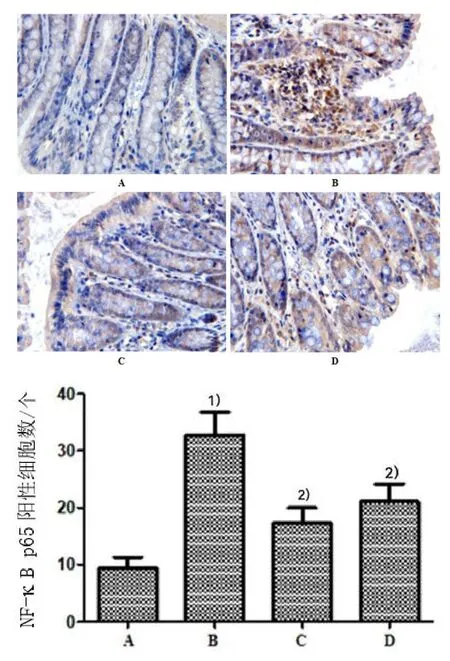
图3 4组大鼠结肠组织NF-κB p65表达(IHC×400,±s, n=10)
2.5 4组大鼠结肠组织SIRT1/NF-κB通路蛋白表达的比较
与空白组比较,模型组大鼠结肠组织中 p-IκBα、p-IKKβ和 NF-κB p65、p-NF-κB p65 及 AC-p65 的蛋白表达显著增多,SIRT1的蛋白表达明显减少(P<0.05)。与模型组比较,药物组和穴位埋线组结肠组织中 p-IκBα、p-IKKβ、NF-κB p65、p-NF-κB p65、AC-p65的蛋白表达显著下调,SIRT1的表达明显上调(P<0.05)。详见图4。

图4 4组大鼠结肠组织SIRT1/NF-κB通路蛋白表达(±s, n=10)
2.6 4组大鼠结肠组织 E-cadherin和 occludin的mRNA表达的比较
与空白组比较,模型组大鼠结肠组织中E-cadherin、occludin的 mRNA表达显著减少(P<0.05)。与模型组比较,药物组和穴位埋线组E-cadherin和 occludin的 mRNA表达明显增多(P<0.01)。详见图5。

图5 4组大鼠结肠组织E-cadherin和occludin的mRNA表达(±s, n=10)
随着近年生活节奏的加快和膳食结构的改变,UC发病率逐年攀升,其病程迁延,难以治愈,且伴有一定癌变风险,严重影响患者的身心健康[12]。目前西医对UC尚无理想治疗方案,针对其临床症状,常采用抗感染、免疫抑制剂等药物进行治疗,但西药治疗存在不良反应多、停药后易复发等缺点[13]。穴位埋线作为中医特色的外治疗法,通过对特定腧穴的持久刺激来激发经络气机,达到调和气血阴阳,疏通经脉的作用,且价格低廉,副作用少,在 UC的非手术疗法中具有较大优势[14]。
中医学将UC归属为“肠癖”“痢疾”等范畴,认为其病位在大肠,发病与脾、胃密切相关,以脾虚湿蕴为本,血瘀凝滞为标,治宜化瘀活血,温阳通络[15]。穴位埋线疗法是一种以经络理论为基础的中医外治手段,通过将羊肠线埋入穴位并放置一定时间,以产生较常规针刺更为持久的针感刺激,起到激发经络气机,疏通经脉的作用;羊肠线在体内分解和吸收的过程亦可增强人体免疫功能,提高机体应激能力[16]。在临床应用中对慢性胃炎、肠炎、UC等慢性病均有显著疗效[17]。根据UC的病因病机,临床取穴主要以足阳明胃经、足太阳膀胱经腧穴为主。足阳明经属胃络脾,多气多血,与脾胃功能和能量代谢关系密切,为治疗 UC的根本所在;足太阳经属“阳中之阳”,可参与经脉气血循环,振奋脾阳[18]。温淑婷等[19]通过梳理近 15年穴位埋线治疗UC的选穴规律发现,选择经脉以足阳明经和足太阳经居多,腧穴使用频次以足三里、天枢和大肠俞最高。
SASP是治疗UC的常用药物,该药进入结肠后经细菌分解为 5-氨基水杨酸和磺胺吡啶,5-氨基水杨酸可通过影响肠黏膜组织花生四烯酸的代谢,清除自由基等发挥抗炎作用,缓解肠道炎症[20]。本研究选取足太阳经大肠俞及足阳明经足三里、上巨虚、天枢穴,通过DSS自由饮用法复制UC大鼠模型,同时选择SASP作为阳性对照药物,观察埋线治疗对 UC肠黏膜的修复效果。足三里为胃的下合穴,针刺有疏调阳明经气、调理肠胃运化之效;天枢为大肠之募穴,主调畅肠腑气机,化瘀活血;上巨虚为大肠之下合穴,与天枢穴合募配伍,可起到调肠和胃作用,与足三里合用,又可提高机体免疫机能;大肠俞为大肠之背俞穴,与天枢穴俞募相配,有理气降逆、调和大肠腑气之功用[21]。UC大鼠经穴位埋线治疗后,DAI和CMDI评分较模型组显著降低,体质量显著增长,结肠黏膜溃疡、糜烂和炎性浸润等病理表现得到有效改善,同时显著降低了大鼠血清和结肠组织中炎症指标 MPO的活性,提示埋线疗法能够显著减轻UC大鼠结肠组织中性粒细胞浸润程度,促进肠黏膜损伤愈合。
NF-κB作为一条经典的炎症通路,在促进炎性细胞因子表达,诱发机体炎症反应方面具有重要作用[22]。在静息状态下,NF-κBp50/p65通过与IκB结合在细胞质中保持非活性状态;当机体受到外部刺激时,IKK发生磷酸化,并促使IκB磷酸化和降解,降解的IκB进入细胞核后激活 NF-κB,进而促进炎症反应的发生和持续[23]。以往研究表明[24-25],在 UC动物模型和患者中存在 NF-κB通路的过度激活,而通过靶向抑制其活化能够缓解结肠组织炎症损伤,对UC起到治疗作用。本研究发现,UC大鼠结肠组织中NF-κBp65、p-NF-κBp65、p-IKKβ、p-IκBα及 AC-p65的蛋白水平均显著上调,p-IκBα/IκBα、p-IKKβ/IKKβ的比值明显增加,经穴位埋线治疗后,NF-κBp65、p-NF-κBp65、p-IKKβ、p-IκBα及 AC-p65 的 表 达 显 著 减 少 ,p-IκBα/IκBα 和p-IKKβ/IKKβ比值明显降低,表明穴位埋线能够作用于 NF-κB通路,通过抑制 NF-κB磷酸化和乙酰化发挥对UC的抗炎修复作用。SIRT1是从酵母中分离的一类去乙酰化酶,在炎症性肠病中,活化并处于高水平的SIRT1能通过调节肠道菌群、抑制炎症来维持肠黏膜屏障功能,保护肠上皮细胞[26]。此外,高表达的 SIRT1还可使 NF-κB去乙酰化,通过抑制 NF-κB的活性以减轻炎症程度。SIRT1表达的降低可减少对NF-κB 信号通路的抑制作用,导致炎症因子表达升高[27]。陈锐等[28]研究证实,SIRT1可通过抑制NF-κB的表达来降低坏死性小肠结肠炎中炎症因子的水平。在本实验中,UC大鼠结肠 SIRT1的蛋白表达显著减少,而埋线治疗明显上调了 SIRT1的水平,提示穴位埋线可能通过促进SIRT1的表达,抑制NF-κB及其下游炎症因子生成以保护UC肠黏膜损伤。
肠黏膜屏障可抵御有害物质的侵袭,在肠道中具有重要的防御功能。UC患者肠镜检查可见黏膜屏障的破坏,肠屏障功能的受损可引起机体免疫异常,使炎症反应和肠上皮细胞损伤进一步加重,导致 UC迁延反复[29]。研究[30]证实,NF-κB的过度活化将导致肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)等炎症介质的过度表达,引起肠黏膜炎症反应,从而造成屏障的损伤。NF-κB阻断剂能够通过上调 occludin、E-cadherin的水平以改善肠屏障功能[31]。熊兴军等[32]发现,木瓜总三萜可通过调节SIRT1/NF-κBp65通路上调Occludin、E-cadherin等肠黏膜屏障保护因子的表达以减轻肠黏膜屏障损伤,发挥对 UC小鼠的治疗作用。本研究检测大鼠结肠组织occludin和E-cadherin的mRNA表达发现,UC大鼠E-cadherin、occludin的mRNA表达明显降低,应用埋线治疗后,明显上调了其表达水平。提示穴位埋线能够促进肠上皮紧密连接蛋白的表达,恢复UC受损的肠屏障功能。
综上所述,本研究表明穴位埋线疗法可显著改善大鼠肠黏膜的炎症,降低DAI、CMDI及病理组织学评分,其作用机制可能与调控SIRT1/NF-κB信号通路、上调黏膜屏障保护因子水平及修复黏膜上皮屏障功能相关。
猜你喜欢结肠穴位黏膜低血压可以按摩什么穴位今日农业(2021年19期)2022-01-12微小RNA在先天性巨结肠中的研究进展天津医科大学学报(2021年4期)2021-08-21Tiger17促进口腔黏膜成纤维细胞的增殖和迁移昆明医科大学学报(2021年8期)2021-08-13提壶揭盖法论治热结肠腑所致咳嗽中国民间疗法(2020年22期)2021-01-07夏季穴位养心华人时刊(2019年13期)2019-11-17男性排湿,常按这五个穴位中国生殖健康(2019年9期)2019-01-07内镜黏膜下剥离术治疗胃窦黏膜脱垂10 例临床效果报道中国内镜杂志(2017年2期)2017-03-20内镜黏膜下剥离术在早期胃癌诊疗中的应用腹腔镜外科杂志(2016年10期)2016-06-0182例后壁黏膜完整隆凸阴道缩紧术临床观察中国医疗美容(2015年1期)2015-07-12经肛门结肠拖出术治疗先天性巨结肠护理体会中国卫生标准管理(2015年3期)2015-01-27