林子栋,席作武,刘洪波
(1.河南中医药大学第二临床医学院,河南 郑州 450002;
2.河南省中医院肛肠科,河南 郑州 450002;
3.南阳医学高等专科学校,河南 南阳 473061)
溃疡性结肠炎是临床中常见的一种疑难肠病,以持续性和弥漫性炎症为主要特征,临床表现为腹泻、腹痛、里急后重等,其病灶局限于结肠黏膜并向直肠近端延伸,其患病率呈不断上升趋势[1]。溃疡性结肠炎的治疗周期长、成本高,且缠绵难愈,增加了患结肠癌的风险。因此,寻找安全有效的溃疡性结肠炎治疗药物显得尤为必要[2]。近年来,中药以其多成分和多靶点的特点,在该病治疗中发挥重要作用,较西医有疗效佳、复发率低和副作用少等优点。
氧化损伤和炎症反应是溃疡性结肠炎的主要特征。沉默信息调节因子1(sirtuin1,SIRT1)作为一种组蛋白去乙酰化酶,在机体抵抗氧化应激和抑制炎症反应中起重要作用[3]。研究表明在溃疡性结肠炎小鼠体内SIRT1 表达明显降低[4-5];
SIRT1表达上调可以减弱溃疡性结肠炎小鼠肠道炎症反应[6]。复方苦参汤是河南省中医院肛肠科临床常用的中医外治方,是国家级知名专家席作武教授临床治疗溃疡性结肠炎的经验方,效果显著,然而复方苦参汤对溃疡性结肠炎的治疗作用是否与SIRT1信号通路有关,目前并不清楚。本研究采用葡聚糖硫酸钠(dextran sulfate sodium,DSS)建立小鼠溃疡性结肠炎模型,并基于SIRT1 通路进一步明确复方苦参汤在治疗溃疡性结肠炎过程中潜在的分子机制。
1.1 实验动物 SPF 级小鼠70 只,雌雄各半,6~8 周龄,体质量(20±3)g,购自郑州大学实验动物中心,实验动物生产许可证号SCXK(豫)2019-022,实验动物使用许可证号SCXK(豫)2019-022。小鼠在12 h/12 h 黑暗/光照循环,相对湿度(55±5)%,温度(23±2)℃的标准实验室进行饲养,自由采食和饮水。所有动物实验操作均按照《国立卫生研究院实验动物护理与使用指南》进行,并经河南中医药大学第二附属医院动物伦理委员会批准(编号PZ-HNSZYY-2021-007)。
1.2 试剂与药物 复方苦参汤(大黄30 g、黄连30 g、黄芩30 g、苦参30 g、地榆30 g、紫花地丁30 g、蒲公英30 g、大青叶30 g、马齿苋30 g、金银花30 g、野菊花30 g、槐米30 g、白鲜皮30 g、黄柏30 g、芒硝30 g)由河南省中医院药剂科提供,经河南省中医院焦伟杰副主任药师鉴定为正品。复方苦参汤药材加入10 倍量纯水浸泡2 h,煎煮30 min,过滤后同法再次煎煮30 min,合并2 次滤液并浓缩至生药量0.6 g/mL,置于4 ℃冷藏备用。DSS(批号Q9358)购自美国MP Biomedicals公司;
SIRT1 抑制剂EX527(批号HY-15452)购自美国Med Chem Express 公司;
多聚甲醛组织固定液(批号21200490)购自美国Sigma 公司;
小鼠肿瘤坏死因子(tumor necrosis factor-alpha,TNFα)、白细胞介素6(interleukin-6,IL-6)、IL-1β、髓过氧化物酶(myeloperoxidase,MPO)试剂盒(批号 ml002859、ml064292、ml037361、ml037361)购自上海酶联生物科技有限公司;
丙二醛(malonaldehyde,MDA)试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒(批号S0131S、P0012S)购自上海碧云天生物技术有限公司;
二氢乙啶(dihydroethidium,DHE)探针(批号HR9069)购自北京百奥莱博科技有限公司;
SIRT1、乙酰化核因子κB(Acetylated nuclear factor κB,Acetyl NF-κB)、锰超氧化物歧化酶(manganese superoxide dismutase,SOD2)、β 肌动蛋白(β-actin)抗体(批号 8469S、12629S、13141T、4970S)购自美国Cell Signaling Technology公司;
过氧化氢酶(catalase,CAT)抗体(批号AS09501a)购自美国Agrisera 公司。
1.3 仪器 RM2245 石蜡切片机、CM1850 冰冻切片机(德国Lecia 公司);
Shandon Citadel 2000 全自动脱水机(美国Thermo Scientific 公司);
TK-218 烘干机(湖北泰维科技实业股份有限公司);
5427R 低温高速离心机(德国Eppendorf 公司);
SilverUVIpro 凝胶数字成像分析仪(英国UVItec 公司);
BX53 荧光显微镜(日本Olympus 公司);
Mini-PROTEAN 蛋白质电泳与转膜系统(美国Bio-Rad 公司);
Spectra MaxM3 酶标仪(美国Molecular Devices 公司);
Pannoramic 250 切片扫描系统(匈牙利3D HISTECH 公司)。
2.1 分组、造模及给药 70 只小鼠按随机数字表法分为对照组,模型组,复方苦参汤低、中、高剂量组,柳氮磺吡啶组,复方苦参汤+EX527 组,每组10 只,对照组给予正常饮用水,其余各组小鼠给予含3% DSS 的饮用水,每隔1 d 更换1 次,自由饮水7 d 以制备溃疡性结肠炎模型,出现便血和体质量降低则提示模型复制成功。从造模第1 天开始,复方苦参汤组小鼠分别给予复方苦参汤低、中、高剂量(3、6、12 g/kg)灌肠;
柳氮磺吡啶组灌胃给予300 mg/kg 柳氮磺吡啶;
复方苦参汤+EX527 组小鼠在给予12 g/kg 复方苦参汤灌肠的同时腹腔注射5 mg/kg EX527;
对照组和模型组给予等体积0.9%氯化钠灌肠,每天1 次,连续7 d。
2.2 小鼠一般状态评价与疾病活动指数(DAI)评分 每天给药后30 min 观察并记录各组小鼠的精神状态、毛发光泽度、大便性状、体质量变化、便血情况及摄食饮水量,并进行DAI 评分。
2.3 样本采集与处理 造模结束后,各组小鼠禁食12 h,次日眼球取血后采取颈椎脱臼法处死,剥离小鼠结肠组织,使用标尺测量各组小鼠结肠组织的长度,进行统计学分析。生理盐水预冷后清除小鼠肠内粪便,取部分结肠组织固定于4%多聚甲醛中,进行苏木素-伊红(HE)染色处理;
其余结肠组织冻存于-80 ℃冰箱备用。
2.4 免疫组化法检测结肠组织中SIRT1 表达 取各组小鼠结肠组织石蜡切片,脱蜡及水化后高压热修复抗原,加3% H2O2于37 ℃孵育10 min,常规洗涤吸干后加入血清封闭,滴加SIRT1 抗体(1∶100),4 ℃孵育过夜,常规洗涤后滴加二抗,37 ℃孵育30 min,常规洗涤吸干后滴加DAB 工作液显色,光学显微镜下拍照。随机观察每张切片中5 个不同视野,分别按照阳性细胞所占百分比和染色强度进行评分。阳性细胞百分比评分标准为0 分表示为阴性,1 分表示阳性细胞数不超过10%,2分表示阳性细胞数为11%~50%,3 分表示阳性细胞数为51%~75%,4 分表示阳性细胞数超过75%;
染色强度评分标准为0、1、2 分分别对应无色、淡黄色和棕黄色,最终根据二者结果计算SIRT1 的表达积分。
2.5 结肠组织病理形态学观察与评价 将固定的结肠组织常规脱水处理后采用二甲苯透明化,石蜡包埋,切片(5 μm),烤片脱蜡后常规HE 染色,封片,使用双盲法在光学显微镜下观察并记录各组小鼠结肠组织的病理形态学情况,采集图片。结肠损伤评分标准有溃疡(0、1、2 分依次代表无溃疡、溃疡小于3 mm、溃疡大于3 mm)、炎症(0、1、2 分依次代表无、轻度、中度)、病变的深度(0、1、2、3 分依次代表无、黏膜下层、肌层、浆膜层)。
2.6 ELISA 法检测结肠组织中炎性因子水平 分别称取冻存于-80 ℃冰箱的各组小鼠结肠组织各50 mg,加入预冷的无菌PBS,充分匀浆后4 ℃、3 000 r/min 离心15 min,分离得上清液,参照ELISA 试剂盒说明书步骤,检测各组小鼠结肠组织上清液中TNF-α、IL-6、IL-1β 水平和MPO 活性。
2.7 DHE 染色法及比色法检测小鼠结肠组织氧化损伤情况 将分离的结肠组织取部分制作冰冻切片(厚度40 μm),按照DHE 荧光探针检测试剂盒说明书进行染色(浓度5 μmol/L)及清洗,荧光显微镜下观察切片的染色情况,记录荧光强度并计算平均值作为ROS 水平。依据试剂盒说明书,采用比色法测定小鼠结肠组织上清液中MDA 水平。
2.8 Western blot 法检测结肠组织中Acetyl-NF-κB、CAT、SOD2 蛋白表达 取小鼠结肠组织研磨后加入RIPA 裂解液在冰上裂解,反复吹打使其松散,冰浴30 min 后4 ℃、12 000 r/min 离心15 min,提取蛋白上清液,按比例加入上样缓冲液后于水浴锅内100 ℃煮沸10 min 进行变性,BCA 蛋白定量法检测其蛋白浓度。蛋白样品进行SDS-PAGE 凝胶电泳后转印至PVDF 膜上,用含有5% 脱脂奶粉的TBST(封闭液)于4 ℃下封闭2 h,加入一抗Acetyl-NF-κB(1∶1 000)、CAT(1∶1 000)、SOD2(1∶1 000),4 ℃孵育过夜,TBST 充分洗涤3 次,加入二抗室温孵育1 h,TBST 充分洗涤3次,加入ECL 显色液于PVDF 膜上后,在曝光仪中测定各组蛋白条带的吸光度,用Image J 软件分析条带灰度值,通过与内参β-actin 的比值来表示目的蛋白相对表达。
2.9 统计学分析 通过SPSS 21.0 软件进行处理,数据以(±s)表示,多组间比较采用单因素方差分析配合Tukey 检验。P<0.05 表示差异具有统计学意义。
3.1 复方苦参汤对溃疡性结肠炎小鼠一般状态和DAI 评分的影响 与对照组比较,模型组小鼠有7只在第2 天出现粪便隐血呈阳性,在实验第4 天则全呈现阳性,与此同时小鼠会伴有精神状态萎靡、毛发凌乱缺乏光泽、大便稀溏以及体质量减轻,随着时间的延长,这些症状表现得更加明显,甚至会伴随有血便的出现;
柳氮磺吡啶组和复方苦参汤各剂量组小鼠上述症状得到不同程度的缓解;
复方苦参汤+EX527 组小鼠的一般状态并未得到有效缓解。
如表1 所示,与对照组比较,随着DSS 处理时间的延长,模型组小鼠DAI 评分升高(P<0.01);
与模型组比较,复方苦参汤各剂量组和柳氮磺吡啶组均减弱了DSS 引起的DAI 评分升高(P<0.05,P<0.01);
与同时间点复方苦参汤组高剂量组比较,复方苦参汤+EX527 处理组小鼠DAI评分升高(P<0.05,P<0.01)。
表1 复方苦参汤对溃疡性结肠炎小鼠DAI 评分的影响(分,±s, n=10)Tab.1 Effects of Compound Sophorae Decoction on DAI score of UC mice(score,±s, n=10)
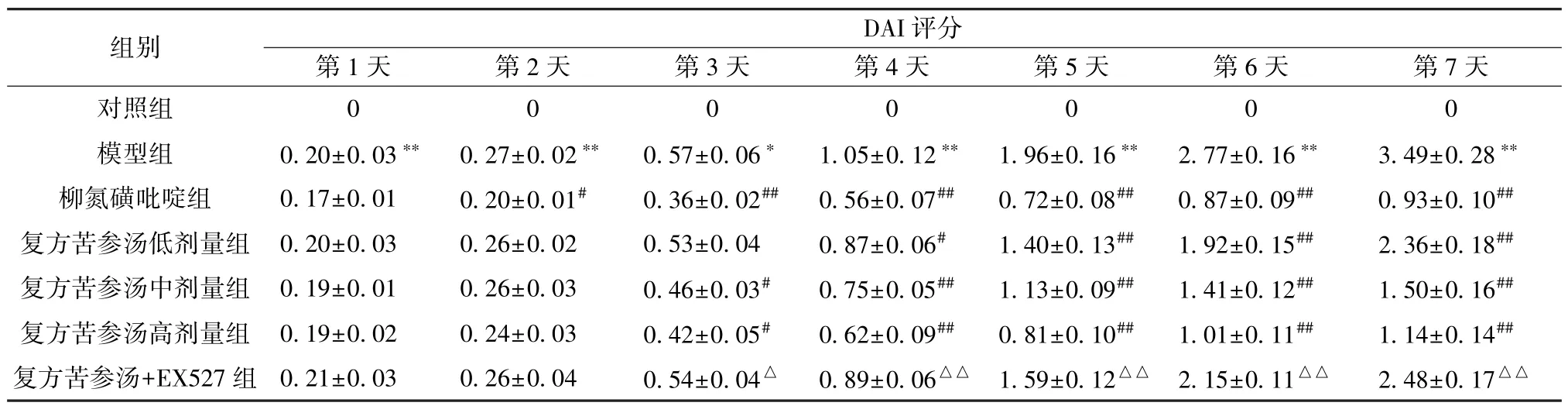
表1 复方苦参汤对溃疡性结肠炎小鼠DAI 评分的影响(分,±s, n=10)Tab.1 Effects of Compound Sophorae Decoction on DAI score of UC mice(score,±s, n=10)
注:与同时间点对照组比较,**P<0.01;
与同时间点模型组比较,#P<0.05,##P<0.01;
与同时间点复方苦参汤高剂量组比较,△P<0.05,△△P<0.01。
3.2 复方苦参汤对溃疡性结肠炎小鼠结肠长度的影响 与对照组比较,模型组小鼠结肠长度缩短(P<0.01);
与模型组比较,柳氮磺吡啶组和复方苦参汤各剂量组小鼠结肠长度增长(P<0.05,P<0.01);
与复方苦参汤高剂量组比较,复方苦参汤+EX527 组小鼠结肠长度缩短(P<0.01),见表2。
表2 复方苦参汤对溃疡性结肠炎小鼠结肠长度的影响(±s, n=10)Tab.2 Effects of Compound Sophorae Decoction on colonic length of UC mice(±s, n=10)

表2 复方苦参汤对溃疡性结肠炎小鼠结肠长度的影响(±s, n=10)Tab.2 Effects of Compound Sophorae Decoction on colonic length of UC mice(±s, n=10)
注:与对照组比较,**P<0.01;
与模型组比较,#P<0.05,##P<0.01;
与复方苦参汤高剂量组比较,△△P<0.01。
3.3 复方苦参汤对溃疡性结肠炎小鼠结肠组织SIRT1 表达的影响 SIRT1 的阳性染色主要位于细胞核上。与对照组比较,模型组小鼠结肠组织中SIRT1 表达减少,表达评分降低(P<0.01);
与模型组比较,柳氮磺吡啶组和复方苦参汤各剂量组小鼠结肠组织SIRT1 表达增加,表达评分升高(P<0.05,P<0.01);
与复方苦参汤高剂量组比较,复方苦参汤+EX527 组小鼠结肠SIRT1 表达减少,表达评分降低(P<0.01),见图1、表3。
表3 复方苦参汤对溃疡性结肠炎小鼠结肠组织SIRT1 表达评分的影响(分,±s, n=10)Tab.3 Effects of Compound Sophorae Decoction on SIRT1 expression scores of UC mice(score,±s, n =10)

表3 复方苦参汤对溃疡性结肠炎小鼠结肠组织SIRT1 表达评分的影响(分,±s, n=10)Tab.3 Effects of Compound Sophorae Decoction on SIRT1 expression scores of UC mice(score,±s, n =10)
注:与对照组比较,**P<0.01;
与模型组比较,#P<0.05,##P<0.01;
与复方苦参汤高剂量组比较,△△P<0.01。

图1 各组小鼠SIRT1 表达情况(×400)Fig.1 Expression of SIRT1 in mice in each group(×400)
3.4 复方苦参汤对溃疡性结肠炎小鼠结肠组织形态学的影响 如图2 所示,对照组小鼠结肠组织黏膜光滑完整,排列整齐,未见炎症细胞的浸润;
模型组小鼠结肠组织黏膜上皮结构遭到破坏,上皮细胞出现破损并可见炎性浸润;
柳氮磺吡啶和复方苦参汤各剂量组小鼠结肠组织黏膜上皮细胞保持相对完整,炎性浸润明显变少;
EX527 处理则减弱了复方苦参汤对溃疡性结肠炎小鼠结肠组织黏膜组织的保护作用。此外,如表4 所示,与对照组比较,模型组小鼠结肠病理学评分升高(P<0.01);
与模型组比较,复方苦参汤各剂量组小鼠结肠组织病理学评分降低(P<0.05,P<0.01);
与复方苦参汤高剂量组比较,复方苦参汤+EX527 组小鼠结肠组织病理学评分升高(P<0.01)。
表4 复方苦参汤对溃疡性结肠炎小鼠结肠组织病理学评分的影响(分,±s, n=10)Tab.4 Effects of Compound Sophorae Decoction on histopathological scores of UC mice(score,±s, n=10)

表4 复方苦参汤对溃疡性结肠炎小鼠结肠组织病理学评分的影响(分,±s, n=10)Tab.4 Effects of Compound Sophorae Decoction on histopathological scores of UC mice(score,±s, n=10)
注:与对照组比较,**P<0.01;
与模型组比较,#P<0.05,##P<0.01;
与复方苦参汤高剂量组比较,△△P<0.01。

图2 各组小鼠结肠组织形态学变化(×400)Fig.2 Histomorphological changes of colon in mice of each group(×400)
3.5 复方苦参汤对溃疡性结肠炎小鼠结肠组织炎症因子水平的影响 与对照组比较,模型组小鼠结肠组织炎症因子TNF-α、IL-6、IL-1β 水平 及MPO 活性升高(P<0.01);
与模型组比较,柳氮磺吡啶组和复方苦参汤各剂量组小鼠结肠组织TNF-α、IL-6、IL-1β 水平及MPO 活性降低(P<0.05,P<0.01);
与复方苦参汤高剂量组比较,复方苦参汤+EX527 组小鼠结肠组织TNF-α、IL-6、IL-1β 水平及MPO 活性升高(P<0.05,P<0.01),见表5。
表5 复方苦参汤对溃疡性结肠炎小鼠炎性因子水平的影响(±s, n=10)Tab.5 Effects of Compound Sophorae Decoction on inflammatory factor levels of UC mice(±s, n=10)

表5 复方苦参汤对溃疡性结肠炎小鼠炎性因子水平的影响(±s, n=10)Tab.5 Effects of Compound Sophorae Decoction on inflammatory factor levels of UC mice(±s, n=10)
注:与对照组比较,**P<0.01;
与模型组比较,#P<0.05,##P<0.01;
与复方苦参汤高剂量组比较,△P<0.05,△△P<0.01。
3.6 复方苦参汤对溃疡性结肠炎小鼠结肠组织氧化应激指标的影响 与对照组比较,模型组小鼠结肠组织中ROS、MDA 水平升高(P<0.01);
与模型组比较,柳氮磺吡啶和复方苦参汤各剂量组小鼠结肠组织ROS、MDA 水平降低(P<0.05,P<0.01);
与复方苦参汤高剂量组比较,复方苦参汤+EX527 组小鼠结肠组织ROS、MDA 水平升高(P<0.01),见图3、表6。
表6 复方苦参汤对溃疡性结肠炎小鼠结肠组织氧化应激指标的影响(±s, n=10)Tab.6 Effects of Compound Sophorae Decoction on colon oxidative stress indices of UC mice(±s, n=10)

表6 复方苦参汤对溃疡性结肠炎小鼠结肠组织氧化应激指标的影响(±s, n=10)Tab.6 Effects of Compound Sophorae Decoction on colon oxidative stress indices of UC mice(±s, n=10)
注:与对照组比较,**P<0.01;
与模型组比较,#P<0.05,##P<0.01;
与复方苦参汤高剂量组比较,△△P<0.01。
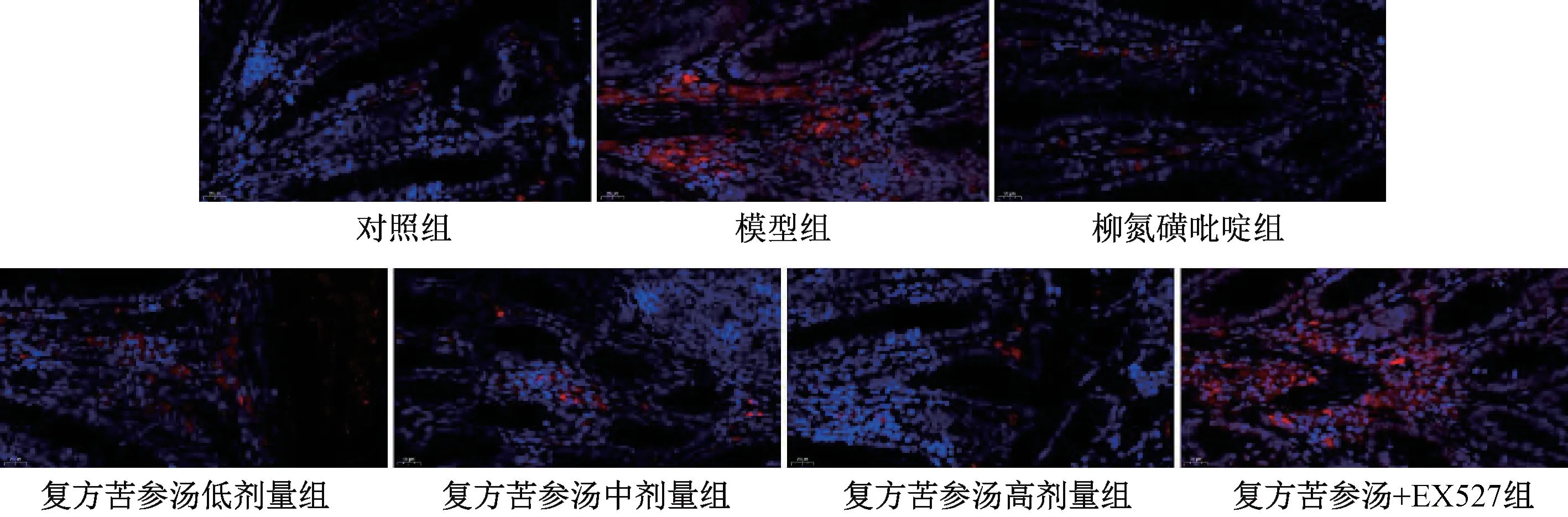
图3 各组小鼠结肠组织ROS 水平(×400)Fig.3 ROS levels in mouse colon of each group(×400)
3.7 复方苦参汤对溃疡性结肠炎小鼠结肠组织Acetyl NF-κB、SOD2、CAT 蛋白表达的影响 与对照组比较,模型组小鼠结肠组织SOD2、CAT 蛋白表达降低(P<0.01),Acetyl NF-κB 蛋白表达升高(P<0.01);
与模型组比较,柳氮磺吡啶组和复方苦参汤各剂量组小鼠结肠组织SOD2、CAT 蛋白表达升高(P<0.01),Acetyl NF-κB 蛋白表达降低(P<0.05,P<0.01);
与复方苦参汤高剂量组比较,复方苦参汤+EX527 组小鼠结肠组织SOD2、CAT 蛋白表达降低(P<0.01),Acetyl NF-κB 蛋白表达升高(P<0.01),见图4、表7。
表7 复方苦参汤对溃疡性结肠炎小鼠结肠组织Acetyl NF-κB、SOD2、CAT 蛋白表达的影响(±s, n=10)Tab.7 Effects of Compound Sophorae Decoction on the colon protein expressions of Acetyl NF-κB,SOD2 and CAT of UC mice(±s, n=10)

表7 复方苦参汤对溃疡性结肠炎小鼠结肠组织Acetyl NF-κB、SOD2、CAT 蛋白表达的影响(±s, n=10)Tab.7 Effects of Compound Sophorae Decoction on the colon protein expressions of Acetyl NF-κB,SOD2 and CAT of UC mice(±s, n=10)
注:与对照组比较,**P<0.01;
与模型组比较,#P<0.05,##P<0.01;
与复方苦参汤高剂量组比较,△△P<0.01。
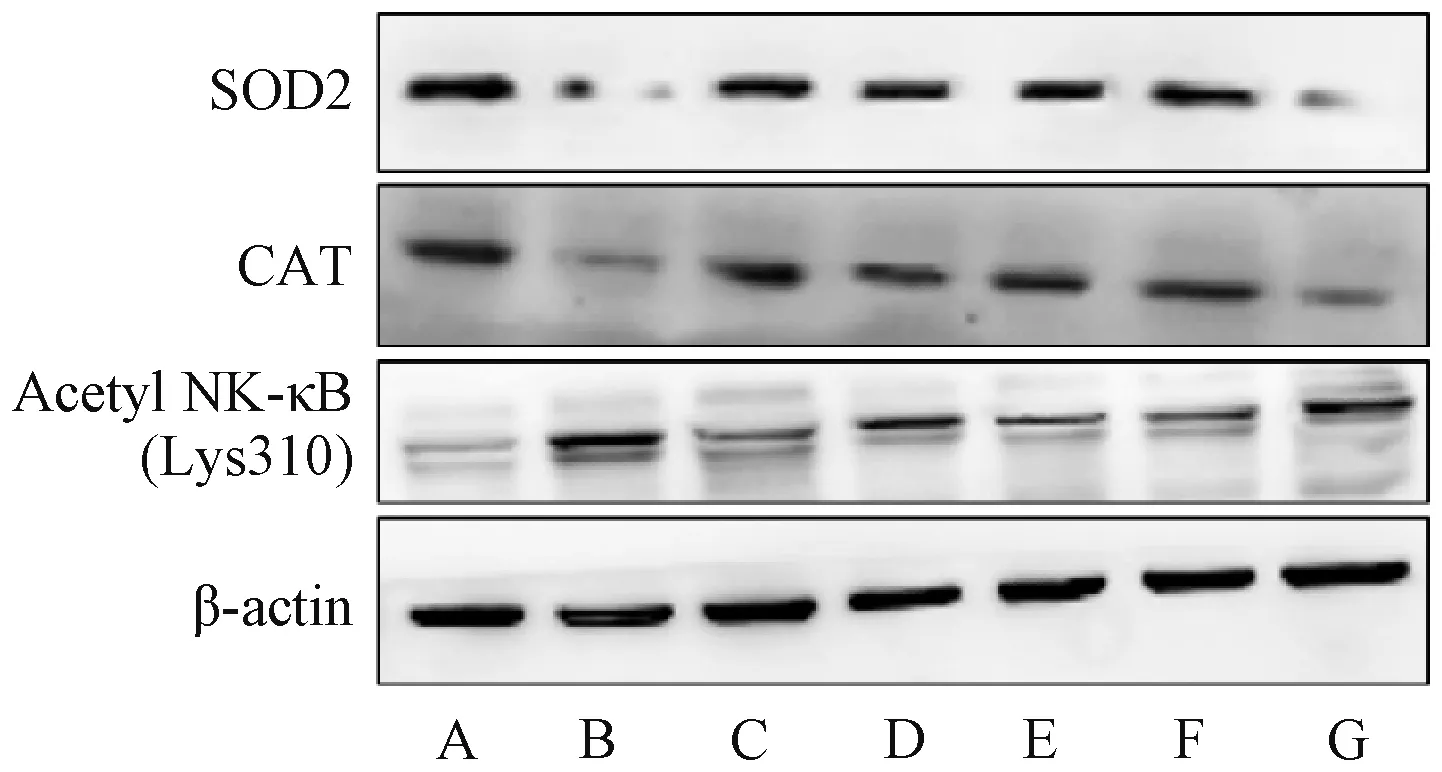
图4 各组小鼠结肠组织Acetyl NF-κB、SOD2、CAT 蛋白条带图Fig.4 Bands of colon Acetyl NF-κB,SOD2 and CAT proteins of mice in each group
溃疡性结肠炎在中医学中归属于“痢疾” “久痢” “肠澼” 等。席作武教授认为,溃疡性结肠炎的发生不外乎嗜食肥甘厚味而生湿热之邪,阻碍胃肠之气血运行,久而及肾,治宜清热解毒,除湿止痛。复方苦参汤具有清热燥湿、凉血解毒、涩肠而止痢的功效[7-11]。本研究结果表明,复方苦参汤对DSS 诱导的小鼠溃疡性结肠炎具有良好的治疗作用。
SIRT1 作为一种去乙酰化酶,包括结肠在内的多种哺乳动物组织中均有广泛表达,它通过调节蛋白的乙酰化水平来对下游靶基因的表达进行调控[12]。研究表明,SIRT1 低表达与溃疡性结肠炎引起的结肠损伤相关,而上调SIRT1 表达则能有效缓解溃疡性结肠炎小鼠的病理损伤[4]。本研究结果进一步证实,溃疡性结肠炎小鼠结肠组织中SIRT1 表达较对照组降低,复方苦参汤处理后SIRT1 表达升高,然而SIRT1 抑制剂EX527 的干预不仅减弱了复方苦参汤诱导的SIRT1 表达升高,而且复方苦参汤对溃疡性结肠炎小鼠体质量、结肠长度、DAI 指数、组织病理评分的保护作用也被抑制,提示复方苦参汤通过调控SIRT1 信号对溃疡性结肠炎小鼠起保护作用。
炎症因子的过量表达与溃疡性结肠炎引起的肠道损伤密切相关。NF-κB 是诱导炎症因子表达的重要转录因子,其转录活性受到乙酰化NF-κB p65 的调控,NF-κB p65 在310 位点赖氨酸残基的乙酰化会促进p65 亚基入核,诱导炎症因子的转录[13-14]。活化的SIRT1 会降低NF-κB p65 的乙酰化水平,从而抑制炎症因子水平[15]。为了探究复方苦参汤是否通过调节SIRT1 信号来发挥抗炎作用,本研究采用SIRT1 抑制剂EX527 来进行干预,结果表明EX527 缓解了复方苦参汤对NF-κB 乙酰化水平的调控作用,其炎症因子TNF-α、IL-6、IL-1β 水平也较复方苦参汤组升高。此外,MPO 活性的高低可直接反映肠道中炎性损伤的程度[16-17]。本研究结果表明,EX527 的使用减弱了复方苦参汤对溃疡性结肠炎小鼠结肠MPO 活性升高的抑制作用。这些结果提示,复方苦参汤通过激活SIRT1 信号来抑制溃疡性结肠炎小鼠炎症损伤。
氧化应激作为溃疡性结肠炎发生与发展的另一重要因素,会引起ROS 水平升高,抗氧化酶CAT、SOD 活性降低,脂质过氧化物MDA 水平升高,当超过机体自由基的清除能力时就会对结肠组织造成破坏性损伤,同时会造成炎症与组织损伤之间出现恶性循环[18-20]。本研究结果显示,复方苦参汤处理降低了溃疡性结肠炎小鼠结肠组织ROS、MDA水平,升高了SOD2、CAT 蛋白表达,而EX527 干预减弱了复方苦参汤对溃疡性结肠炎小鼠结肠氧化损伤的保护作用。
综上所述,复方苦参汤通过激活SIRT1 信号对溃疡性结肠炎起保护作用,而活化的SIRT1 减弱了溃疡性结肠炎小鼠结肠组织NF-κB 乙酰化水平,激活SOD2、CAT 蛋白表达,从而抑制炎性因子水平,减轻氧化损伤。
猜你喜欢苦参溃疡性结肠炎“结肠炎”背后的亲子关系问题中老年保健(2022年5期)2022-08-24Efficacy of Kushen decoction (苦参汤) on high-fat-diet-induced hyperlipidemia in ratsJournal of Traditional Chinese Medicine(2022年3期)2022-07-20以苦参为主治疗心律失常的疗效观察中国典型病例大全(2022年10期)2022-05-10苦参百部液治虫咬皮炎基层中医药(2021年8期)2021-11-02大剂苦参治不寐中国民间疗法(2019年1期)2019-01-07足底溃疡性扁平苔藓合并普秃一例中华皮肤科杂志(2014年4期)2014-12-19中西医结合治疗溃疡性结肠炎40例中医研究(2014年6期)2014-03-11愈疡消溃方治疗溃疡性结肠炎活动期30例中国中医药现代远程教育(2014年23期)2014-03-01辨证论治慢性腹泻型结肠炎45例中国中医药现代远程教育(2014年22期)2014-03-01治疗脾肾阳虚型溃疡性结肠炎30例中国中医药现代远程教育(2014年15期)2014-03-01