陶 琦,郝若晨,刘希望,秦 哲,李世宏,白莉霞,李剑勇,杨亚军
(中国农业科学院 兰州畜牧与兽药研究所 农业农村部兽用药物创制重点实验室/甘肃省新兽药工程重点实验室,甘肃 兰州 730050)
药物进入体内后,有些药物能够提高肝脏微粒体药物代谢酶系(药酶)的活性,从而提高药物代谢速率,称为酶的诱导;
或者使药酶的活性降低,使其代谢药物的速率减慢,称为酶的抑制。药酶的诱导或抑制均可影响药物代谢的速率;
当2种或2种以上的药物在同时或前后序贯用药时,如果在代谢环节产生了药酶的诱导或抑制,使疗效增强甚至产生毒副作用,或疗效减弱甚至治疗失败,此称之为代谢性药物相互作用(metabolic drug interaction)[1]。随着药物联合使用越来越普遍,药物之间的代谢性相互作用愈显重要。在临床用药中,相当部分的药物不良反应是由代谢性药物相互作用引起的,其发生率占药代动力学相互作用的40%,而代谢性相互作用的96%是由肝脏微粒体细胞色素P450酶系统(cytochrome P450,CYP450)介导的[2-3]。研究药物对CYP450酶系的影响,可以预测其在体内可能引起的代谢性药物相互作用,进而为临床药物相互作用试验提供参考。因此,在新药的安全性评价中,研究药物对CYP450酶的活性影响具有重要意义。
目前,欧美各国已经将药物对CYP450酶活性影响的测定用于代谢及新药的筛选研究,并将其列为新药研究中必须进行的一项试验[4-6]。我国于2021年颁布了《药物相互作用研究指导原则(试行)》,明确了化学药物相互作用研究的具体方法,生物制品、中药和天然药物可参照执行[7]。
阿司匹林丁香酚酯(aspirin eugenol ester,AEE)是利用结构拼合的前药原理,以丁香酚(Eug)对阿司匹林(Asp)进行酯化修饰而合成的一种新型药用化合物,具有很好的成药性。研究表明,AEE具有确切的抗炎[8]、抗氧化[9-10]、降血脂[11-12]、预防动脉粥样硬化[11-12]、预防血栓形成[15-17]和抗急性肝损伤作用[18]。前期研究主要集中在药理与毒理方面,该药物对CYP450酶活性的影响尚不清楚。因此,本试验选择SD大鼠和C57小鼠为研究对象,将其分为空白对照组与试验组,采用ELISA方法,考察AEE对CYP450酶的6种主要亚型CYP3A4、CYP2C8、CYP2C19、CYP1A2、CYP2D6和CYP2C9活性的影响,预测AEE在动物体内可能引起的代谢性药物相互作用,为研究AEE与其他药物的相互作用及其作用机制奠定基础,为其兽医临床试验研究提供参考依据。
1.1 药品与试剂AEE(含量99.8%,中国农业科学院兰州畜牧与兽药研究所自制,批号:20190815);
羧甲基纤维素钠,大鼠CYP1A2试剂盒(批号:ml592615-J),大鼠细胞色素氧化酶2C8(CYP2C8)试剂盒(批号:ml696555-J),大鼠细胞色素P450家族成员2C9(CYP2C9)试剂盒(批号:ml846955-J),大鼠细胞色素P450家族成员2C19(CYP2C19)试剂盒(批号:ml565952-J),大鼠细胞色素P450酶亚型2D6(CYP2D6)试剂盒(批号:ml986556-J),大鼠细胞色素P450家族成员3A4(CYP3A4)试剂盒(批号:ml365254-J),小鼠CYP1A2试剂盒(批号:ml875116-J),小鼠细胞色素P450氧化酶2C8(CYP2C8)试剂盒(批号:ml763516-J),小鼠细胞色素P450家族成员2C9(CYP2C9)试剂盒(批号:ml563432-J),小鼠细胞色素P450家族成员2C19(CYP2C19)试剂盒(批号:ml578931-J),小鼠细胞色素P450酶亚型2D6(CYP2D6)试剂盒(批号:ml963546-J),小鼠细胞色素P450家族成员3A4(CYP3A4)试剂盒(批号:ml568741-J),以上试剂盒均购自上海酶联生物科技有限公司;
磷酸盐缓冲液(PBS)(索莱宝,批号:D1040-500);
乌拉坦(NJKOCED);
蛋白酶抑制剂(Thermo Fisher,货号:36978)。
1.2 实验动物40只清洁级SD大鼠,雄性,1月龄,体质量110~120 g;
40只清洁级C57小鼠,雄性,6~8周龄,体质量18~22 g,均购自中国农业科学院兰州兽医研究所,动物生产许可证号:NKMYD201907018。
1.3 溶液配制称取羧甲基纤维素钠适量,用蒸馏水配制成0.5%的溶液。试验前将AEE用研钵研磨成细粉。将研磨的AEE混悬在 0.5%的羧甲基纤维素钠中,配制成质量浓度为20 g/L的混悬液备用。
1.4 试验分组及给药方式将SD大鼠及C57小鼠,分别随机分为空白对照组和试验组,每组20只。空白组灌服0.5%的羧甲基纤维素钠溶液;
试验组灌服AEE(54 mg/kg)。每天1次,连续给药3周后,每组随机选取10只,禁食不禁水过夜,腹腔注射乌拉坦麻醉后,迅速处死,取出肝脏,用预冷的PBS(4℃预冷2 h)冲洗组织表面,去除表面残留的血液。各组的剩余大鼠,于停药2周后,以相同方式采集肝脏。
1.5 样品采集与处理将肝脏样品测质量后剪碎,与PBS(PBS中加入了蛋白酶抑制剂)按比例(1 g∶9 mL)混合,置于匀浆机中充分均质后,进行超声破碎,以使进一步裂解,然后4℃、5 000×g离心10 min,取上清液备用。上述操作均在冰浴条件下进行。
1.6 肝脏药物代谢酶活性的测定设置标准品孔和样品孔。根据试剂盒说明书操作步骤进行测定,在450 nm波长处测定各孔的D值。以所测标准品的D值为纵坐标,标准品的浓度值为横坐标,绘制标准曲线,并得到直线回归方程,将样品的D值代入方程,计算出样品中酶的活性。

2.1 SD大鼠与C57小鼠体质量变化受试动物适应一段时间后,开始正式试验。定期对其体质量进行记录。如图1所示,2组SD大鼠的体质量在给药和停药期间无显著性差异(P>0.05)。如图2所示,2组C57小鼠的体质量在给药和停药期间无显著性差异(P>0.05)。

图2 C57小鼠随时间体质量变化
2.2 标准曲线的建立根据试剂盒说明书分别建立SD大鼠和C57小鼠肝脏药物代谢酶标准曲线。结果显示,SD大鼠和C57小鼠CYP450酶的6种主要亚型CYP3A4、CYP2C8、CYP2C19、CYP1A2、CYP2D6、CYP2C9的标准曲线的相关系数R2均在0.99以上(图3,4)。说明在各质量浓度范围内,各酶标准曲线的线性良好,可以进行下一步试验。

A~F.分别为CYP3A4、CYP2C8、CYP2C19、CYP1A2、CYP2D6、CYP2C9亚型

A~F.分别为CYP3A4、CYP2C8、CYP2C19、CYP1A2、CYP2D6、CYP2C9亚型
2.3 给药后肝脏药物代谢酶活性如图5所示,SD大鼠连续灌服给药3周后,与对照组比较,AEE对CYP3A4、CYP2C19、CYP1A2的活性有显著的抑制作用(P<0.05),对CYP2C8的活性有显著的诱导作用(P<0.05),而对CYP2D6、CYP2C9的活性无显著影响(P>0.05)。

A~F.分别为CYP3A4、CYP2C8、CYP2C19、CYP1A2、CYP2D6、CYP2C9亚型。与空白对照组相比*P<0.05。下同
如图6所示,C57小鼠在连续灌药3周后,其酶活性结果与SD大鼠相似,即对CYP3A4、CYP2C19、CYP1A2、CYP2D6的活性有显著抑制作用(P<0.05),对CYP2C8的活性有一定的促进作用(P<0.05),对CYP2C9无显著影响(P>0.05);
然而,AEE给药后,C57小鼠CYP2D6的活性亦出现了明显的抑制(P<0.05)。

A~F.分别为CYP3A4、CYP2C8、CYP2C19、CYP1A2、CYP2D6、CYP2C9亚型
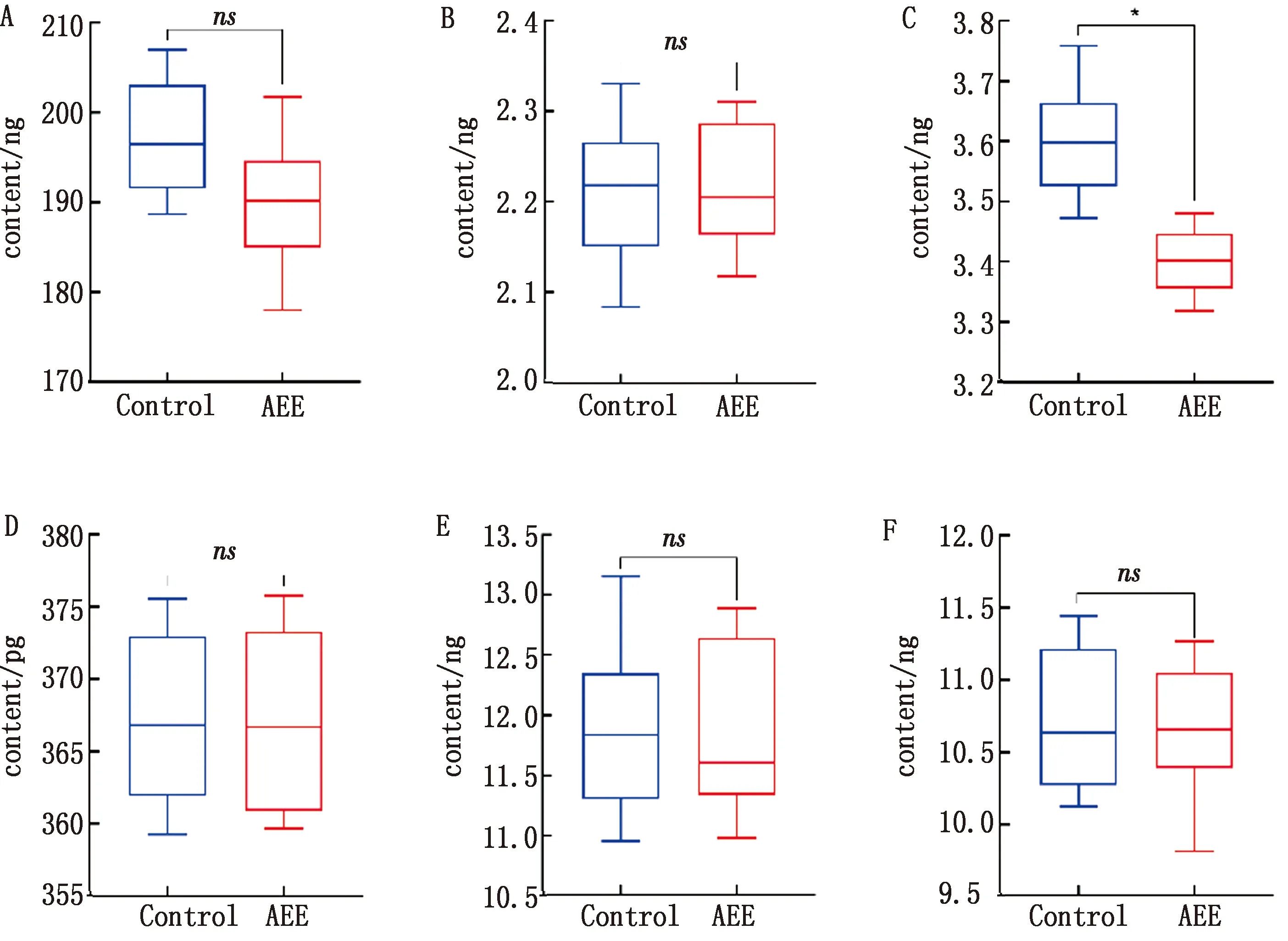
2.4 停药后肝脏药物代谢酶活性如图7所示,SD大鼠停药2周后,与对照组比较,仅CYP2C19的活性尚未恢复,而其余药酶活性皆有一定的恢复,与对照组无显著性差异(P>0.05)。

A~F.分别为CYP3A4、CYP2C8、CYP2C19、CYP1A2、CYP2D6、CYP2C9亚型
如图8所示,C57小鼠停药2周后,与对照组比较,发现只有CYP2C19的活性没有恢复,而其余药酶活性都有一定的恢复,与对照组无显著性差异(P>0.05)。
A~F.分别为CYP3A4、CYP2C8、CYP2C19、CYP1A2、CYP2D6、CYP2C9亚型
2.5 AEE对2种实验用鼠的肝脏主要药物代谢酶活性的影响AEE试验组与空白对照组2组实验鼠,在试验期间体质量无显著性差异(P>0.05),说明AEE在本试验期间对实验鼠体质量无显著性影响。本试验主要考察了AEE对CYP450酶的6种亚型:CYP3A4、CYP2C8、CYP2C19、CYP1A2、CYP2D6、CYP2C9的影响以及影响后的自我恢复。结果显示,AEE对CYP3A4、CYP2C19、CYP1A2的活性有一定的抑制作用(P<0.05),对CYP2C8的活性有一定的诱导作用(P<0.05),而CYP2C9的活性无显著性差异(P>0.05);
停药2周后,发现只有CYP2C19的活性没有恢复,而其余药酶活性都有一定的恢复,与空白对照组无显著性差异(P>0.05),详见表1。

表1 药酶(CYP)活性变化
CYP450酶属于血红素蛋白基因超家族,编码一系列的代谢酶,主要存在于肝脏内质网上[18]。该酶参与了大多数内源性和外源性化合物的代谢,药物的代谢速率依赖于其活性。已知的CYP450中主要有CYP1、CYP2、CYP3 三个家族,参与机体内的内源性和外源性化合物的生物转化[20]。CYP1A2是CYP450酶超家族中CYP1的重要亚型,主要分布在肝脏,参与约5%的临床药物,如咖啡因、非那西丁、茶碱、氯氮平和三环类抗抑郁药的代谢过程,同时在前致癌物与前毒物的生物转化过程中也起到了重要的作用[21]。CYP2C这个家族是CYP450超家族中最大的亚家族,包括CYP2C8、CYP2C9、CYP2C10、CYP2C19等多个亚型[22-24]。CYP2D6是一种主要的药物代谢酶,尽管只占肝脏酶总量的2%左右,但负责消除超过20%~30%的临床使用药物[25]。
CYP450酶的活性可被外源化合物影响,呈现可诱导性或可抑制性,从而在联合用药的过程中产生药物-药物相互作用,使得药效降低或发生药物不良反应[26]。一些CYP450可被诱导,而有些却对此不敏感;
前者称为诱导性P450,后者称为构成性P450[27]。有诱导作用的化合物大多数是该酶的底物或类似物[28],在生物合成中的作用是催化。化合物对CYP450酶的抑制可分为4类:可逆性竞争抑制、可逆性非竞争抑制、不可逆性抑制、干扰蛋白质合成。可逆性竞争抑制:同一种酶的两种底物竞争相同活性部位互为抑制,这是由底物重叠性的特点所决定的。如,美托洛尔和异喹胍都是CYP2D6的底物,当它们同时存在时,就存在竞争抑制[29]。可逆性非竞争抑制过程:物质本身可能无抑制作用,但其代谢产物与相应酶的亲和力较高,从而抑制物质本身的进一步代谢。随着代谢产物的消除,这种抑制作用也随之消除。如,食用调味品的成分黄樟醚的代谢过程[30]。不可逆性抑制:P450结构被破坏或造成蛋白质永久失活。如,农药1605、马拉硫磷对P450的抑制作用[30]。干扰蛋白质合成:动物机体若营养不良或有肝脏疾病,可抑制蛋白质P450的合成,从而抑制P450的活性。研究药物对CYP450酶的诱导和抑制,对于临床合理用药、提高药物疗效、降低药物的毒副作用具有重要意义。因此,本试验采用ELISA方法考察AEE对2种实验鼠的肝脏主要药物代谢酶活性的影响。
CYP2D6是CYP450酶系中重要的一种氧化代谢酶,其基因多态性对酶的活性有着至关重要的影响,是构成药物代谢个体差异和种族差异的基础[31-32],CYP2D6基因多态性对药物代谢起着重要的作用。本试验中AEE对SD大鼠和C57小鼠的CYP2D6活性的影响存在差异,原因可能是由于2种实验鼠的CYP2D6的基因型有差异,从而导致AEE对2种实验鼠的CYP2D6活性影响有一定的差异。
CYP3A4是CYP450酶中最重要的成分,约占CYP450酶总量的30%~40%,该酶在许多内外源化合物的代谢中起着重要作用。本试验结果表明AEE能够抑制CYP3A4的活性,研究发现阿司匹林也能够抑制CYP3A4的活性[33-34],提示AEE作为阿司匹林的衍生物,作用效果可能与阿司匹林相似。
CYP2C19是S-MP4羟化酶(S-美芬妥英羟化酶)[35],是第一代质子泵抑制剂奥美拉唑、兰索拉唑、泮托拉唑等药物的最主要代谢酶,其中奥美拉唑90%都是通过CYP2C19进行代谢的[36]。而AEE对CYP2C19的活性具有抑制作用,提示AEE与奥美拉唑联用,可能会提高奥美拉唑对消化道溃疡的治疗效果。
CYP1A2是CYP450酶中CYP1的重要亚型,主要分布在肝脏,参与约5%临床药物代谢。其活性与药物的疗效或毒性以及某些肿瘤的易感性密切相关,具有重要的生理学和毒理学意义[37-38]。AEE对CYP1A2的活性具有抑制作用,其作用机制需要进一步研究。
多种重要的药物都可作为CYP2C8的底物,包括抗癌药物、抗心律不齐药物、降血糖药物、抗癫痫药物、HMG-CoA还原酶抑制药物(他汀类药物)等,紫杉醇是CYP2C8的特征性底物[39]。紫杉醇(paclitaxel)是临床常用的抗肿瘤药,主要用于卵巢癌、乳腺癌及非小细胞肺癌的治疗,紫杉醇转化为其主要代谢产物6-羟基紫杉醇是由CYP2C8主要负责[40]。AEE对CYP2C8的活性有一定的诱导作用。结果表明,AEE与紫杉醇联用,可能会提高紫杉醇的抗肿瘤效果。
目前,关于药物之间相互作用的研究,主要集中在药物对肝脏药物代谢酶的诱导或抑制阶段,很少有关于被诱导或被抑制的肝脏药物代谢酶在停药后的自我恢复性研究。基于此,本试验还考察了AEE对被抑制或被诱导的肝脏药物代谢酶停止给药后的影响。根据SD大鼠和C57小鼠的结果可以得出:停药2周后,发现只有CYP2C19的活性没有恢复,而其余药酶活性都有一定的恢复,与空白对照组无显著性差异(P>0.05)。CYP2C19酶的活性不仅仅与遗传多态性相关,还与其他一些外在因素相关。目前为止,已经发现CYP2C19基因中存在30多个等位基因的突变体[40]。其中CYP2C19*1是编码正常酶活性的野生型。CYP2C19*2、CYP2C19*3为主要突变基因型,所表达的酶活性减低[42]。
AEE对CYP2C19的活性具有抑制作用,且该酶的活性在停药后2周仍未恢复。原因可能是服用AEE后引起CYP2C19基因发生了突变,从而导致CYP2C19酶活性降低,其具体的作用机制有待进一步研究。因此,AEE的临床使用,可能导致动物肝脏药物代谢酶的抑制或诱导,但停止用药后短期内可以恢复。结果表明,可以通过停止服用AEE,从而避免其与其他药物间的相互作用。
综上所述,本研究结果表明,AEE在临床使用中应注意由CYP450酶介导而可能发生的药物间的相互作用。临床使用AEE与其他药物合用时,要特别注意可能出现的药效学改变或出现的不良反应。
猜你喜欢亚型批号试剂盒一种JTIDS 信号批号的离线合批方法航天电子对抗(2022年4期)2022-10-24农药残留快速检测试剂盒的制备方法及其应用研究食品安全导刊(2021年21期)2021-08-30试剂盒法制备细胞块的效果及其技术要点天津医科大学学报(2019年6期)2019-08-13医学科技期刊中药品生产批号标注探析中国科技纵横(2018年2期)2018-11-29中药材批号划分与质量管理中成药(2018年7期)2018-08-04基于CLSI-M43国际标准改良的Mycoview-AST试剂盒检测性能评估现代检验医学杂志(2016年2期)2016-11-14Ikaros的3种亚型对人卵巢癌SKOV3细胞增殖的影响中国病理生理杂志(2015年8期)2015-12-21ABO亚型Bel06的分子生物学鉴定中国当代医药(2015年30期)2015-03-01HeLa细胞中Zwint-1选择剪接亚型v7的表达鉴定癌变·畸变·突变(2014年2期)2014-03-01牛结核病PCR诊断试剂盒质量标准的研究当代畜禽养殖业(2014年6期)2014-02-27