牛 爽, 何忠时, 曾 炼2,, 胡鹏超△, 王 静△
(1锦州医科大学湖北医药学院附属襄阳市第一人民医院研究生联合培养基地肿瘤科,湖北 襄阳 441000;
2华中科技大学同济医学院附属同济医院,湖北 武汉 430030;
3湖北医药学院附属襄阳市第一人民医院,湖北 襄阳 441000)
结直肠癌(colorectal cancer)是世界上第三大常见的肿瘤,也是世界上第二大肿瘤死亡的常见原因[1]。目前对结直肠癌的主要治疗方法分为手术、化疗和放疗,靶向及免疫治疗,但5年生存率仍然较低[2-3]。对于中晚期结直肠癌患者来说,化疗是重要的方法之一,主要为铂类药物,其中顺铂(cisplatin,Cis)是医治结直肠癌常用的化疗药物之一,而结直肠癌对顺铂产生耐药是其化疗失败的主要原因[4-5]。顺铂耐药性的机理错综复杂,其中包括与细胞质内亲核物种的结合,如谷胱甘肽(glutathine, GSH),一方面,可能是顺铂的细胞质效应基础,从而消耗抗氧化物质和激活氧化应激;
另一方面,亲核物种作为细胞质清除剂,限制顺铂的细胞毒性[6]。当对顺铂产生耐药性时,体内和体外都发现了GSH水平上升的现象,但GSH仍是维持细胞内氧化还原最重要的抗氧化剂,清除细胞内GSH有利于逆转顺铂耐药,从而提高肿瘤细胞对顺铂的敏感性[7]。研究证实肿瘤细胞在发生耐药时会启动抗氧化机制,特别是GSH水平的升高和活性氧(reactive oxygen species, ROS)水平的降低,使肿瘤细胞获得耐药性[8]。Stockwell等[9]研究表明GSH在铁死亡中发挥重要作用,GSH的合成与system xC-有关,通过 system xC-抑制胱氨酸的摄取会造成GSH的消耗和GPX4的失活,最终导致脂质过度氧化,细胞发生死亡。
2012年Dixon等[10]提出一种新的细胞死亡方式,主要是以铁过量、脂质过氧化物和ROS的过度积累为特征,即铁死亡。大量研究证实诱导铁死亡可逆转卵巢癌、头颈鳞癌、胃癌和肺癌等多种肿瘤细胞对顺铂的耐药性[11-14]。最近研究发现铁死亡抑制肿瘤的作用是由p53介导的[15]。p53是一种典型的抑癌基因,在调节细胞各种代谢和铁死亡相关基因的调控中发挥重要作用[16],p53通过抑制溶质载体家族7成员 11(solute carrier family 7 member 11, SLC7A11)重组蛋白的转录来阻断胱氨酸的摄入,从而限制细胞内GSH的合成,致使细胞对铁死亡的敏感性增加[17]。上述研究表明p53可以调控肿瘤细胞发生铁死亡。本研究主要探讨p53介导的铁死亡在结直肠癌细胞顺铂耐药中的作用及机制,为结直肠癌细胞顺铂耐药的治疗提供新的思路。
1 实验材料
顺铂购自江苏豪森药企;
胎牛血清(fetal bovine serum, FBS)和胰蛋白酶购自Gibco;
RPMI-1640培养液购自Sigma-Aldrich;
RNA反转录试剂盒和荧光定量PCR试剂盒购自TaKaRa;
erastin和liproxstatin-1购自 MedChemExpress;
Cell Counting Kit-8 (CCK-8)购自北京兰杰柯科技有限公司;
ROS检测荧光探针2",7"-二氯二氢荧光素二乙酸酯(2",7"-dichlorodihydrofluorescein diacetate, DCFH-DA)分析试剂盒和线粒体膜电位JC-1检测试剂盒购自江苏凯基生物技术股份有限公司;
细胞亚铁离子荧光探针购自Dojindo;
SDS-PAGE凝胶快速制备试剂盒购自沈阳万类生物科技有限公司;
细胞核染料Hoechst 33258、线粒体红色荧光探针MitoTracker Red CMXRos、BCA试剂盒和辣根过氧化物酶标记的山羊抗兔IgG购自杭州碧云天生物技术有限公司;
抗谷胱甘肽过氧化物酶4(glutathione peroxidase 4, GPX4)抗体和抗SLC7A11抗体购自Cell Signaling Technology;
抗p53抗体购自武汉三鹰生物技术有限公司;
引物购自生物生工工程(上海)有限公司,序列见表1。SpectraMax i3x酶标仪(Molecular Devices);
IX70倒置荧光显微镜(Olympus)。

表1 RT-qPCR引物序列Table 1. Sequences of the primers for RT-qPCR
2 方法
2.1 细胞株与细胞培养 课题组前期采用人结肠腺癌细胞株LOVO反复短期暴露于顺铂并逐渐增加顺铂浓度的方法建立耐顺铂细胞株LOVO/DDP。用含10% FBS和1%双抗(青霉素和链霉素)的RMPI-1640培养液培养LOVO和LOVO/DDP细胞,放入37 ℃、5% CO2培养箱培养。待细胞密度长至70%~80%,用胰蛋白酶消化,取对数生长期的细胞进行接种。
2.2 CCK-8法测定细胞活力 对数生长期的LOVO和LOVO/DDP细胞接种到96孔板中,密度为5×107/L,置于37 ℃、5%的CO2培养箱中培养。正常LOVO细胞经顺铂(0.5、1、2、4和8 mg/L)处理48和72 h,耐顺铂细胞株LOVO/DDP经顺铂(1、2、4、8和16 mg/L)处理48和72 h以及顺铂(2 mg/L)联合铁死亡激活剂erastin(1 μmol/L)或抑制剂 liproxstatin-1(10 μmol/L)处理48 h,并设置空白对照组,每个处理组设5个复孔,培养24 h后,弃掉旧培养液,加入含有上述药物的培养液培养48 h后,每孔加入10 μL CCK-8试剂,避光孵育2 h,用酶标仪测量450 nm处的吸光度,并计算顺铂的半数抑制浓度(IC50)。
2.3 ROS检测 把对数生长期的LOVO和LOVO/DDP细胞接种到96孔板中,细胞密度为5×107/L,设置对照组、顺铂(0.5、1和2 mg/L)组、顺铂(2 mg/L)联合铁死亡激活剂erastin(1 μmol/L)及顺铂(2 mg/L)联合铁死亡抑制剂liproxstatin-1(10 μmol/L)组。培养48 h后,弃掉旧培养液,PBS洗2遍,使用ROS绿色荧光探针DCFH-DA标记细胞中的ROS,放入培养箱中孵育15 min,用PBS洗2遍,在荧光显微镜观察并拍照。
2.4 MitoTracker检测 把对数生长期的LOVO和LOVO/DDP细胞接种到96孔板中,细胞密度为5×107/L,分组处理同上,培养48 h后,弃掉旧培养液,PBS洗2遍,用线粒体红色荧光探针MitoTracker Red CMXRos标记线粒体,加入200 μL工作液,放入培养箱中孵育15 min,在荧光显微镜观察并拍照。
2.5 JC-1检测线粒体膜电位 对数生长期的LOVO和LOVO/DDP细胞接种到96孔板中,细胞密度为5×107/L,分组处理同上,培养48 h后,弃掉旧培养液,用PBS洗2遍,加入的线粒体膜电位JC-1工作液200 μL,放入培养箱中孵育15 min后,用1× Incubation Buffer洗涤2遍,再加入4%多聚甲醛覆盖细胞,室温下固定30 min,用PBS洗2遍,然后加入Hoechst 33258标记细胞核,室温染色15 min,PBS洗2 遍,在荧光显微镜观察并拍照。
2.6 亚铁离子的检测 把对数生长期的LOVO和LOVO/DDP细胞接种到96孔板中,细胞密度为5×107/L,分组处理同上,培养48 h后,弃掉旧培养液,用无血清的培养液洗3遍,按照1∶1 000,将1 mol/L FerroOrange溶液配成终浓度为1 μmol/L的工作液,加入200 μL的FerroOrange工作液,置于37 ℃、5%的CO2培养箱孵育30 min,在荧光显微镜下观察并拍照。
2.7 Western blot 按照上述分组处理细胞,将加入RIPA裂解液的6孔板放在冰上15 min,用枪头刮取细胞,并在超声破碎仪下破碎细胞,然后在4 ℃、12 000 r/min下离心10 min,使用BCA法测定蛋白浓度。取20 μL蛋白样品进行SDS-PAGE,采用湿转法转印到PVDF膜上,将膜放入含有5%脱脂奶粉的TBST溶液中室温封闭1 h;
用TBST溶液按照1∶1 000(SLC7A11 和 GPX4)、1∶3 000(p53)和 1∶2 000(GAPDH)稀释Ⅰ抗,4 ℃孵育过夜,TBST洗3次,每次5 min;
Ⅱ抗(山羊抗兔IgG,1∶2 000)室温孵育2 h;
TBST洗3次,每次5 min;
用Gene Gnome XRQ化学发光成像系统获取图像,使用Bio-Rad凝胶成像系统对灰度值进行定量。
2.8 RT-qPCR检测mRNA表达 按照上述分组处理细胞,在6孔板中加入Trizol试剂裂解细胞,再加入氯仿和异丙醇提取细胞RNA并检测RNA浓度。将RNA在逆转录酶作用下逆转录为cDNA,再将cDNA进行PCR扩增。反应体系:
2 μL cDNA、10 μL 2×SYBR Green Super Mix、上下游引物各 1 μL 和 6 μL ddH2O,总体积为20 μL。反应条件:预变性95 ℃30 s,进行40个循环(95 ℃ 5 s,60 ℃ 30~40 s)。根据Ct值使用公式2-ΔΔCt计算mRNA的相对表达量。
3 统计学处理
使用SPSS 22软件进行数据分析。每个实验进行3次重复性独立实验,结果用均数±标准差(mean±SD)表示。采用t检验比较两组间的差异;
采用单因素方差分析(one-way ANOVA)比较多组间的差异,用SNK法进行多组间的两两比较。P<0.05表示差异有统计学意义。
1 调控铁死亡影响结直肠癌细胞对顺铂的敏感性
如图1A所示,与对照组相比,LOVO细胞在顺铂(0.5、1、2、4和8 mg/L)处理48 h和72 h后,细胞活力显著下降(P<0.01),呈剂量依赖性,48 h及72 h的IC50分别为1.822 mg/L和1.398 mg/L;
如图1B所示,耐顺铂细胞株LOVO/DDP在顺铂(1、2、4、8和16 mg/L)作用下细胞活力下降幅度低于LOVO细胞,48 h及72 h的IC50分别为4.091 mg/L和2.763 mg/L。顺铂(2 mg/L)单独及联合铁死亡激活剂erastin(1 μmol/L)或铁死亡抑制剂liproxstatin-1(10 μmol/L)处理后,在LOVO细胞中,与单独顺铂组比较,顺铂联合erastin组细胞活力下降,顺铂联合liproxstatin-1组细胞活力升高,见图1C;
在LOVO/DDP细胞中,与单独顺铂组比较,顺铂联合erastin组细胞活力由78.13%下降至40.25%(P<0.05),顺铂联合liproxstatin-1组细胞活力升高至85.97%(P<0.05),见图1D。

Figure 1. Effects of ferroptosis regulation on the viability of colorectal cancer cells. A and B:
CCK-8 assay was used to detect the viability of LOVO and LOVO/DDP cells treated with cisplatin (Cis) at different concentrations for 48 and 72 h;
C and D:CCK-8 assay was used to detect the viability of LOVO and LOVO/DDP cells treated with Cis alone or Cis combined with ferroptosis activator erastin (Era) or inhibitor liproxstatin-1 (Lip) for 48 h. Mean±SD. n=5. *P<0.05, **P<0.01 vs 0 mg/L or control group;
#P<0.05 vs Cis group.图1 调控铁死亡对结直肠癌细胞活力的影响
2 调控铁死亡影响顺铂敏感/耐药结直肠癌细胞的ROS合成
比较顺铂作用前后LOVO及LOVO/DDP细胞中ROS的合成,在LOVO细胞中,与对照组相比,随着顺铂浓度的增加,ROS的绿色荧光强度显著增加,呈剂量依赖性(P<0.01),顺铂(2 mg/L)作用48 h后平均荧光密度升高3.94倍,见图2A;
在LOVO/DDP细胞中,顺铂诱导ROS增加平缓,顺铂(2 mg/L)作用48 h后平均荧光密度仅升高1.47倍,见图2B。顺铂单独及联合使用erastin或liproxstatin-1处理LOVO和LOVO/DDP细胞,在LOVO细胞中,与单独顺铂组比较,顺铂联合erastin组ROS的荧光强度增加,顺铂联合liproxstatin-1组荧光减弱,见图2C;
在LOVO/DDP细胞中,顺铂联合erastin组ROS的平均荧光强度较单独顺铂组升高3.79倍(P<0.05),顺铂联合liproxstatin-1组ROS荧光信号与单独顺铂组差异不显著(P>0.05),见图2D。
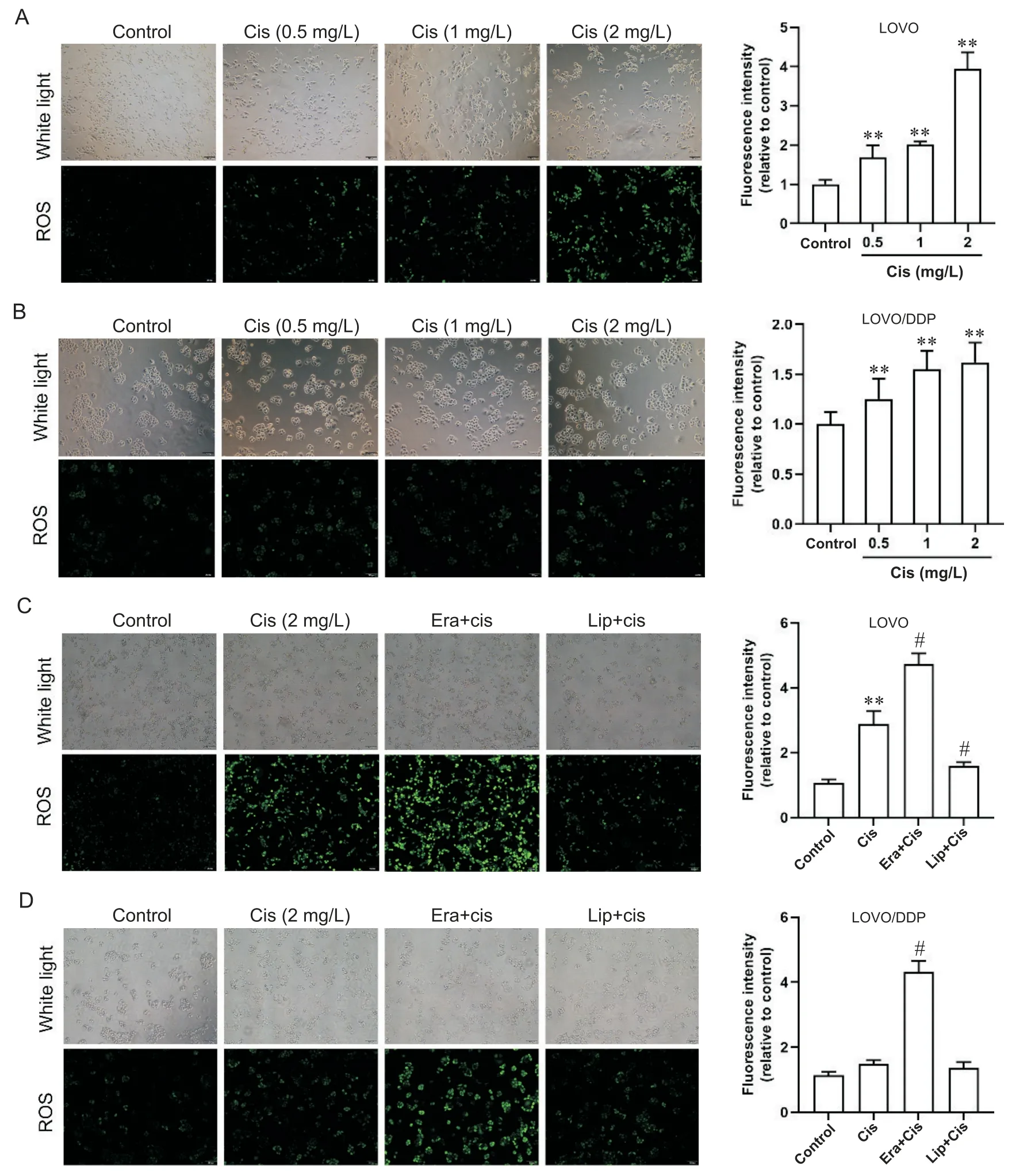
Figure 2. Effects of ferroptosis regulation on intracellular ROS synthesis in colorectal cancer cells. Intracellular ROS were labeled with H2DCFDA. A and B:
the LOVO and LOVO/DDP cells were treated with different concentrations of cisplatin(Cis) for 48 h;
C and D:
the LOVO and LOVO/DDP cells were treated with Cis alone or Cis combined with ferroptosis activator erastin (Era) or inhibitor liproxstatin-1 (Lip) for 48 h. The scale bar=100 μm. Mean±SD. n=3. **P<0.01 vs control group;
#P<0.05 vs Cis group.图2 调控铁死亡对结直肠癌细胞内ROS合成的影响
3 调控铁死亡影响顺铂敏感/耐药结直肠癌细胞的线粒体功能
比较顺铂作用前后LOVO及LOVO/DDP细胞的线粒体功能,线粒体MitoTracker荧光染色结果显示:顺铂诱导的LOVO细胞线粒体功能障碍,与对照组相比,线粒体红色荧光探针的信号强度随顺铂浓度增加下降明显,顺铂(2 mg/L)作用48 h后平均荧光强度下降65.2%(P<0.01),见图 3A;
在 LOVO/DDP细胞中,顺铂(2 mg/L)作用48 h后平均荧光强度仅下降32.9%,见图3B。顺铂单独及联合使用erastin或liproxstatin-1处理LOVO和LOVO/DDP细胞,在LOVO细胞中,顺铂联合erastin组线粒体红色荧光强度较单独顺铂组下降,顺铂联合liproxstatin-1组红色荧光强度升高,差异均有统计学意义(P<0.05),见图3C;
在LOVO/DDP细胞中,与单独顺铂组比较,顺铂联合erastin组线粒体红色荧光强度下降,顺铂联合liproxstatin-1组红色荧光强度升高,差异均有统计学意义(P<0.05),见图3D。
为进一步探讨铁死亡对顺铂敏感/耐药细胞株线粒体功能的影响,采用JC-1荧光探针检测细胞内线粒体膜电位水平。在LOVO细胞中,与对照组比较,单独顺铂组中红色荧光强度下降,JC-1聚合体减少,线粒体膜电位降低;
与单独顺铂组相比,顺铂联合erastin组红色荧光强度下降,顺铂联合liproxstatin-1组红色荧光强度升高(P<0.05),见图4A。在LOVO/DDP细胞中,单独顺铂组红色荧光强度与对照组差异不显著(P>0.05);
与单独顺铂组相比,顺铂联合erastin组的红色荧光明显下降,红色荧光与绿色荧光信号的比值显著减少,顺铂联合liproxstatin-1组红色荧光强度升高,红色荧光与绿色荧光信号的比值增加(P<0.05),见图4B。
4 调控铁死亡影响相关基因在顺铂敏感/耐药结直肠癌细胞中的差异表达
比较顺铂处理前后LOVO及LOVO/DDP细胞中铁死亡相关基因的表达水平,RT-qPCR结果显示:以LOVO细胞作为对照,促铁死亡相关基因(ACSL1、ACSL4、NCOA4和VDAC3)在LOVO/DDP细胞中低表达,顺铂(2 mg/L)处理48 h后,上述基因在敏感细胞系(LOVO细胞)中表达升高,而耐药细胞系(LOVO/DDP细胞)中未见明显变化(P>0.05),见图5A;
铁死亡抑制基因(GPX4、FTH1、NQO1和Nrf2)在LOVO/DDP细胞中高表达,顺铂(2 mg/L)处理48 h后,上述基因在敏感细胞系中表达升高,而耐药细胞系中差异无统计学意义(P>0.05),见图5B。
5 调控铁死亡影响顺铂敏感/耐药结直肠癌细胞亚铁离子含量及p53和铁死亡相关蛋白的表达
顺铂单独及联合使用铁死亡激活剂erastin(1 μmol/L)或铁死亡抑制剂liproxstatin-1(10 μmol/L)处理LOVO和LOVO/DDP细胞48 h后,亚铁离子荧光探针FerroOrange荧光染色结果显示:在LOVO细胞中,单独顺铂组荧光强度较对照组明显增加,联合铁死亡激活剂erastin处理后,红色荧光信号进一步增强,平均荧光强度较对照组升高2.25倍,联合铁死亡抑制剂liproxstatin-1处理,红色荧光强度显著降低(P<0.05),见图6A、B;
在LOVO/DDP细胞中,单独顺铂组荧光强度与对照组相比差异无统计学意义(P>0.05),联合erastin处理后,红色荧光明显增强,平均荧光强度较单独顺铂组升高2.52倍(P<0.05),联合liproxstatin-1处理后,平均荧光强度与单独顺铂组相比差异不显著(P>0.05),见图7A、B。顺铂单独及联合使用铁死亡激活剂erastin(1 μmol/L)或铁死亡抑制剂liproxstatin-1(10 μmol/L)处理 LOVO和 LOVO/DDP细胞48 h后,Western blot结果显示:在LOVO细胞中,与对照组相比,随着顺铂浓度的增加SLC7A11和GPX4蛋白表达逐渐降低,p53蛋白表达逐渐升高,与单独顺铂组相比,顺铂联合erastin组SLC7A11和GPX4蛋白表达下降(P<0.05),p53蛋白表达略升高,顺铂联合liproxstatin-1组SLC7A11和GPX4蛋白表达略升高(P>0.05),p53蛋白表达明显降低(P<0.05),见图6C~F;
在LOVO/DDP细胞中,与对照组相比,随着顺铂浓度的增加SLC7A11和GPX4蛋白表达逐渐降低,p53蛋白表达逐渐升高,与单独顺铂组相比,顺铂联合erastin组SLC7A11蛋白表达略降低,GPX4蛋白表达明显降低(P<0.05),p53蛋白表达略升高(P>0.05),顺铂联合liproxstatin-1组的SLC7A11和GPX4蛋白表达略升高(P>0.05),p53蛋白表达显著降低(P<0.05),见图7C~F。

Figure 3. Effects of ferroptosis regulation on mitochondrial function in colorectal cancer cells. Mitochondria were labeled with Mito-Tracker Red CMXRos. A and B:
the LOVO and LOVO/DDP cells were treated with different concentrations of cisplatin(Cis) for 48 h;
C and D:
the LOVO and LOVO/DDP cells were treated with Cis alone or Cis combined with ferroptosis activator erastin (Era) or inhibitor liproxstatin-1 (Lip) for 48 h. The scale=50 μm. Mean±SD. n=3. **P<0.01 vs control group;
#P<0.05 vs Cis group.图3 调控铁死亡对结直肠癌细胞线粒体功能的影响
结直肠癌是最常见的消化道系统恶性肿瘤之一,我国的结直肠癌发病率和死亡率逐渐上升[18]。顺铂是现代临床防治结直肠癌常用的化疗药剂,DNA是顺铂细胞毒性的重要靶点,主要与DNA上的嘌呤碱基配对进行链内交联,产生顺铂-DNA复合体,诱导DNA双链发生断裂,进而起到细胞毒性效应,最终导致肿瘤细胞凋亡[19]。然而,由于结直肠癌细胞对顺铂敏感性下降,导致顺铂的临床应用受到限制。因此,提高结直肠癌细胞对顺铂的敏感性是目前亟待解决的问题。研究证实肿瘤对顺铂耐药的主要机制包括DNA修复能力增强、药物积累减少,解毒的增强和凋亡逃逸[20]。Guo等[21]研究发现顺铂治疗肿瘤时会引起细胞凋亡和铁死亡,而顺铂耐药机制可以影响顺铂引起的细胞凋亡,但不影响顺铂引起的铁死亡。有文献表明铁死亡在逆转卵巢癌、肺癌和胃癌顺铂耐药性中发挥关键作用,而铁死亡在逆转结直肠癌顺铂耐药中的作用机制尚未完全清楚。张丽媛等[22]在2015年首次提出p53与铁死亡密切相关,认为p53通过转录的方式抑制SLC7A11的表达,诱导细胞发生铁死亡。本研究结果显示,与顺铂单药相比,顺铂联合erastin组LOVO/DDP细胞p53蛋白表达升高, SLC7A11蛋白表达下将及GPX4蛋白表达明显下降,顺铂联合Lip组p53蛋白表达降低,SLC7A11和GPX4蛋白表达升高,上述结果证实了p53的上调诱导LOVO/DDP细胞发生铁死亡,从而增强LOVO/DDP细胞对顺铂的敏感性。提示p53可能通过介导铁死亡增强结直肠癌细胞对顺铂的敏感性。

Figure 4. Effects of ferroptosis regulation on mitochondrial membrane potential in colorectal cancer cells. Mitochondrial membrane potential was detected by JC-1 probe. A:
the LOVO cells were treated with cisplatin (Cis) alone or Cis combined with ferroptosis activator erastin (Era) or inhibitor liproxstatin-1 (Lip) for 48 h;
B:
the LOVO/DDP cells were treated with Cis alone or Cis combined with Era or Lip for 48 h. The scale=50 μm. Mean±SD. n=3. **P<0.01 vs control group;
#P<0.05 vs Cis group.图4 调控铁死亡对结直肠癌细胞线粒体膜电位的影响
铁死亡是一种依赖铁的细胞死亡形式,在基因、生物化学和形态学上不同于其他细胞死亡方式,包括凋亡、坏死和自噬[22]。其主要特征为细胞内ROS的积累、GSH水平的降低及GPX4的失活[23]。Yu等[24]研究表明铁死亡激活剂可以诱导肿瘤细胞发生铁死亡,减轻肿瘤细胞对化疗药物的耐药并增加化疗效果,如erastin可以增强HL60细胞对阿糖胞苷和多柔比星的敏感性。Gao等[25]研究发现顺铂联合erastin可以增强人骨肉瘤MG63/DDP和Saos-2/DDP细胞对顺铂的敏感性。随着对铁死亡机制的进一步研究发现, erastin可以增加肿瘤细胞内ROS的水平和诱导线粒体功能障碍,致使肿瘤细胞激活氧化应激,最终诱导肿瘤细胞发生铁死亡[26]。最近的一项研究表明线粒体代谢通过促进膜电位超极化和脂质过氧化积累[27]调节铁死亡。本研究结果发现顺铂联合erastin相比顺铂单药,LOVO/DDP细胞活力显著下降,ROS水平显著增加及诱导线粒体功能障碍,结果表明诱导结直肠癌LOVO/DDP细胞发生铁死亡,可以增强顺铂耐药株LOVO/DDP细胞对顺铂的敏感性。研究发现细胞内铁积累可产生ROS,通过Fenton反应引起氧化应激,促进脂质过氧化,最终触发细胞发生铁死亡[23]。本研究证实顺铂联合erastin相比顺铂单药,LOVO/DDP细胞内的亚铁离子明显增加,结果表明LOVO/DDP细胞对顺铂的耐药性使细胞内铁离子水平较低致使铁死亡受到抑制,在联合铁死亡激活剂后,LOVO/DDP细胞内亚铁离子明显增加诱导铁死亡的发生,从而增强LOVO/DDP细胞对顺铂的敏感性。

Figure 5. Effects of cisplatin (Cis) on the mRNA expression of ferroptosis-related genes. RT-qPCR assay was used to detect the mRNA expression levels of genes promoting (A) or inhibiting (B) ferroptosis in LOVO and LOVO/DDP cells treated with 2 mg/L Cis for 48 h. Mean±SD. n=3. *P<0.05, **P<0.01 vs LOVO group;
#P<0.05, ##P<0.01 vs LOVO/DDP group.图5 顺铂对铁死亡相关基因表达的影响
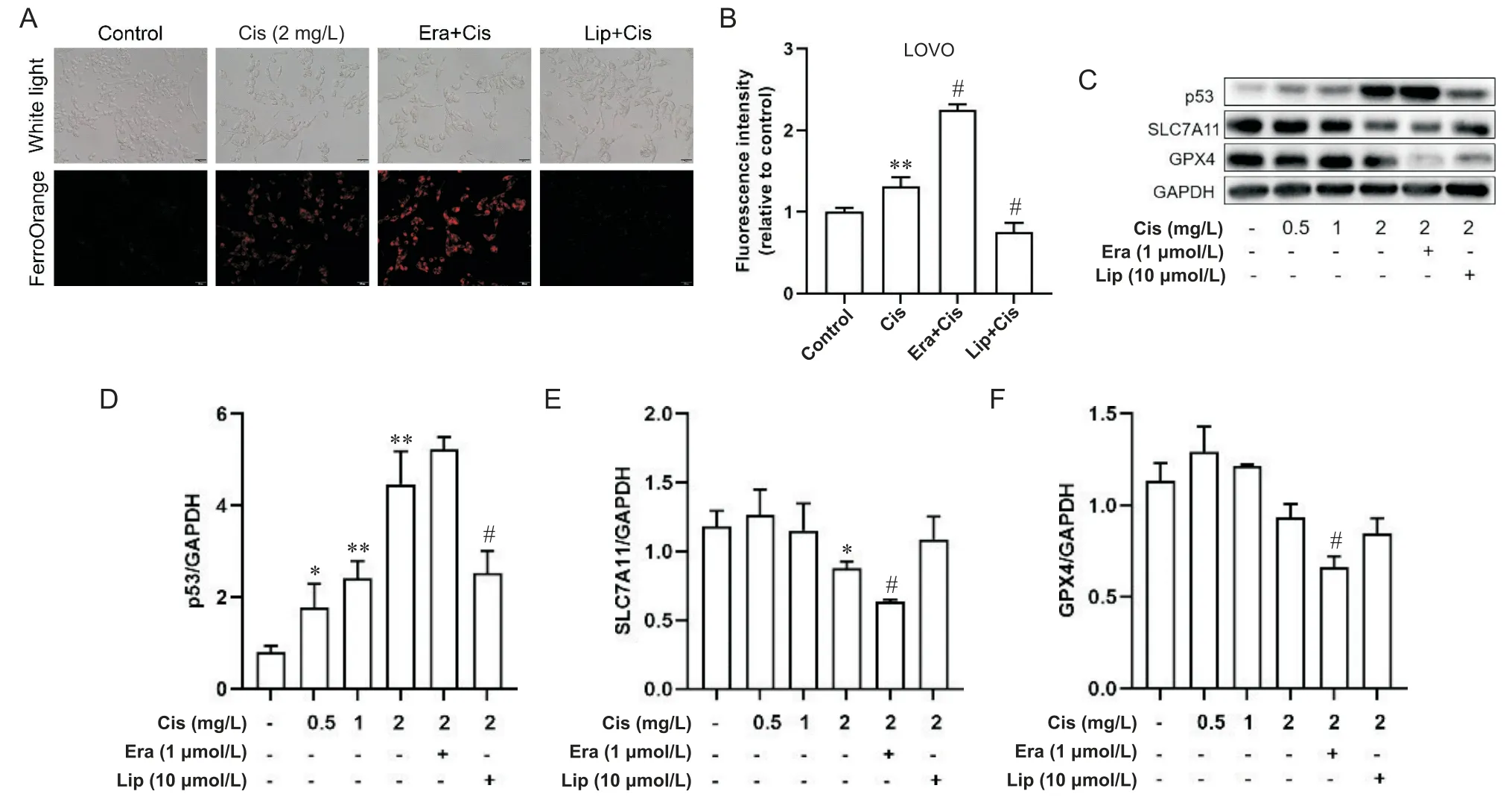
Figure 6. Effects of ferroptosis regulation on ferrous ion content, and p53 and ferroptosis-related protein expression in LOVO cells. A and B:
the ferrous ion content of LOVO cells treated with cisplatin (Cis) alone or Cis combined with ferroptosis activator erastin (Era) or inhibitor liproxstatin-1 (Lip) for 48 h was detected by ferrous ion fluorescent probes (scale bar=50 μm);
C to F:
the protein expression levels of p53, SLC7A11 and GPX4 in LOVO cells were detected by Western blot. Mean±SD. n=3. *P<0.05, **P<0.01 vs control group;
#P<0.05 vs Cis group.图6 调控铁死亡对LOVO细胞亚铁离子含量及p53和铁死亡相关蛋白表达的影响

Figure 7. Effects of ferroptosis regulation on ferrous ion content, and p53 and ferroptosis-related protein expression in LOVO/DDP cells. A:
the ferrous ion content of LOVO/DDP cells treated with cisplatin (Cis) alone or Cis combined with ferroptosis activator erastin(Era) or inhibitor liproxstatin-1(Lip) for 48 h was detected by ferrous ion fluorescent probes(scale bar=50 μm);
C to F:
the protein expression levels of p53, SLC7A11 and GPX4 in LOVO/DDP cells were detected by Western blot. Mean±SD. n=3. *P<0.05 vs control group;
#P<0.05 vs Cis group.图7 调控铁死亡对LOVO/DDP细胞亚铁离子含量、p53和铁死亡相关蛋白表达的影响
综上所述,本研究证实耐顺铂人结肠腺癌细胞株LOVO/DDP对顺铂的耐药性与铁死亡受到抑制有关,通过应用铁死亡激活剂,证实了激活铁死亡可以增强LOVO/DDP细胞对顺铂的敏感性。同时我们也发现激活LOVO/DDP细胞发生铁死亡后,细胞内SLC7A11和GPX4表达降低,p53表达升高,提示p53可能通过下调SLC7A11和GPX4蛋白的表达诱导LOVO/DDP细胞发生铁死亡,进而增强LOVO/DDP细胞对顺铂的敏感性。但p53调控铁死亡的通路网络复杂多样,需要进一步深入探究p53在调节肿瘤细胞对铁死亡敏感性的具体信号通路及机制,找到特定的信号通路作为研究靶点,为结直肠癌等恶性肿瘤的治疗提供新的研究依据。
猜你喜欢线粒体敏感性直肠癌线粒体自噬在纤维化疾病中作用的研究进展中华实用诊断与治疗杂志(2022年1期)2022-08-31棘皮动物线粒体基因组研究进展海洋通报(2021年1期)2021-07-23线粒体自噬与帕金森病的研究进展生物学通报(2021年4期)2021-03-16钇对Mg-Zn-Y-Zr合金热裂敏感性影响中国有色金属学报(2018年2期)2018-03-26腹腔镜下直肠癌前侧切除术治疗直肠癌的效果观察中国医药指南(2017年3期)2017-11-13AH70DB钢焊接热影响区组织及其冷裂敏感性焊接(2016年1期)2016-02-27直肠癌术前放疗的研究进展西南军医(2016年3期)2016-01-23COXⅠ和COX Ⅲ在结直肠癌组织中的表达及其临床意义中国继续医学教育(2015年6期)2016-01-07如何培养和提高新闻敏感性新闻传播(2015年8期)2015-07-18GRP及GRPR在结直肠癌中的表达及意义中国当代医药(2015年30期)2015-03-01