吴周璐,龚颖芸,付真真,周红文
南京医科大学第一附属医院内分泌科,江苏 南京 210029
随着现代社会生活方式和饮食结构的改变,肥胖(obesity)的发生率不断升高,目前肥胖及其相关并发症已经成为世界性的公共卫生问题。2020年发布的《中国居民营养与慢性病状况报告》显示,我国超重人口已达3.25亿,占据成年总人口的30.1%,其中肥胖人群数量接近9 000万[1]。当摄入能量大于消耗能量时,机体会将过剩能量转变为脂肪进行贮存,进而导致肥胖的发生发展。进一步根据肥胖症患者的相关代谢指标水平(如血糖、血压和血脂水平等)进行分类,可将其分为代谢健康的肥胖患者(metabolically healthy obesity,MHO)[2-3]和代谢不健康的肥胖患者(metabolically unhealthy obesity,MUO)[4]。除生活方式和药物干预外,减重代谢手术已成为目前治疗重度肥胖及其并发症的有效手段[5-6]。
脂肪组织作为一个复杂的内分泌器官,除了脂肪细胞外,还包含了免疫细胞、血管基质细胞、结缔组织和神经组织等多种成分。既往研究表明,增生肥大的脂肪组织中通常伴随各类免疫细胞的异常浸润,导致肥胖症患者体内持续的低水平慢性炎症状态,并影响机体的糖脂代谢能力,造成相关临床指标的异常改变,进而引起相关并发症,例如胰岛素抵抗(insulin resistance,IR)[7]、心血管疾病[8-10]以及非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)[11-12]等。
根据部位的不同,脂肪组织主要分为皮下脂肪组织(subcutaneous adipose tissue,SAT)和内脏脂肪组织(visceral adipose tissue,VAT)两大类。VAT 中的固有免疫细胞群与肥胖状态下脂肪组织稳态及低水平炎症的调节有关,并伴有数量和功能的改变[13]。针对肥胖人群的研究证实,VAT中巨噬细胞浸润最为明显,相关炎症因子水平与VAT中巨噬细胞水平呈正相关,并且糖代谢受损亚组人群脂肪组织表现为巨噬细胞优先向VAT浸润的表型[14];
另有研究显示,VAT分布对于代谢综合征(metabolic syndrome,MS)的发生具有预测作用[15-16],均提示VAT的异常扩增伴随炎症细胞浸润可能是影响不同肥胖个体代谢功能的关键因素。近期相关研究发现,特殊类型的B细胞所产生的IgG可能是介导肥胖炎症发展的关键因子,再次强调了免疫细胞在肥胖相关炎症发生过程中的重要作用[17]。
本课题组前期的脂肪组织RNA-seq研究结果表明,与体重正常(lean)组相比,MHO 组及MUO 组间VAT差异表达基因富集于炎症免疫通路[18],从而引起思考:不同体重人群的VAT内免疫细胞浸润情况是否存在差异?其与代谢相关差异表达基因是否存在关联?故本研究针对以上3组间VAT中各类免疫细胞占比及变化情况进行探究,并通过MHO组及MUO 组间差异表达的免疫细胞与RNA-seq 中差异表达的炎症及免疫反应通路基因进行关联性分析,旨在评估肥胖患者代谢能力受损与各类免疫细胞占比改变的相关性。
1.1 对象
收集于南京医科大学第一附属医院因肥胖行代谢手术治疗的48 例患者及体重和代谢指标正常但因其他非炎症性疾病(疝气、胆结石及肾囊肿等)行腹腔镜手术的11例患者的内脏脂肪组织标本,同时汇总了患者相关病史及临床检查数据。该项目获得南京医科大学第一附属医院伦理委员会批准(2016-SR-220),且所有标本的收集均在术前获得患者书面的知情同意。
MUO 组的定义[4]:患者体重指数(body mass index,BMI)≥28 kg/m2,且至少满足以下标准中的3项:空腹血糖≥5.6 mmol/L,收缩压≥130 mmHg,舒张压≥85 mmHg,甘油三酯(triacylglycerol,TAG)>1.7 mmol/L,高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-c)<1.3 mmol/L(女性)或<1.04 mmol/L(男性)。MHO 组的定义[2,19]:患 者BMI≥28 kg/m2,空腹血糖<5.6 mmol/L,收缩压<130 mmHg,舒张压<85 mmHg,TAG<1.7 mmol/L,且既往无高脂血症、高血压、糖尿病等病史。Lean组的定义:患者BMI<28 kg/m2。
1.2 方法
1.2.1 RNA提取及RNA-seq测序
收集的内脏脂肪组织标本均通过TRIzol法提取RNA,使用Qiagen RNeasy 试剂盒纯化后,通过琼脂糖凝胶电泳、Nanodrop 及Agilent2100确认每个样品的RNA 质量。基于Illumina 平台的NEBNext Ultra RNA Library Prep Kit 制备每个样品的RNA-seq库,并在Illumina HiSeq 4000平台上进行RNA-seq。
1.2.2 免疫细胞构成比计算
利用在线数据库CIBERSORT(https://cibersortx.stanford.edu/)[20],对RNA-seq 数据进行基于线性支持向量回归原理的反卷积分析,可计算获得22种不同类型和功能的免疫细胞在内脏脂肪组织样本中的占比分数。
1.3 统计学方法
应用SPSS 25 软件进行相关数据的统计分析,并对各项指标进行正态分布和方差齐性检验。3组间比较应用单因素方差分析,事后比较应用邓尼特t检验;
相关性分析应用Pearson 相关分析。P<0.05为差异有统计学意义。图片由GraphPad Prism 8 软件绘制。
2.1 3组人群分组情况及相关临床指标
首先对相关患者的代谢特征数据(如年龄、性别比、BMI 及空腹血糖等)按照分类标准进行统计,最终符合标准的Lean组、MHO组及MUO组入组人数分别为11例、22例及26例,其具体临床数据见表1。
表1 3组人群的临床指标Table 1 Clinical characteristics of three groups of participants()
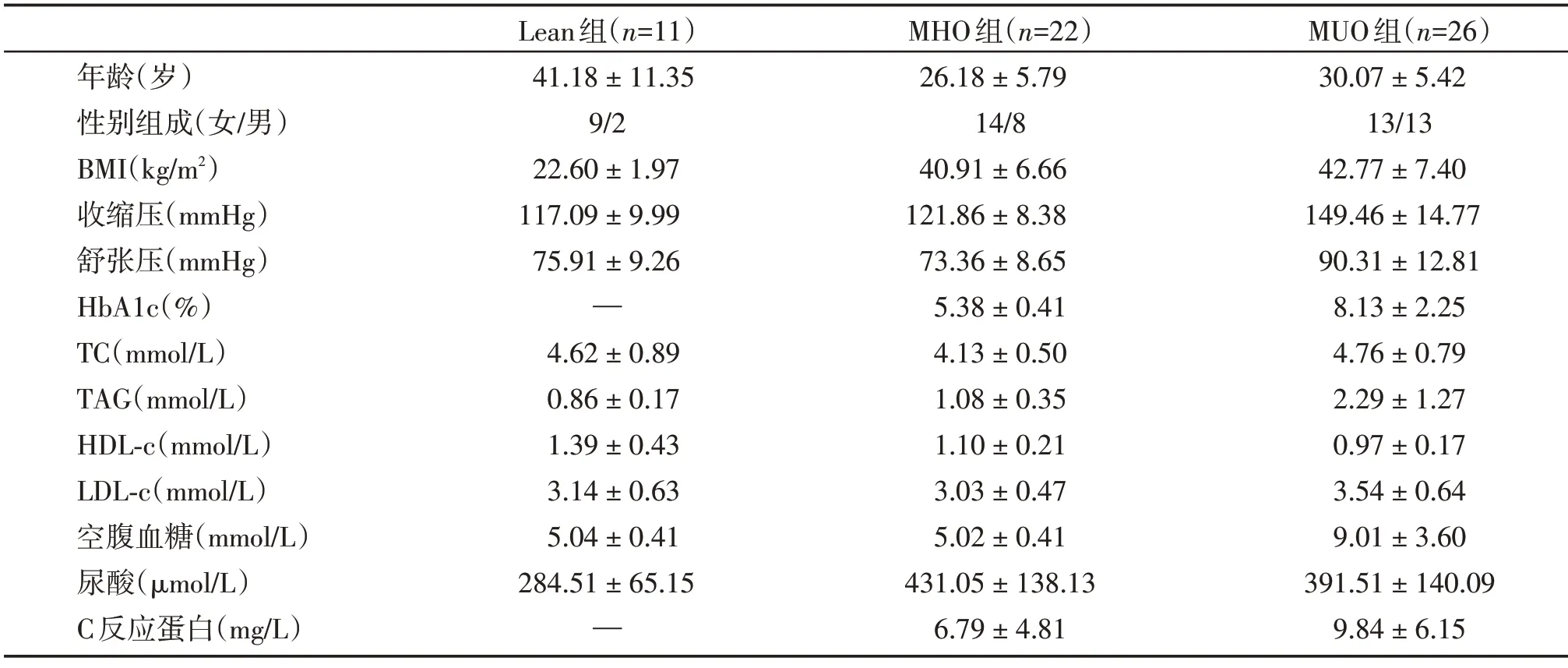
表1 3组人群的临床指标Table 1 Clinical characteristics of three groups of participants()
HbA1c:糖化血红蛋白;
TC:总胆固醇;
TAG:甘油三酯;
HDL-c:高密度脂蛋白胆固醇;
LDL-c:低密度脂蛋白胆固醇。
2.2 3组人群内脏脂肪组织中的免疫细胞占比情况
将3 组人群的内脏脂肪标本提取RNA 并进行RNA-seq测序,利用在线数据库CIBERSORT进行数据处理分析,可以推算得到共22种免疫细胞在VAT中的占比情况。
与Lean 组比较,MHO 及MUO 组人群VAT 中的巨噬细胞占比变化明显,其中以M2 型巨噬细胞表达增加为主(图1)。

图1 3组人群内脏脂肪组织RNA-seq分析所得相关免疫细胞占比情况Figure 1 Proportion of immune cells in VAT among three groups from RNA-seq analysis
通过分析各类免疫细胞在组间的表达差异,发现调节性T 细胞(regulatory T cell,Treg)在3 组间的比例呈依次递减的趋势[Lean 组(7.08±4.04)%,MHO 组(5.69±3.45)%,MUO 组(4.08±2.59)%],且Lean组与MUO组的Treg比例存在统计学差异(Lean组与MUO 组比较,P=0.031,图2A)。而被激活的自然杀伤(natural killer,NK)细胞则在Lean 组中占比较高,为(4.53±2.80)%,在肥胖的两组人群间比较,MUO 组被激活的NK 细胞占比有高于MHO 组的趋势,但两组间无统计学差异[MHO组(1.78±1.73)%,MUO 组(2.32±1.87)%,MHO 组与MUO 组比较,P=0.361,图2B]。免疫细胞中的巨噬细胞亚群中,M1型巨噬细胞的占比在3 组间没有明显改变[Lean 组(0.04±0.14)%,MHO 组(0.11±0.42)%,MUO 组(0.21±0.38)%,图2C]。M0 型巨噬细胞的占比在MUO组明显升高,而在代谢正常的两组间没有明显差 异[Lean 组(2.69 ± 4.45)%,MHO 组(3.13 ±7.46)%,MUO 组(12.00±12.79)%,Lean 组与MUO组比较,P=0.011;
MHO 组与MUO 组比较,P=0.003,图2D]。发挥抗炎作用的M2 型巨噬细胞占比的改变最为明显,无论是MHO组还是MUO组,对比Lean组,M2 型巨噬细胞的占比都明显增加[(Lean 组(20.63±7.72)%,MHO 组(28.54±9.76)%,MUO 组(28.51±7.19)%,Lean 组与MHO 组比较,P=0.013;
Lean组与MUO组比较,P=0.011,图2E]。

图2 3组人群内脏脂肪中差异表达的免疫细胞亚群Figure 2 Differentially expressed immune cell subclasses in VAT among three groups
通过分析各亚型巨噬细胞在整群巨噬细胞中的占比(图3)发现,相较MHO组,MUO 组VAT 中的M2 型巨噬细胞在巨噬细胞整群中占比明显下降[Lean 组{88.99 ± 15.01)%,MHO 组(90.75 ±18.79)%,MUO 组(73.82±23.55)%,MHO 组与MUO组比较,P=0.012],而促炎的M1 型巨噬细胞在巨噬细胞整群中占比则有相对升高的趋势[Lean 组(0.14±0.46)%,MHO 组(0.27±0.92)%,MUO 组(0.46±0.86)%],提示MUO 组内VAT 中存在较高的炎症水平,且这种持续慢性低炎症水平状态与肥胖患者代谢紊乱的发生有关。

图3 3 组人群内脏脂肪中M1(A)和M2 型(B)巨噬细胞在总巨噬细胞中的占比Figure 3 The proportion of M1(A)and M2(B)macrophages in total macrophages in VAT among three groups
2.3 MHO与MUO组间GPR183和C5AR1与巨噬细胞亚群水平存在相反关联性
在既往对相关RNA-seq 数据的分析统计中,已经明确了内脏脂肪组织中存在30 余种基因在Lean组、MHO组及MUO组间皆存在差异性表达,尤其是部分炎症通路和免疫反应相关基因,如C5AR1、GPR183、IL1RN、ITGAX、CD300LB及MSR1等,与空腹血糖、收缩压等代谢指标关联[18],提示机体内部炎症反应与代谢健康状态具有一定相关性。利用The Human Protein Atlas 数据库查询C5AR1 等差异表达基因在脂肪组织中的单细胞测序结果,可以发现这些基因多数仅在以巨噬细胞为主的免疫细胞中存在高表达(图4)。

图4 脂肪组织单细胞测序中C5AR1、GPR183、IL1RN、ITGAX、CD300LB和MSR1的表达水平Figure 4 Expression levels of C5AR1、GPR183、IL1RN、ITGAX、CD300LB and MSR1 in single-cell sequencing of adipose tissue
接着,又将已明确的31种在3组间差异表达的基因[18]与有差异的免疫细胞(Treg 细胞,激活的NK细胞,M0、M1及M2型巨噬细胞)占比进行相关性分析(图5)。在MHO与MUO组中,与代谢指标无相关性的差异表达基因与巨噬细胞亚类的关联性相对较弱,与代谢指标具有相关性的基因多与巨噬细胞亚类存在较强关联。进一步地对与代谢指标相关的基因进行分析,发现数种基因的表达水平,如SPP1、CHIT1、ITGAX、CD300LB、IL1RN 及DCSTAMP等,与M0、M1 型巨噬细胞的占比呈正相关关系,而与M2 型巨噬细胞的占比大多数呈负相关关系。但MHO 与MUO 两组间的不同之处在于C5a受体1(Complement fragment 5a receptor 1,C5AR1)与G 蛋白偶联受体183(G-protein coupled receptor 183,GPR183)基因与巨噬细胞亚型的关联性,这两种基因在MHO 组中表现为与M0 及M1 型巨噬细胞占比正相关,与M2型巨噬细胞占比负相关;
在MUO组中则呈现相反的关联性。

图5 3组人群中免疫反应及炎症通路基因表达与免疫细胞比例的相关性分析Figure 5 The correlation of gene expression of immune response and inflammation and proportion of immune cells among three groups
结果证明,相较体重正常组,两组肥胖患者的巨噬细胞整体表达水平都明显提高;
同时在两组肥胖患者间比较巨噬细胞亚群的整体占比,抗炎的M2型巨噬细胞的比例在MUO 组中较MHO 组下降,提示代谢异常的肥胖患者体内的炎症水平相对更高。造成这种改变的具体机制为肥胖时增生的脂肪组织通过释放白介素-6(interleukin-6,IL-6)、白介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)及单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)等炎症因子和细胞因子,激活并募集以巨噬细胞为主的免疫细胞[21-22],成为病理性免疫反应的激活部位,表现为肥胖机体内的慢性持续性低水平炎症状态,最终导致机体代谢水平改变。
除了巨噬细胞亚群外,Treg表达水平在MUO组中下降明显。Treg主要在免疫反应中调节效应性T细胞和B 细胞的作用以维持免疫稳态,同时也通过分泌细胞因子白介素-10(interleukin-10,IL-10)等参与抗炎调节[23]。Treg被证明与促炎型巨噬细胞存在拮抗作用并可改善胰岛素抵抗[24-26],故肥胖状态下Treg数量与功能下调与代谢紊乱的发生较为相关。
在激活的NK细胞分组中,MUO组相较MHO组的细胞占比有上升趋势。NK细胞与巨噬细胞在功能上存在双向调节作用[27],并且Lee等[28]的动物研究证明,在肥胖状态下NK细胞能够调节巨噬细胞向促炎方向极化,从而引起胰岛素抵抗等代谢状态紊乱的发生。但本研究中,激活的NK细胞水平在体重正常的对照组较肥胖组别更高,可能是由于部分体重正常的对照者术中取材部位源自于肿块周边的脂肪组织,进而引起了激活的NK细胞水平表达差异。
在前期研究中发现,3 组间的差异表达基因主要集中于免疫反应与炎症通路,其中部分基因与代谢参数相关[18],且多数仅在脂肪组织的巨噬细胞等免疫细胞中高表达。继续对肥胖状态下上调的炎症通路基因与VAT 中差异表达的免疫细胞占比进行关联分析验证,结果提示肥胖组中SPP1、CHIT1、ITGAX、CD300LB、IL1RN 及DCSTAMP 等差异表达基因与VAT中发挥促炎作用的M1型巨噬细胞占比正相关,与发挥抗炎作用的M2 型巨噬细胞占比负相关,再次印证了肥胖个体VAT中巨噬细胞浸润增加,进而导致组织内高炎症水平状态。
与此同时,C5AR1 及GPR183 作为同样在巨噬细胞中高表达并且与代谢指标相关的差异表达基因,在MHO与MUO组间,对二者与VAT中巨噬细胞占比进行统计却表现出了相反的相关性,这种相反的趋势提示我们思考:这两种基因是否存在作为预测肥胖患者代谢状态改变的相关因子的可能性?
C5AR1 为补体C5a 的对应受体,可以激活多条重要信号通路途径以正向调控炎症反应[29-31]。既往动物实验证明,饮食诱导肥胖小鼠模型的脂肪组织中C5AR1的表达水平明显升高;
全身敲除C5AR1的小鼠在高脂喂养的条件下与对照组相比胰岛素敏感性得到改善,这可能与敲除C5AR1后脂肪组织中M1型巨噬细胞数量减少及抗炎因子IL-10的表达增加有关[32]。在高脂饮食诱导下,全身敲除C5AR1的小鼠性腺脂肪及腹股沟脂肪质量较野生型小鼠明显减少,伴随更高的餐后脂质清除率和较低的血浆甘油三酯及游离脂肪酸水平,该过程可能与C5AR1及C5AR 样受体(C5aR-like receptor 2,C5L2)具有互作关系并形成异二聚体有关[33-34]。
GPR183 作为在多种免疫细胞表面表达的一种G 蛋白偶联受体,与免疫反应的激活与免疫细胞的迁移定位有直接关系[35]。Copperi 等[36]最新研究发现,GPR183 在棕色脂肪组织(brown adipose tissue,BAT)中高表达,通过应用其内源性配体7α,25-二羟基胆固醇(7α,25-dihydroxycholestero)可以激活BAT中的GPR183 从而抑制BAT 产热功能,降低能量消耗,但GPR183在白色脂肪组织(white adipose tissue,WAT)中发挥何种作用尚未明确。故C5AR1 和GPR183 确可影响脂肪组织功能,但这二者在脂肪组织扩增过程中是如何引起机体代谢能力改变的,其具体机制仍需要更深入的基础实验进行验证。
综上,本文通过RNA-seq 技术分析了正常体重者与不同代谢状态的肥胖症患者的VAT 中各型免疫细胞占比变化与部分免疫反应通路基因的关联性,再次验证了代谢正常及异常的肥胖患者内脏脂肪组织中免疫细胞亚类的构成变化情况,并且分析得到C5AR1及GPR183基因与肥胖患者巨噬细胞亚群占比及代谢状态变化有关,具有作为预测肥胖代谢状态生物学因子的潜能。
猜你喜欢脂肪组织内脏组间达格列净对预混胰岛素治疗血糖控制不达标的2型糖尿病患者的疗效和安全性研究健康之友(2022年23期)2022-12-29GDM孕妇网膜脂肪组织中Chemerin的表达与IRS-1及其酪氨酸磷酸化分析昆明医科大学学报(2022年1期)2022-02-28高脂肪饮食和生物钟紊乱会影响体内的健康脂肪组织中老年保健(2021年9期)2021-08-24双源CT对心脏周围脂肪组织与冠状动脉粥样硬化的相关性昆明医科大学学报(2021年8期)2021-08-13空心猪散文诗世界(2019年6期)2019-09-10多发内脏动脉瘤合并右侧髂总动脉瘤样扩张1例中国临床医学影像杂志(2019年6期)2019-08-27好吃的内脏意林·全彩Color(2019年7期)2019-08-13数据组间平均数、方差关系的探究中学生数理化·七年级数学人教版(2019年6期)2019-06-25要背沟,不要“虎背熊腰”家庭百事通·健康一点通(2018年4期)2018-05-16更 正中华皮肤科杂志(2018年4期)2018-01-22