王银龙 彭啟敏 贾 盛 王璐瑶 乔献琦 陈伟丽 苏战强 王金泉
(新疆农业大学动物医学学院,乌鲁木齐 830052)
禁止在饲料中使用抗生素作为生长促进剂已成为全球农业养殖的流行趋势,因此,使用益生菌作为抗生素替代品在家畜养殖中已变得越来越广泛,可以最大限度地减少动物肠道疾病的发生[1-2]。研究称同源益生菌可更好地在宿主肠道定植,因此候选益生菌应从目标动物的肠道中分离[3]。芽孢杆菌属在高热环境和低温储存过程中具有良好的稳定性[4],此外,芽孢杆菌属还被证明具有排除病原体、抗氧化、抗菌、免疫调节的能力[5-7]。龙舌兰芽孢杆菌是芽孢杆菌属的一种,能形成生物膜,且具有抗真菌生长的作用,可促进植物的生长[8]。Abid等[9]研究发现,从山羊奶中得到的龙舌兰芽孢杆菌-GM,可抑制和破环病原微生物的成膜能力,可用作乳制品的发酵剂。Parveen等[10]研究发现,鸡源龙舌兰芽孢杆菌FR9胞外多糖的含量较多且能与多种病原体聚集,对HCT-116人结肠癌细胞系具有很强的黏附性并能减少李斯特菌和粪肠球菌的数量。骆驼可以充分利用荒漠的自然资源,对其生态环境条件有很强的适应能力,不同于一般畜禽,饲养环境一般在荒漠,所用抗生素种类数量较少,从其肠道分离的益生菌获得性耐药的可能性较小。且国内外研究骆驼源益生菌集中从驼奶中分离,而关于骆驼源肠道益生菌的研究很少。因此,本研究旨在寻找具有优良益生特性的骆驼源菌株,以及证明其安全性,为双峰驼的健康养殖提供理论依据。
1.1 试验材料
1.1.1 试验动物
提供粪便样品的骆驼来源于阿勒泰地区吉木乃县万驼园实践基地。雄性昆明种小鼠[4周龄,无特定病原体(SPF)级,体重(20±2) g]共48只,购自新疆医科大学实验动物中心,自由饮水和采食。
1.1.2 试验试剂及供试菌
LB固体及液体培养基、牛胆盐,北京索莱宝科技有限公司产品;
芽孢杆菌生化鉴定条,青岛海博生物技术有限公司产品;
细菌药敏纸片(批号:20172400206),杭州滨和微生物试剂有限公司产品;
小鼠血清谷丙转氨酶、尿素氮、总蛋白检测试剂盒,武汉伊莱瑞特生物科技股份有限公司产品。大肠杆菌、金黄色葡萄球菌、沙门氏菌菌株由新疆农业大学动物医学学院临床兽医学实验室保存。
1.2 试验方法
1.2.1 样品采集
无菌收集骆驼新鲜粪便共计23份。
1.2.2 芽孢杆菌初分离
取骆驼新鲜粪便放入无菌的磷酸盐缓冲溶液(PBS)中,涡旋混匀,在水浴锅80 ℃加热处理15 min,预培养16~18 h,梯度稀释,取10-4、10-5和10-6稀释度的菌液于LB琼脂平板上涂布,倒置培养。挑出不同形态的单菌落,接种纯化3代,直至平板上的菌落形状、大小、颜色一致,革兰氏染色法观察菌体形态,然后将其与50%灭菌甘油按1∶1混合,在-80 ℃冰箱中储存备用。
1.2.3 分离菌株的益生菌潜力筛选
1.2.3.1 耐酸性
将分离菌株接种于新鲜的LB营养肉汤中,37 ℃、180 r/min过夜,在室温下6 000 r/min离心3 min。无菌PBS洗涤3次,再悬浮于10 mL无菌PBS(pH 2.5)中,以无菌PBS(pH 7.2)为对照[11]。培养3 h,在培养过程中分别于1、2、3 h测定600 nm处的吸光度(OD600)值,试验重复3次,计算相对存活率。
相对存活率(%)=(试验组平均OD600/对照组平均OD600)×100。
1.2.3.2 耐胆盐
用牛胆盐配制胆盐浓度0.3%的LB肉汤,以不加胆盐的LB肉汤作为对照,将各菌液分别接种于新鲜的LB肉汤中扩增培养,37 ℃、180 r/min过夜,在室温下6 000 r/min离心3 min。无菌PBS洗涤3次,以1%接种量再悬浮在0.3%胆盐的LB液体培养基中[12]。培养6 h,然后分别于2、4、6 h测定OD600,试验重复3次,计算相对存活率,计算公式同上。
1.2.3.3 药敏试验
挑选耐酸、耐胆盐活性优异且稳定的分离菌株,采用K-B纸片扩散法测定菌株的抗生素抗性[13],选取青霉素G、苯唑西林和四环素等13种药物进行抗生素敏感性试验。
1.2.3.4 溶血活性测定
待测菌株在LB肉汤培养基中活化后,在血平板上划线,37 ℃培养24 h,观察菌落形态是否发生变化,周围是否出现溶血环。
1.2.3.5 抗菌活性测定
采用琼脂扩散法进行抑菌试验[14]。将3株致病菌复苏,过夜培养;
将分离菌株接种至LB液体培养基,过夜培养。取病原菌液50 μL于营养琼脂平板上,涂抹均匀,上面水平放置牛津杯,在牛津杯中分别加入200 μL分离菌株的菌液(108CFU/mL),过夜培养,测量抑菌圈直径。
1.2.4 芽孢杆菌分离株的鉴定
1.2.4.1 生化鉴定
复苏菌株,用芽孢杆菌生化鉴定条进行生化反应鉴定,结果参照《常见细菌系统鉴定手册》比对。
1.2.4.2 16S rRNA基因序列分析
参考水煮法提取细菌DNA作为PCR扩增模板[15],细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)、1492R(5′-GGTTACCTTGTTACGACTT-3′)用于PCR扩增鉴定,引物序列由上海生工合成。扩增体系:Premix Taq 10 μL,上、下游引物各0.5 μL,基因组DNA 5 μL,ddH2O 4 μL。用1%琼脂糖凝胶电泳检测PCR产物,将PCR产物送至上海生工测序,测序结果与NCBI进行比较[16]。
1.2.5 芽孢杆菌生长曲线测定
活化细菌,按照1%的量接种于LB液体培养基,在180 r/min立式智能精密摇床上37 ℃培养,从刚接种开始每隔2 h取样1次,共10次,分别测定其OD600。
1.2.6 筛选出的芽孢杆菌的安全性评价
1.2.6.1 灌胃试验
经过7 d的适应后,24只雄性昆明小鼠被随机分成2组(n=12),其中对照组A灌胃无菌PBS(0.2 mL),试验组B灌胃1×108CFU/mL龙舌兰芽孢杆菌LTF7(悬浮于0.2 mL无菌PBS),持续14 d。在整个试验过程中每天观察动物的活动、行为和一般健康状况。每天记录1次体重。在试验结束时,所有小鼠禁食12 h,然后通过腹腔注射4%水合氯醛进行麻醉;
通过心脏穿刺将血样收集到含有乙二胺四乙酸(EDTA)的试管中,并制备血清;
取出心脏、肺脏、肾脏和睾丸并称重。
1.2.6.2 腹腔注射
经过7 d的适应后,24只雄性昆明小鼠被随机分成2组(n=12),其中对照组C腹腔注射0.2 mL生理盐水,试验组D腹腔注射1×108CFU/mL的龙舌兰芽孢杆菌LTF7(悬浮于0.2 mL无菌PBS),注射后第7天处死。在整个试验过程中每天观察动物的活动、行为和健康状况,每天记录1次体重,解剖观察各组织器官是否存在病理变化。
1.3 数据处理与分析
采用SPSS 20.0的单因素方差分析和GraphPad Prism 8.0对数据进行处理和作图,结果表示为平均值±标准差,P<0.05表示差异显著。
2.1 芽孢杆菌初分离
共挑取在LB固体培养基呈乳白色、微凸起、表面褶皱的单菌落7个(编号LTF1~7,LTF为骆驼粪拼音的首字母缩写,数字为挑菌顺序)。进一步划线纯化(图1-A),革兰氏染色后其中有2株呈革兰氏阳性的短杆状(图1-B),将短杆菌进一步纯化后于-20 ℃保存。

A:LB琼脂平板划线 LB agar plate streaking;
B:革兰氏染色 Gram stain (100×)。图1 分离菌株LTF7形态Fig.1 Morphology of isolated strain LTF7
2.2 分离菌株的益生菌潜力筛选
2.2.1 耐酸性
由表1可知,2个分离菌株在pH=2.5的强酸环境中培养3 h后,随着时间增长相对存活率逐渐降低,从1~3 h,LTF6菌株的相对存活率高于LTF7菌株。
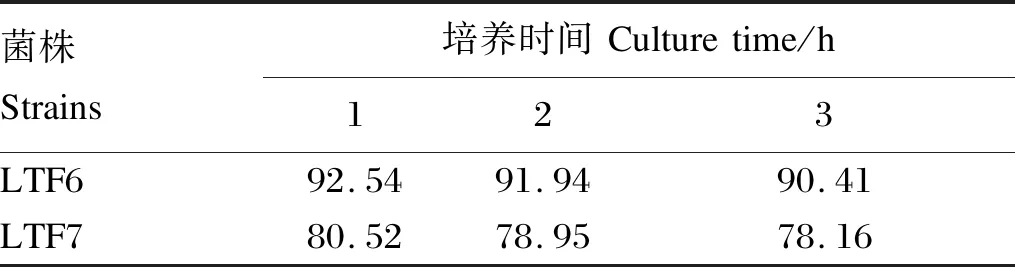
表1 在强酸环境下的相对存活率Table 1 Relative survival rate in strong acid environment %
2.2.2 耐胆盐
由表2可知,2株分离菌株在0.3%的胆盐中都能够存活,在培养的前1 h内均有较高的相对存活率,在6 h时LTF7菌株生长优势较为明显,表明LTF7菌株耐受胆盐的能力相对较强。
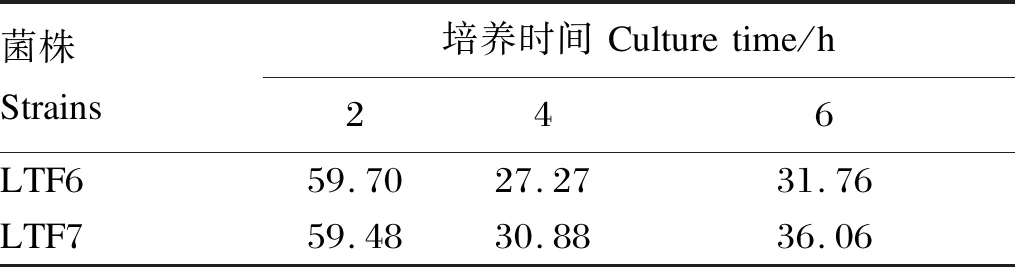
表2 在0.3%胆盐环境下的相对存活率Table 2 Relative survival rate under 0.3% bile salt environment %
2.2.3 药敏试验
选取13种常用药物对2个分离菌株做药敏试验,试验结果表明:LTF6菌株对头孢噻肟、卡那霉素、四环素、红霉素中度敏感,LTF7菌株仅对四环素中度敏感,对其他药物均敏感(表3)。分离菌株LTF7部分药敏试验结果见图2。

A:青霉素G penicillin G;
B:氨苄西林 ampicillin;
C:头孢噻肟 cefotaxime;
D:苯唑西林 oxacillin;
E:链霉素 streptomycin;
F:卡那霉素 kanamycin;
G:四环素 tetracycline。图2 分离菌株LTF7部分药敏试验Fig.2 Partial drug susceptibility test of isolated strain LTF7
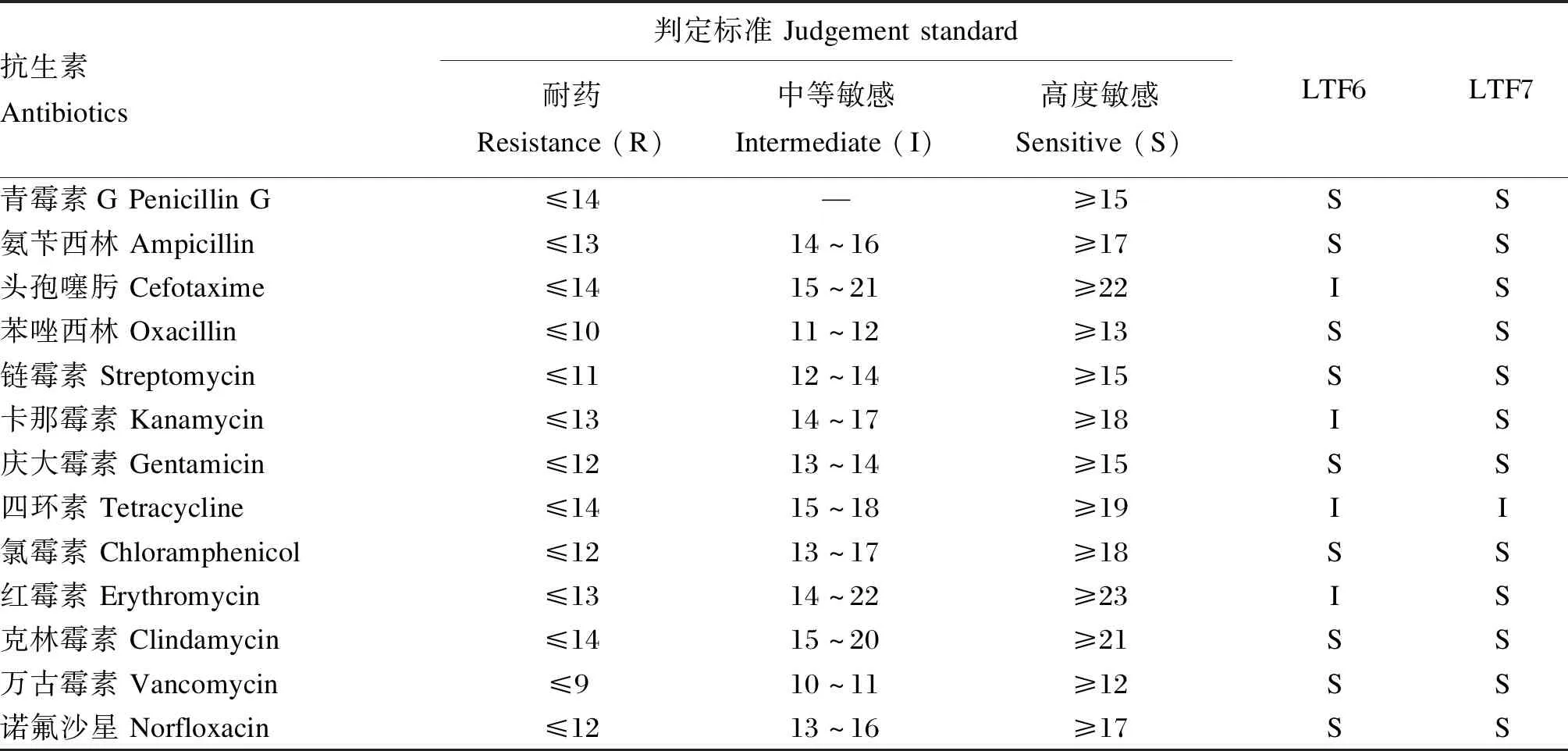
表3 分离菌株对药物的敏感性Table 3 Sensitivity of isolated strains to drugs
2.2.4 溶血活性测定
如图3所示,2株分离菌的菌落在血平板上菌生长良好,形态无变化,无溶血现象。

A:LTF6菌株 LTF6 strain;
B:LTF7菌株 LTF6 strain。图3 分离菌株在血平板上的菌落形态Fig.3 Colony morphology of isolated strains on blood plate
2.2.5 抗菌活性测定
由表4可知,2株分离菌对大肠杆菌、沙门氏菌和金黄色葡萄球菌具有独特的抗菌能力,以LTF7菌株对大肠杆菌、沙门氏菌和金黄色葡萄球菌的抗菌效果较好,选取LTF7菌株进行鉴定。

表4 分离菌株对病原菌的抑制圈直径Table 4 Inhibitory zone diameter of isolated strains against pathogenic bacteria mm
2.3 芽孢杆菌分离菌株的鉴定
2.3.1 生化鉴定
表5显示,LTF7菌株的生化鉴定结果为V-P试验阳性、不水解淀粉,可使明胶液化等。参照《常见细菌系统鉴定手册》,初步判断LTF7菌株为芽孢杆菌属。

表5 分离菌株LTF7生化鉴定结果Table 5 Biochemical identification results of isolated strain LTF7
2.3.2 16S rRNA基因序列分析
由图4可知,在约为1 500 bp的位置出现特异性条带,与预期相符。将得到的序列与NCBI比对,发现LTF7菌株与龙舌兰芽孢杆菌(NR104919.1)相似性为100%(图5)。结合LTF7菌株的形态特征及生理生化鉴定结果,判定LTF7菌株为龙舌兰芽孢杆菌,将其命名为龙舌兰芽孢杆菌LTF7。
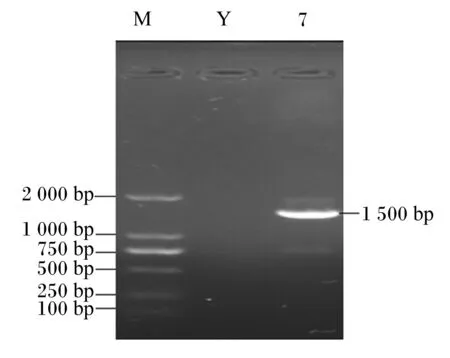
M:Maker;
Y:阴性对照 negative control;
7:LTF7菌株 LTF7 strain。图4 分离菌株LTF7 PCR扩增电泳结果Fig.4 PCR amplification and electrophoresis results of isolated strain LTF7
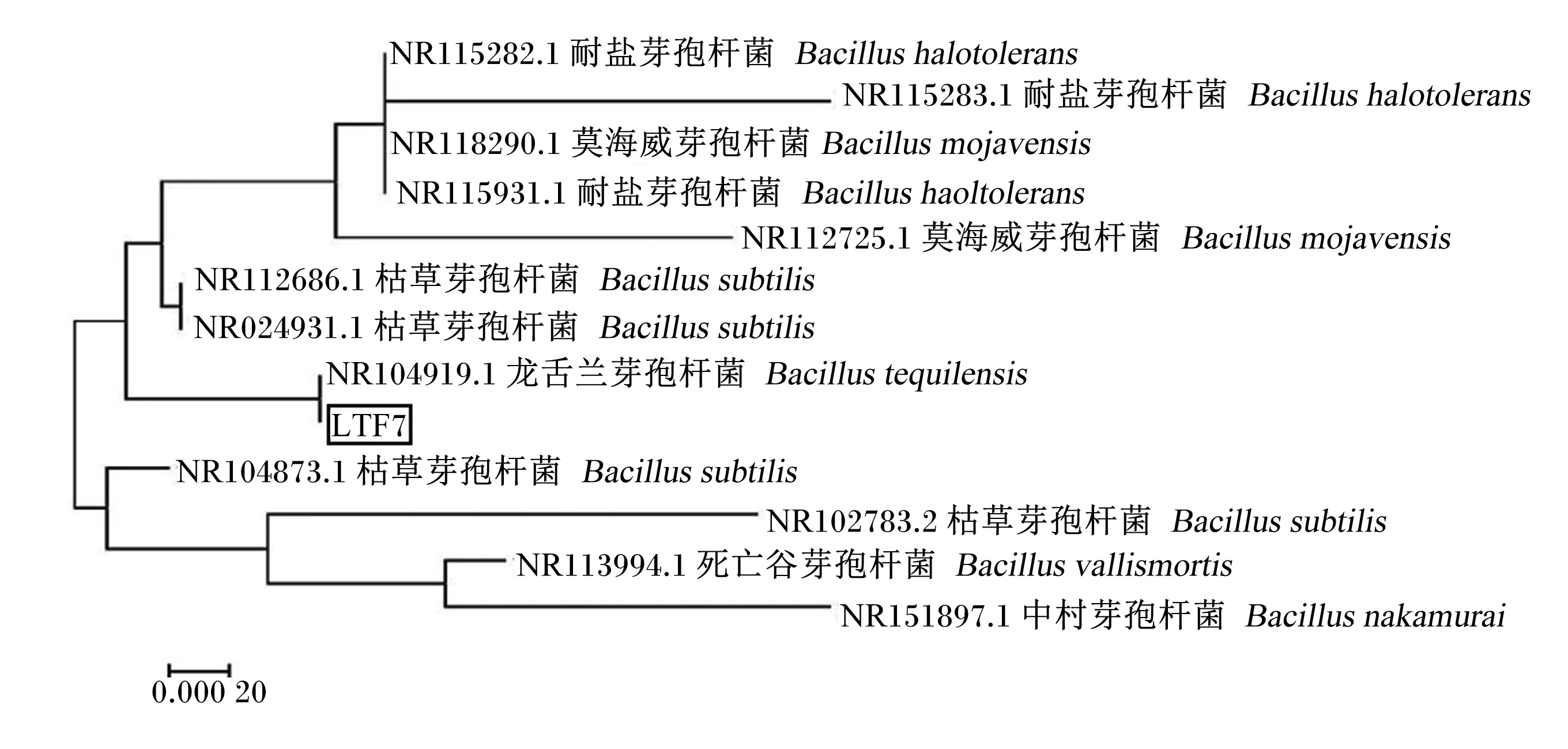
图5 分离菌株LTF7的系统进化树Fig.5 Phylogenetic tree of isolated strain LTF7
2.4 龙舌兰芽孢杆菌LTF7生长曲线测定
分离到的龙舌兰芽孢杆菌LTF7在LB肉汤中经37 ℃培养20 h后,其生长情况如图6所示。当培养到2 h时,菌株开始对数生长期。
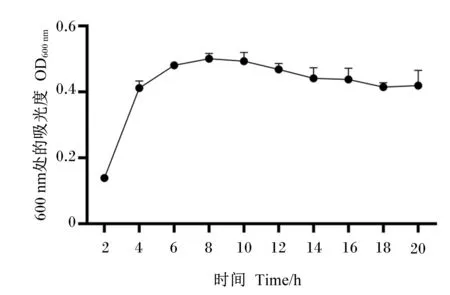
图6 分离菌株LTF7的生长曲线Fig.6 Growth curve of isolated strain LTF7
2.5 龙舌兰芽孢杆菌LTF7安全性评价
2.5.1 灌胃试验
2.5.1.1 小鼠剖检
试验过程中,各组小鼠均表现活跃,每日进食量和饮水量均正常;
此外,未发现腹泻、死亡或其他疾病症状。剖检显示各组小鼠各脏器及肠各节段外观正常,肉眼检查未见明显病理改变(图7)。
2.5.1.2 体重和脏器指数
如图8所示,灌胃龙舌兰芽孢杆菌LTF7的试验组B小鼠与对照组A小鼠的生长情况相同,各时间点组间体重均无显著差异(P>0.05)。

A、C:对照组A剖检 autopsy of control group A;
B、D:试验组B剖检 autopsy of test group B。图7 灌胃后小鼠剖解变化及肝脏和肠道观察Fig.7 Anatomical changes and observation of liver and intestinal tract in mice after gavage
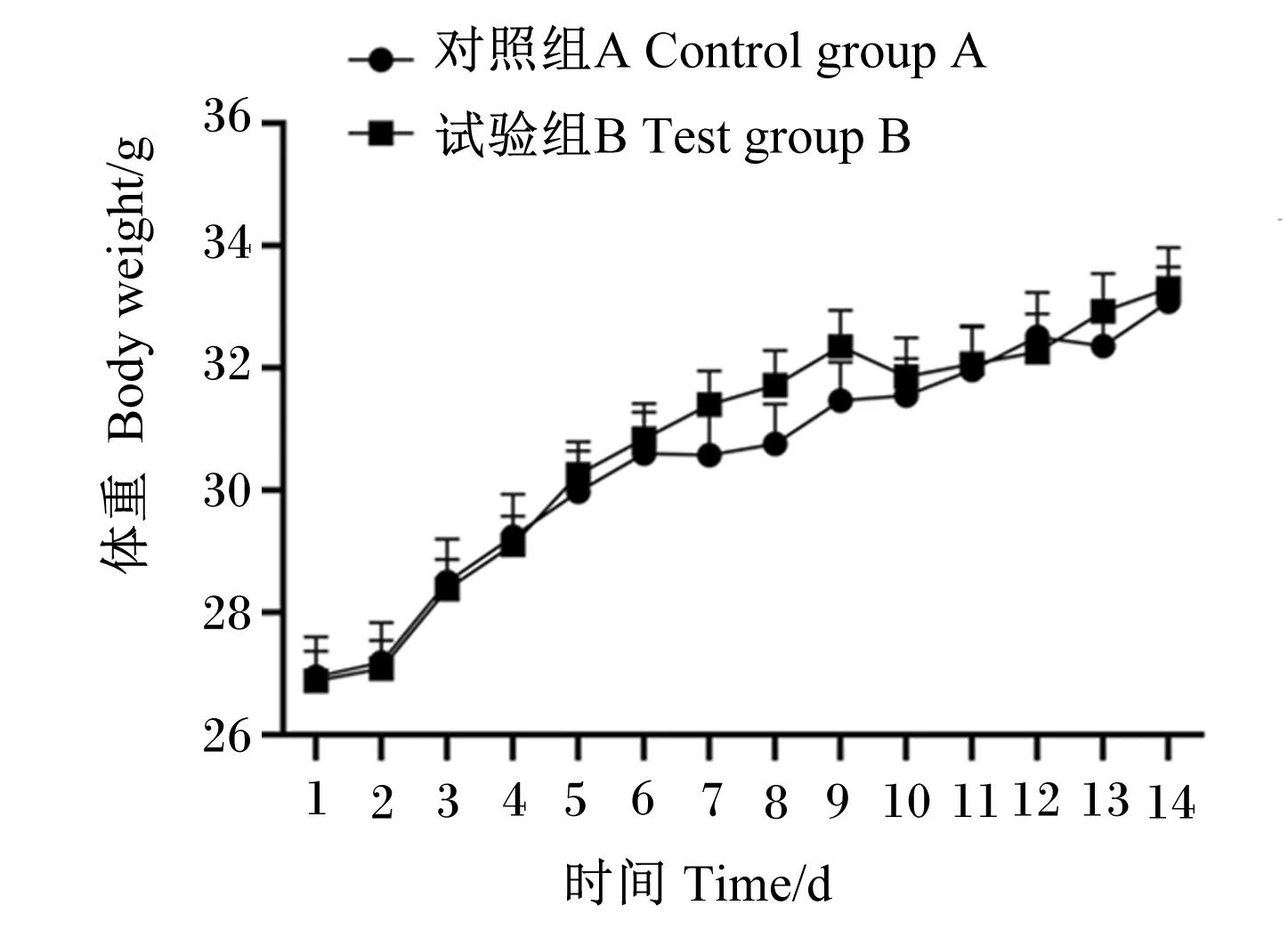
图8 灌胃龙舌兰芽孢杆菌LTF7对小鼠体重的影响Fig.8 Effects of gavage of Bacillus tequilensis LTF7 on body weight of mice
由表6可知,试验组B小鼠的心脏、肺脏、肾脏和睾丸指数与对照组A均无显著差异(P>0.05)。

表6 灌胃龙舌兰芽孢杆菌LTF7对小鼠脏器指数的影响Table 6 Effects of gavage of Bacillus tequilensis LTF7 on organ indexes of mice %
2.5.1.3 血液学参数
由表7可知,对照组A和试验组B小鼠血清中谷丙转氨酶活性、总蛋白和尿素氮含量均无显著差异(P>0.05);
所检测的血常规指标中,仅单核细胞数量在试验组B与对照组A间存在显著差异(P<0.05),但在参考范围之内,其他指标2组之间无显著差异(P>0.05)。

表7 灌胃龙舌兰芽孢杆菌LTF7对小鼠血液学参数的影响Table 7 Effects of gavage of Bacillus tequilensis LTF7 on hematological parameters of mice
2.5.1.4 组织切片观察
采用苏木精-伊红(HE)染色观察肝脏、肾脏组织,显微镜下2组小鼠均未见明显眼观病理变化(图9)。

A:对照组A肝脏 liver of control group A;
B:试验组B肝脏 liver of test group B;
C:对照组A肾脏 kidney of control group A;
D:试验组B肾脏 kidney of test group B。图9 灌胃龙舌兰芽孢杆菌LTF7对小鼠肝脏、肾脏组织的影响Fig.9 Effects of gavage Bacillus tequilensis LTF7 on liver and kidney tissue of mice (100×)
2.5.2 腹腔注射试验
腹腔注射后的连续7 d观察期间对照组C和试验组D小鼠的体重增长无明显异常(图10),未见异常症状和死亡,小鼠剖检腹腔内脏器无明显眼观病理变化(图11)。

图10 体重增长Fig.10 Weight gain
3.1 芽孢杆菌益生特性
益生菌在宿主肠道定植并发挥作用,候选菌株必须能耐受胃的酸性和小肠的胆汁盐,因此耐酸和耐胆盐通常被认为是潜在益生菌的一个必要的评估标准[17]。经pH 2.5的强酸处理3 h后,自骆驼粪便中分离的龙舌兰芽孢杆菌LTF7的相对存活率为78.16%,和不同种属的乳酸菌、芽孢杆菌菌株的耐酸能力[18-20]相似。研究发现,乳酸杆菌和芽孢杆菌菌株在0.3%胆汁中3 h后仍保持其活力[17,21]。肠道胆盐浓度平均约为0.3%,因此本试验用0.3%的胆盐测试龙舌兰芽孢杆菌LTF7的抵抗能力,结果显示其对0.3%的胆盐具有耐受性。

A:对照组C剖检 autopsy of control group C;
B:试验组D剖检autopsy of test group D。图11 腹腔注射小鼠剖检Fig.11 Necropsy of mice injected intraperitoneally
为防止潜在的抗生素耐药性转移到肠道微生态中,需对潜在益生菌进行抗生素耐药性评估[22]。本试验采用13种抗生素对龙舌兰芽孢杆菌LTF7进行药敏试验,发现其对四环素以外的大部分抗生素表现出高度敏感。抗生素耐药性认为是细菌本身存在的,Parveen等[10]研究发现龙舌兰芽孢杆菌5A2对青霉素、四环素、链霉素和甲氧苄氨嘧啶具有耐药性。本试验结果与上述研究结果有所差异,可能由于菌株差异性导致的,说明本试验所分离的龙舌兰芽孢杆菌菌株耐药性低,安全性高。
体外评估益生菌的溶血活性是评估潜在益生菌菌株安全性的必要条件之一[23]。Luis-Villaseor 等[24]研究发现,龙舌兰芽孢杆菌YC5-2不会发生溶血现象,从而证实该菌株不会对宿主造成危害,同样,本试验分离得到的龙舌兰芽孢杆菌LTF7也未出现溶血现象。
益生菌对病原菌的抑制作用有助于维持肠道菌群平衡和其他生理功能,例如减少炎症性肠病或结直肠癌[25]。芽孢杆菌对病原菌的抑制作用,主要是次级代谢途径抗菌蛋白和化合物的合成[26]。研究发现,龙舌兰芽孢杆菌FR9菌株对大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、李斯特菌和粪肠球菌等病原体表现出较广的抑制生长作用,其中对李斯特菌的抑制作用最强[10]。本试验中的2株分离菌LTF76和LTF7都能不同程度地抑制大肠杆菌、金黄色葡萄球菌和沙门氏菌生长,其中LTF7菌株对大肠杆菌和沙门氏菌的生长抑制效果较好。
生长曲线可以直观地看出益生菌在培养液中的生长能力[27]。Anvari等[28]研究了龙舌兰芽孢杆菌HK01的生长能力,接种后0~10 h龙舌兰芽孢杆菌HK01生长非常快,随后进入平稳期。Andriani等[29]研究巨大芽孢杆菌的生长情况时发现其在0~6 h内进入对数期,6 h已达到该菌的最高生长高度。在本试验中,龙舌兰芽孢杆菌LTF7的生长特性均与前人的研究基本一致,在37 ℃培养时能更快进入对数期,具有良好的生长特性。
3.2 龙舌兰芽孢杆菌LTF7的安全性
对于益生菌的安全性评价,目前还没有国际通用的标准,但是啮齿动物的急性经口毒性试验已被认为是一种基本的益生菌安全性评估测试,已应用于益生菌安全性的评估[30]。Dutta等[31]研究发现,龙舌兰芽孢杆菌KF623287可以提高鱼种的生长和免疫力以及其对养分的利用。目前,国内外对龙舌兰芽孢杆菌作为益生菌在安全性方面的研究甚少,但芽孢杆菌属其他成员在安全性方面的研究较为广泛。Li等[32]从牦牛肠道分离出枯草芽孢杆菌18,以小鼠为动物模型,经过17 d的饲喂后,解剖时没有肉眼可见的脏器病变,以此来说明分离菌株的安全性;
Kim等[33]从发酵食品中分离两种枯草芽孢杆菌和一种解淀粉芽孢杆菌后使用小鼠模型进行的体内致病性测试,证实其安全性。在连续14 d灌胃具有较强抗菌活性的龙舌兰芽孢杆菌LTF7的观察期内,解剖小鼠没有观察到明显的病理变化,小鼠的体重没有显著变化,脏器指数、血常规指标和血清生化指标没有显著变化,肝肾组织未发现明显病理变化。有研究表明,芽孢杆菌对睾丸有明显的增重效果,且没有生殖毒性,对雄性小鼠生殖功能有一定的促进作用[34]。本试验分离的龙舌兰芽孢杆菌LTF7同样提高了小鼠的睾丸指数。尹凤琴等[35]用从白牦牛粪便中分离出的枯草芽孢杆菌对小鼠腹腔注射,以此来确定获得的枯草芽孢杆菌是安全的。为了进一步评估从骆驼粪便中分离出的龙舌兰芽孢杆菌LTF7的安全性,本试验给小鼠腹腔内注射龙舌兰芽孢杆菌LTF7菌悬液,没有观察到小鼠行为变化或死亡,对小鼠采食、生长性能没有影响。综上所述,本试验分离的骆驼源龙舌兰芽孢杆菌具有较高的安全性。
本试验分离的骆驼源龙舌兰芽孢杆菌LTF7不仅在体外表现出对酸和胆盐良好的耐受性,对临床使用的大多数抗生素敏感,对沙门氏菌和大肠杆菌生长具有抑制作用,不具有溶血的能力,并且通过小鼠口服和腹腔注射试验证明了安全性,其可以作为新型饲料添加剂且具有减少细菌性疾病发生的潜力。
猜你喜欢龙舌兰胆盐芽孢LiaX 家族表面蛋白LPL9_0968 在副干酪乳杆菌L9 胆盐胁迫应激中的作用中国食品学报(2022年12期)2023-01-12胆盐在肝移植术后缺血性胆道病变中的作用及研究进展器官移植(2022年4期)2022-07-112020年墨龙舌兰酒出口创14年来最大增幅今日农业(2021年9期)2021-11-26提高乳酸菌耐胆盐能力的研究生物化工(2020年3期)2020-01-07解淀粉芽孢杆菌Lx-11农药科学与管理(2019年6期)2019-11-23解淀粉芽孢杆菌的作用及其产品开发农药科学与管理(2019年6期)2019-11-23侧孢短芽孢杆菌A60农药科学与管理(2019年8期)2019-11-23来一杯龙舌兰!海外文摘(2018年1期)2018-01-1830L发酵罐培养枯草芽孢杆菌产高密度芽孢的研究当代化工研究(2016年7期)2016-03-20高压脉冲电刺激下龙舌兰释放负离子的研究重庆工商大学学报(自然科学版)(2015年10期)2015-12-28