陈二华 朱慧芳 谭东明 张建华丁旭殷紫∗
(1.江苏护理职业学院药学与中药学院, 江苏 淮安223005;
2.江苏护理职业学院护理与助产学院, 江苏淮安223005)
神经炎症是众多神经退行性疾病的共同致病机制,中枢神经系统中原发与继发性的伤害会导致多重的无菌损伤,并诱发细胞的凋亡、炎症反应、神经功能障碍等[1]。小胶质细胞是中枢神经系统中先天免疫的第一道防线,在介导中枢神经炎症的激活与继发性损伤中起到关键作用,不仅可以释放炎症因子加重中枢神经的损伤,另一方面也可释放营养因子从而减少炎症对神经的损伤[2⁃3]。在中枢神经炎症介导的众多疾病中,抑制小胶质细胞的损伤,减少细胞凋亡等是减轻神经炎症的一大重要策略。
白藜芦醇作为目前临床应用前景较好的多酚类化合物,在抑制细胞炎症反应、减少细胞凋亡、影响细胞代谢、衰老、自噬等方面有重要作用[4⁃5],但确切机制尚不明确。因此,本实验建立了脂多糖刺激小鼠小胶质BV2 细胞系的炎症模型,深入探讨该成分发挥神经保护作用的机制,以期为后续临床应用提供理论基础。
1.1 细胞 小鼠小胶质细胞BV2 细胞系(批号CL⁃0493),购自武汉普诺赛生命科技有限公司,培养于含10%胎牛血清的DMEM 培养基中,在37 ℃、5% CO2条件下培养至融合度70%~80%时,传代进行保种,或进行后续实验。
1.2 试剂与药物 白藜芦醇(纯度≥99%,批号R5010⁃100MG)、脂多糖(批号L4516)、细胞荧光染色Hoechst(批号B2261,1∶3 000)均购自美国Sigma⁃Aldrich 公司;
DMSO(批号KGT5131)、DMEM(批号KGM12800⁃500)、RIPA 裂解液(批号KGP704)、BCA 蛋白定量试剂盒(批号KGP903)均购自江苏凯基生物技术股份有限公司;
胎牛血清FBS(美国Gibco 公司,批号10100147);
3⁃甲基腺嘌呤(3⁃MA)(美国Selleck 公司,批号S2767);
磷酸酶抑制剂(美国Thermo Fisher 公司,批号78426);
兔抗Bax(美国Proteintech 公司,批号50599⁃2⁃Ig);
兔抗Bcl⁃2(南京巴傲得生物科技有限公司,批号BS1511);
鼠抗GAPDH(美国Santa Cruz 公司,批号sc⁃32233);
兔抗LC3B(批号2775)、兔抗SQSTM1(批号5114s)、兔抗TLR4(批号14358s)、兔抗FOXO3(批号2497s)、兔抗P⁃FOXO3(批号9466s)均购自美国Cell Signaling Technology 公司;
二抗辣根过氧化物酶标记羊抗小鼠lgG(H+L)(批号bs⁃40296G⁃HRP)、辣根过氧化物酶标记羊抗兔lgG(H+L)(批号bs⁃40295G⁃HRP)均购自北京博奥森生物技术有限公司;
Lyso Tracker Red(批号1583088,1∶2 000)、mRNA提取Trizol(批号15596026)均购自美国Invitrogen 公司;
HiScript ⅡQ Select RT SuperMix for qPCR(批号R233⁃01)、ChamQ qPCR SYBR Green MasterMix(批号Q121⁃02)均购自南京诺唯赞生物科技股份有限公司。
1.3 仪器 细胞培养箱、冷冻离心机、双波长酶标仪、荧光定量PCR 仪(美国Thermo Fisher Scientific 公司);
电泳电转仪(美国Bio⁃Rad 公司);
LAS 显影仪(日本富士公司);
尼康共聚焦显微镜(日本Nikon 公司)。
2.1 给药与分组 细胞按“1.1”项下方法培养后,先加入白藜芦醇(结合前期研究与实验结果[6],设定能有效抑制炎症反应的浓度为30 μmol/L)预处理30 min,再给予100 ng/mL 脂多糖刺激6 h,3⁃甲基腺嘌呤在脂多糖刺激5 h时给予处理1 h,现配现用,终浓度为5 mmol/L。再随机分为对照组(不完全培养基培养,不做其他处理)、脂多糖组(100 ng/mL)、白藜芦醇组(30 μmol/L)、脂多糖+白藜芦醇组(100 ng/mL+30 μmol/L)、脂多糖+白藜芦醇+3⁃甲基腺嘌呤组(100 ng/mL+30 μmol/L+5 mmol/L)。
2.2 Western blot 法检测蛋白表达 用含有磷酸酶抑制剂的RIPA 裂解液裂解BV2 细胞,置于冰上裂解15 min 后刮取蛋白,16 000×g离心15 min,吸取上清后进行蛋白定量,加入5×Loading Buffer,在95 ℃下煮沸5 min,即得蛋白样本。电泳仪分离蛋白分子,电转移将蛋白分子转移至PVDF膜,5%脱脂奶封闭1 h,4 ℃过夜孵育一抗,隔天弃去一抗,TBST 洗膜3次,室温孵育二抗1 h,TBST 洗膜后显影曝光。
2.3 RT⁃qPCR 法检测炎症因子mRNA 表达 PBS 漂洗12孔板中的BV2 细胞,吸弃废液后加入TRIzol,置于冰上裂解5 min,将TRIzol 溶液转移至1.5 mL EP 管中,加入三氯甲烷,4 ℃、12 000×g离心15 min,将上层液体转移至全新无酶RNA EP 管中,加入异丙醇于-20 ℃下静置1 h,4 ℃、12 000×g离心15 min,弃上清,75%乙醇洗涤沉淀,挥干乙醇后加入DEPC 水溶解RNA。使用反转录试剂盒将RNA 逆转录成cDNA,程序为42 ℃2 min,50 ℃15 min,80 ℃5 s,所得cDNA 样品进行荧光定量PCR 检测。反应体系为cDNA 1 μL,正、反向引物各0.5 μL,双蒸水3 μL,ChamQ qPCR SYBR Green MasterMix 5 μL,引物序列见表1。
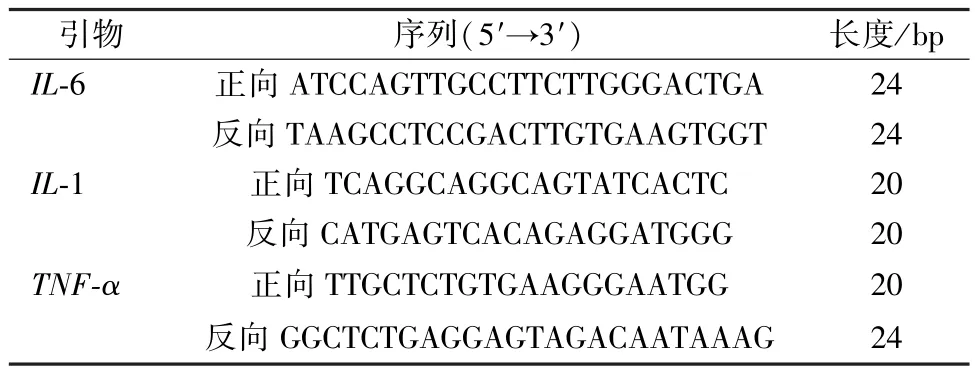
表1 引物序列
2.4 细胞溶酶体Lyso tracker Red 染色 将接种于24 孔板中细胞爬片上BV2 细胞用Lyso tracker Red(DMEM,1∶2 000)染色30 min 后(37 ℃、5% CO2),将混有染料的DMEM 溶液吸弃,用4% 多聚甲醛溶液固定细胞15 min,PBS 轻轻洗涤细胞爬片,Hoechst 染核10 min,PBS 轻轻洗涤细胞爬片后倒扣在载玻片上,用防荧光猝灭剂封片,在显微镜下拍摄。
2.5 统计学分析 通过GraphPad Prism 7.0 软件进行处理,数据均以()表示,组间比较采用单因素方差分析。P<0.05表示差异具有统计学意义。
3.1 白藜芦醇对BV2 细胞凋亡蛋白表达的影响 与脂多糖组比较,脂多糖+白藜芦醇组BV2 细胞Bax 蛋白表达降低(P<0.05),Bcl⁃2 蛋白表达升高(P<0.01),表明白藜芦醇能改善由脂多糖引起的BV2 细胞凋亡反应,见图1。

图1 白藜芦醇对BV2 细胞凋亡蛋白表达的影响(,n=3)
3.2 白藜芦醇对BV2 细胞状态的影响 对照组、白藜芦醇组BV2 细胞形态呈圆形,细胞有较少的分支突起;
脂多糖组BV2 细胞圆形结构遭到破坏,细胞有明显触角,为激活样状态;
脂多糖+白藜芦醇组能缓解BV2 细胞的激活,表现为炎症因子的释放而介导神经炎性作用,表明白藜芦醇可缓解脂多糖引起的BV2 细胞激活,见图2。

图2 各组BV2 细胞的状态
3.3 白藜芦醇对BV2 细胞炎症因子mRNA 表达的影响 与对照组比较,脂多糖组BV2 细胞中IL⁃6、IL⁃1、TNF⁃αmRNA 表达升高(P<0.01);
与脂多糖组比较,脂多糖+白藜芦醇组BV2 细胞中IL⁃6、IL⁃1、TNF⁃αmRNA 表达降低(P<0.01),见图3。

图3 白藜芦醇对BV2 细胞炎症因子mRNA 表达的影响(,n=6)
3.4 白藜芦醇对BV2 自噬阻滞的影响 细胞凋亡现象可能因其细胞自噬受阻而导致[7]。与对照组比较,脂多糖组BV2 细胞中SQSTM1 蛋白表达升高(P<0.01),LC3⁃Ⅱ/LC3⁃Ⅰ比值降低(P<0.05),提示脂多糖可引发细胞自噬的阻滞;
与脂多糖组比较,脂多糖+白藜芦醇组细胞中SQSTM1 蛋白表达降低(P<0.05),LC3⁃Ⅱ/LC3⁃Ⅰ比值升高(P<0.05),提示白藜芦醇能缓解脂多糖引起的自噬阻滞;
与脂多糖+白藜芦醇组比较,脂多糖+白藜芦醇+3⁃甲基腺嘌呤组BV2 细胞中SQSTM1 蛋白表达升高(P<0.05),LC3⁃Ⅱ/LC3⁃Ⅰ比值降低(P<0.05),表明自噬抑制剂3⁃甲基腺嘌呤可消除白藜芦醇的促自噬作用,见图4。

图4 白藜芦醇对BV2 自噬阻滞现象的影响(,n=3)
3.5 白藜芦醇对BV2 细胞自噬⁃溶酶体损伤阻滞的影响与对照组比较,脂多糖组能引起自噬⁃溶酶体通路中溶酶体细胞器的损伤,表现为细胞器荧光信号的减弱,而白藜芦醇组可有效降低脂多糖对BV2 的损伤;
与脂多糖组比较,脂多糖+白藜芦醇组则有效提高了溶酶体细胞器的荧光强度,降低损伤;
与脂多糖+白藜芦醇组比较,脂多糖+白藜芦醇+3⁃甲基腺嘌呤组可消除白藜芦醇的作用,增加溶酶体的损伤阻滞,见图5。

图5 各组BV2 细胞自噬⁃溶酶体损伤阻滞现象(×40)
3.6 白藜芦醇对BV2 细胞凋亡与炎症相关蛋白表达的影响 TLR4 受体介导的哺乳动物FOXO3 转录因子的磷酸化上调是LPS 引发自噬的重要机制[8]。与对照组比较,脂多糖组TLR4 蛋白表达、FOXO3 磷酸化水平升高(P<0.01);
与脂多糖组比较,脂多糖+白藜芦醇组TLR4 蛋白表达、FOXO3 磷酸化水平降低(P<0.05,P<0.01);
与脂多糖+白藜芦醇组比较,脂多糖+白藜芦醇+3⁃甲基腺嘌呤组TLR4蛋白表达、FOXO3 磷酸化水平升高(P<0.05,P<0.01),表明自噬抑制剂3⁃甲基腺嘌呤消除了白藜芦醇的作用,见图6。

图6 白藜芦醇对BV2 细胞凋亡与炎症相关蛋白表达的影响(,n=3)
神经退行性疾病的发病起始阶段,炎症反应起到保护和修复组织的作用,而持续的炎症反应则会引起小胶质细胞、星形胶质细胞、神经元细胞的凋亡损伤、自噬功能缺陷[9⁃11]。小胶质细胞的激活是神经炎症的主要特征,激活的小胶质细胞可介导各种神经毒性物质以及促炎因子的释放并导致神经元细胞的死亡。生理条件下,小胶质细胞主要负责免疫监视与宿主的防御感染,但在神经炎性条件下,小胶质细胞的异常激活会释放各种神经毒性物质如兴奋性谷氨酸、奎宁酸、组胺等从而导致脑组织的损伤。虽然短期的小胶质细胞活化是有神经保护效应,但长期的活化已被认为是神经退行性疾病的潜在机制。因此,基于小胶质细胞功能以获得安全有效的神经保护剂很重要。
白藜芦醇来源于虎杖、葡萄等,研究表明其能降低心血管系统疾病的发病率[12],并且在脂多糖诱导的神经炎症模型中,可通过过氧化物酶体增殖物激活受体⁃γ 共激活因子⁃1α 减轻炎症损伤促进小胶质细胞向M2 型转化[13]。白藜芦醇能影响细胞自噬的关键通路,例如调控雷帕霉素靶蛋白的磷酸化程度,从而影响细胞的糖酵解过程[14];
通过抑制丝裂原诱导的核糖体p70S6K 激酶磷酸化影响大鼠主动脉平滑肌细胞肥大[15]。在中枢神经系统中,白藜芦醇也可通过调控自噬过程来提高神经系统的稳定性,免受氧化应激的损伤[4,16]。本研究发现,白藜芦醇有效减轻了脂多糖引起的自噬阻滞,并减少了溶酶体细胞器的损伤,从而减少了BV2 细胞的凋亡与炎症因子IL⁃6、IL⁃1、TNF⁃αmRNA表达。
脂多糖是对小胶质细胞激活最为有效的刺激物之一,脂多糖刺激小胶质细胞后,通过膜上的TLR4 受体介导下游的免疫应答[17]。FOXO3 是FOXO 家族的重要成员,因其广泛参与调控泛素⁃蛋白酶体和自噬⁃溶酶体蛋白水解途径,是蛋白分解的关键调节剂[18]。自噬⁃溶酶体途径是维持细胞自身代谢以及蛋白质更新的重要过程,自噬过程的顺利进行有利于细胞受损成分的清除与细胞内物质的降解,以便在饥饿以及压力环境下提供能量。既往研究与本研究证实,白藜芦醇能有效减轻脂多糖引起的自噬⁃溶酶体通路障碍[19],通过进一步研究发现,白藜芦醇可通过TLR4⁃FOXO3 通路有效减轻自噬的阻滞现象。
综上所述,白藜芦醇可能通过TLR4⁃FOXO3 信号通路减弱脂多糖引发的自噬⁃溶酶体的通路障碍,并减少BV2 细胞的凋亡与炎症因子的释放。
猜你喜欢 腺嘌呤溶酶体白藜芦醇 6-苄基腺嘌呤对大豆内部水分分布及其生长状态的影响农业工程学报(2022年5期)2022-06-22两种剂型龟鹿二仙胶对于腺嘌呤诱导肾阳虚型少弱精子症大鼠的干预作用世界科学技术-中医药现代化(2021年5期)2021-11-05溶酶体功能及其离子通道研究进展生物化工(2021年2期)2021-01-19溶酶体及其离子通道研究进展生物化工(2020年1期)2020-02-17高中阶段有关溶酶体的深入分析读与写(2019年35期)2019-11-05氧化白藜芦醇对小鼠肝癌淋巴结转移的抑制作用中成药(2018年8期)2018-08-29浅谈溶酶体具有高度稳定性的原因现代职业教育·高职高专(2018年7期)2018-05-14液相色谱串联质谱法同时检测DNA中3_甲基腺嘌呤和3_乙基腺嘌呤分析化学(2014年8期)2014-09-02白藜芦醇通过上调SIRT1抑制阿霉素诱导的H9c2细胞损伤中国药理学通报(2014年2期)2014-05-09白藜芦醇调节STAT3与miR-21表达抗肝癌作用的初步研究中国药理学通报(2014年2期)2014-05-09