蒋 丽,郭瑞齐,管仁伟,路俊仙,王 萌,林慧彬,闫雪生,詹志来
(1.山东中医药大学,山东 济南 250355;
2.山东省中医药研究院,山东 济南 250014;
3.中国中医科学院中药资源中心,北京 100700)
凤仙透骨草为凤仙花科凤仙花属植物凤仙花(Impatiens balsamina L.)的干燥茎,主要分布于江苏、安徽、浙江、四川等地。凤仙透骨草具有祛风湿、活血、消肿、止痛等功效,主要用于治疗风湿性关节痛、屈伸不利等症状[1]。药理学研究表明,凤仙透骨草具有抗炎镇痛、抗菌、抗氧化等作用[2-3]。透骨草药材同名异物现象严重,品种极其混乱[4-5],有明显的区域用药性。经统计发现,凤仙透骨草及珍珠透骨草为透骨草药材的主流品种,用药区域较为广泛,其主要含有黄酮类、萘醌类、萜类等化学成分[6-10]。
中药指纹图谱是一种综合、可量化的数字化评价系统,可全面、系统地展现样品的成分及其特点,弥补了多组分定量分析的缺憾,为评价质量一致性及稳定性提供参考依据[11]。中药谱效关系是一种辨别模式,通过对药材化学成分特征和药效进行数据分析,科学地表达化学成分与药效之间的关系[12]。目前,凤仙透骨草质量控制主要体现在性状鉴别、显微鉴别、粉末鉴别、灰分、水分、浸出物等方面,尚未发现指标性成分用于质量评价,以及指纹图谱与活性研究相结合的报道。本实验采用高效液相色谱(HPLC)建立凤仙透骨草指纹图谱,根据临床用药特点,以抗炎作用为切入点,结合灰色关联度分析与偏最小二乘判别分析(PLS-DA)探索指纹图谱与抗炎活性的谱效关系[13],初步探究凤仙透骨草药材发挥抗炎活性的物质基础,为凤仙透骨草药材质量评价提供参考依据。
1.1 仪器
RHP-500A型高速多功能粉碎机(浙江永康市荣浩工贸有限公司);
XS205DU型电子天平(梅特勒-托利多国际有限公司);
Thermo Ultimate 3000高效液相色谱仪(赛默飞世尔有限公司VWD检测器,Chromeleon7色谱工作站);
DZKW-S-4水浴锅(北京市永光明医疗器械有限公司)。
1.2 动物
SPF级KM小鼠130只,雌雄各半,体质量18~20 g,由济南朋悦实验动物繁育有限公司提供,动物许可证号SCXK(鲁)20190003。本研究经山东省中医药研究院实验动物福利与伦理委员会批准(批准号SDZYY20190915002)。
1.3 试剂及药品
小鼠血清肿瘤坏死因子-α(TNF-α)酶联免疫吸附试验(ELISA)试剂盒(批号2020-12)、小鼠血清白细胞介素-1β(IL-1β)ELISA试剂盒(批号2020-12)均购自江苏酶免实业有限公司;
阿司匹林肠溶片(规格:100 mg,国药准字J20171021)购自拜尔医药保健有限公司;
角叉菜胶(批号C11738614)购自上海麦克林生化科技有限公司;
对照品金丝桃苷(批号111521-201507)、山柰酚(批号110861-202013)、槲皮素(批号100081-201610)均购自中国食品药品检定研究院;
阿魏酸(批号0773-9910)、芦丁(批号100080-200306)均购自中国药品生物制品检定所;
2-甲氧基-1,4-萘醌(批号2348-82-5)购自上海源叶生物科技有限公司。10批凤仙透骨草样品经林慧彬研究员鉴定均为凤仙花科植物凤仙花(Impatiens balsamina L.)干燥茎。见表1。

表1 10批凤仙透骨草药材来源
2.1 色谱条件
色谱柱:Welchrom C18(5 μm,250 mm×4.6 mm);
检测波长270 nm;
流动相:乙腈(A)-0.05%磷酸水溶液(B);
梯度洗脱:0~20 min,13%B;
20~30 min,13%~15%B;
30~40 min,15%~22%B;
40~50 min,22%B;
50~60 min,22%~30%B;
60~70 min,30%B;
70~80 min,30%~35%B;
80~100 min,35%~40%B;
柱温25℃;
流速1 mL/min,进样量10 μL。
2.2 对照品溶液制备
取阿魏酸、芦丁、2-甲氧基-1,4-萘醌、槲皮素、山柰酚对照品适量,精密称定,加甲醇制成质量浓度分别为15.100 μg/mL、50.200 μg/mL、30.100 μg/mL、22.240 μg/mL、26.500 μg/mL的混合对照品溶液。
2.3 供试品溶液制备
取凤仙透骨草粉末约1 g,精密称定,置具塞锥形瓶中,加入80%甲醇溶液40 mL,回流提取1.5 h,放冷后补足失重,摇匀过滤,滤液蒸干,定容于2 mL容量瓶,过0.45 μm微孔滤膜,即得。
2.4 指纹图谱建立
2.4.1 方法学考察
2.4.1.1 精密度考察 以凤仙透骨草S1为试验对象,按“2.3”项下方法制备供试品溶液,在“2.1”项下色谱条件连续进样6次,记录各共有峰峰面积及保留时间,以2-甲氧基-1,4-萘醌色谱峰为参照,计算各共有峰相对峰面积和相对保留时间,测得各共有峰相对保留时间的相对标准差(RSD)均小于1%,相对峰面积的RSD均小于3%,表明精密度良好。
2.4.1.2 稳定性考察 按“2.3”项下方法制备供试品溶液,分别在0 h、2 h、4 h、8 h、16 h、24 h按照“2.1”项下色谱条件进样,记录各共有峰峰面积及保留时间,以2-甲氧基-1,4-萘醌色谱峰为参照,测得各共有峰相对保留时间的RSD小于1%,相对峰面积的RSD小于3%,表明供试品溶液在24 h内稳定性良好。
2.4.1.3 重复性考察 精密称取凤仙透骨草粉末S1 6份,按“2.3”项下方法制备6份供试品溶液,在“2.1”项下色谱条件进样,记录各共有峰峰面积及保留时间,以2-甲氧基-1,4-萘醌色谱峰为参照,测得各共有峰相对保留时间的RSD小于1%。相对峰面积的RSD小于3%,表明该方法的重复性良好。
2.4.2 指纹图谱的建立 精密称取凤仙透骨草药材S1约1.0 g,按照“2.3”项下方法制备供试品溶液,在“2.1”项下色谱条件进样,记录HPLC色谱图,将10批凤仙透骨草药材的色谱图导入《中国色谱指纹图谱相似度评价系统》(2004版),以河北凤仙透骨草药材S1的指纹图谱为参照图谱,以中位数法生成对照图谱,时间窗宽度为0.4 min,经多点校正、自动匹配生成凤仙透骨草药材指纹图谱的共有模式。见图1、图2。
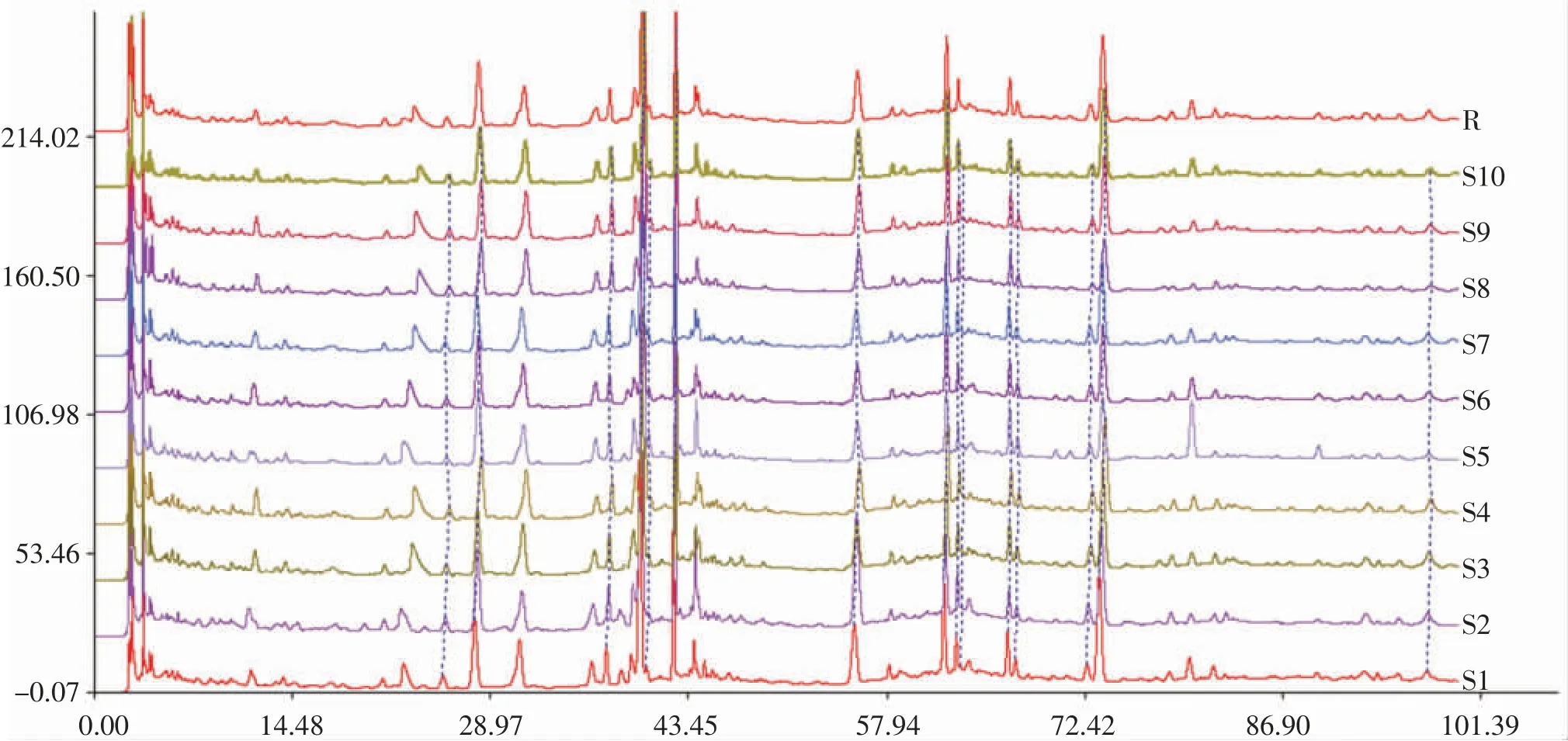
图1 凤仙透骨草药材(S1~S10)高效液相色谱法指纹图谱叠加图及对照图谱(R)

图2 凤仙透骨草药材混合对照品(A)及供试品共有模式(B)高效液相色谱法色谱图
根据凤仙透骨草药材指纹图谱共有模式可知,各批次凤仙透骨草HPLC指纹图谱共有15个共有峰,部分共有峰峰面积略有差异,表明不同批次凤仙透骨草药材在成分含量层面有所不同,见表2。通过各对照品保留时间与各批次药材对比共确认了5个色谱峰,分别为阿魏酸、芦丁(峰3)、2-甲氧基-1,4-萘醌(峰7)、槲皮素(峰8)、山柰酚(峰14)。

表2 10批不同来源凤仙透骨草药材共有峰峰面积
2.4.3 相似度评价 将各批次凤仙透骨草HPLC指纹图谱分别导入《中药色谱指纹图谱相似度评价系统》(2004版),对各批次凤仙透骨草指纹图谱全谱进行自动匹配、相似度计算。10批凤仙透骨草药材相似度均在0.90以上,表明不同批次凤仙透骨草药材质量基本稳定。见表3。
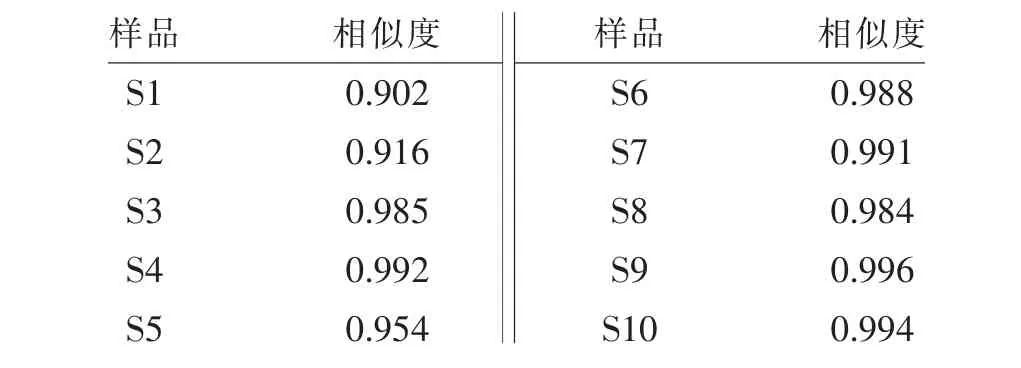
表3 10批不同来源凤仙透骨草药材相似度评价结果
2.4.4 聚类分析 将10批凤仙透骨草色谱图中各共有峰峰面积导入SPSS 17.0软件进行聚类分析,采用组间连接法、欧式距离为度量标准,当距离为25时,10批凤仙透骨草药材共分为4类,其中Ⅰ类包括样品S4、S6、S7、S8、S9、S10;
Ⅱ类包括样品S1、S3;
Ⅲ类包括样品S5,Ⅳ类包括样品S2。见图3。

图3 10批不同来源凤仙透骨草药材聚类分析结果
2.4.5 主成分分析 将10批凤仙透骨草药材标准化的共有峰峰面积导入SPSS 17.0软件进行主成分分析,结果见表4、表5、图4。将特征根值、方差贡献率作为保留主成分个数依据,以特征根值1为筛选标准,共得到3个主成分,累计贡献率为86.015%,碎石图也表明提取前3个成分后坡度趋于平缓,说明这3个主成分代表了凤仙透骨草色谱峰所包含的大部分信息,可用于评价凤仙透骨草的质量。

图4 10批不同来源凤仙透骨草药材主成分分析碎石图
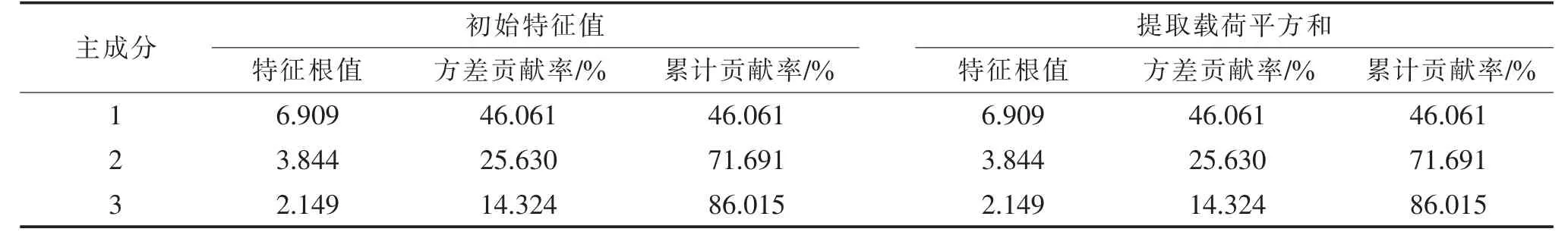
表4 10批不同来源凤仙透骨草药材主成分方差贡献率
由初始因子载荷矩阵表5可知,第一主成分信息主要来源于色谱峰1、3、6、7、8、9、13、14、15;
第二主 成 分 信息 主 要 来 源 于 色 谱 峰2、4、5、10、11、12、13;
第三主成分信息主要来源于色谱峰2、7,进而推测凤仙透骨草药材各批次间质量差异是因多种化学成分综合作用的结果。

表5 10批不同来源凤仙透骨草药材共有峰初始因子载荷矩阵
利用SIMCA14.1软件对10批凤仙透骨草指纹图谱共有峰进行主成分分析,见图5。结果显示10批药材分类状况与聚类分析结果基本一致。
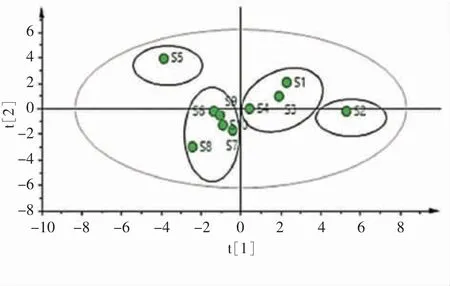
图5 10批不同来源凤仙透骨草药材主成分分析得分图
2.4.6 PLS-DA为研究不同批次药材间差异,利用SIMCA14.1软件对10批不同来源凤仙透骨草药材指纹图谱数据进行PLS-DA。在此模型中,变量重要性投影(VIP)值图可直观反映各色谱峰的贡献程度,通常以VIP值>1作为筛选指标的标准,VIP值>1表明此成分起关键性作用。峰2、峰4、峰6、峰7(2-甲氧基-1,4-萘醌)和峰14(山柰酚)为造成不同批次间差异的关键性色谱峰,在凤仙透骨草药材质量控制中发挥重要作用,见图6。

图6 10批不同来源凤仙透骨草药材色谱峰变量重要性投影值图
3.1 分组及给药
将130只SPF级KM小鼠随机分为空白组、模型组、阳性药组、凤仙透骨草醇提物组(S1~S10),每组各10只。空白组、模型组给予生理盐水;
阳性药组给予阿司匹林肠溶片;
S1~S10组给予凤仙透骨草醇提物,给药剂量见表6。每日灌胃给药1次,连续给药7 d。第7天给药30 min后,除空白组外,其余各组均在小鼠右足跖皮下注射1%角叉菜胶溶液50 μL。
造模4 h后摘眼球取血,以离心半径16 cm,12 000 r/min离心血液10 min,取上层血清,采用ELISA法,测定血清中TNF-α、IL-1β水平;
同一位置剪下左右足趾,精密称重,计算足肿胀度和抑制率[14]。见表6。
肿胀度=右脚质量-左脚质量
抑制率=(模型组足肿胀度-给药组足肿胀度)/模型组足肿胀度×100%
3.2 统计分析
小鼠足肿胀度、抑制率、血清中TNF-α及IL-1β水平等计量资料用x±s表示,导入SPSS 17.0统计软件,采用单因素方差分析。取α=0.05为检验水准。
3.3 研究结果
与空白组比较,模型组小鼠足肿胀度显著升高(P<0.01),小鼠血清中TNF-α、IL-1β水平明显增加(P<0.05)。与模型组比较,除S6、S8组,其余组小鼠足肿胀度均有明显的降低作用(P<0.05);
除S6、S7、S8组,其余组小鼠血清中TNF-α水平均明显增加(P<0.05);
除S8组,其余组小鼠血清中IL-1β水平均明显增加(P<0.05)。见表6。
表6 各组小鼠足肿胀度、抑制率及血清TNF-α、IL-1β水平比较±s)
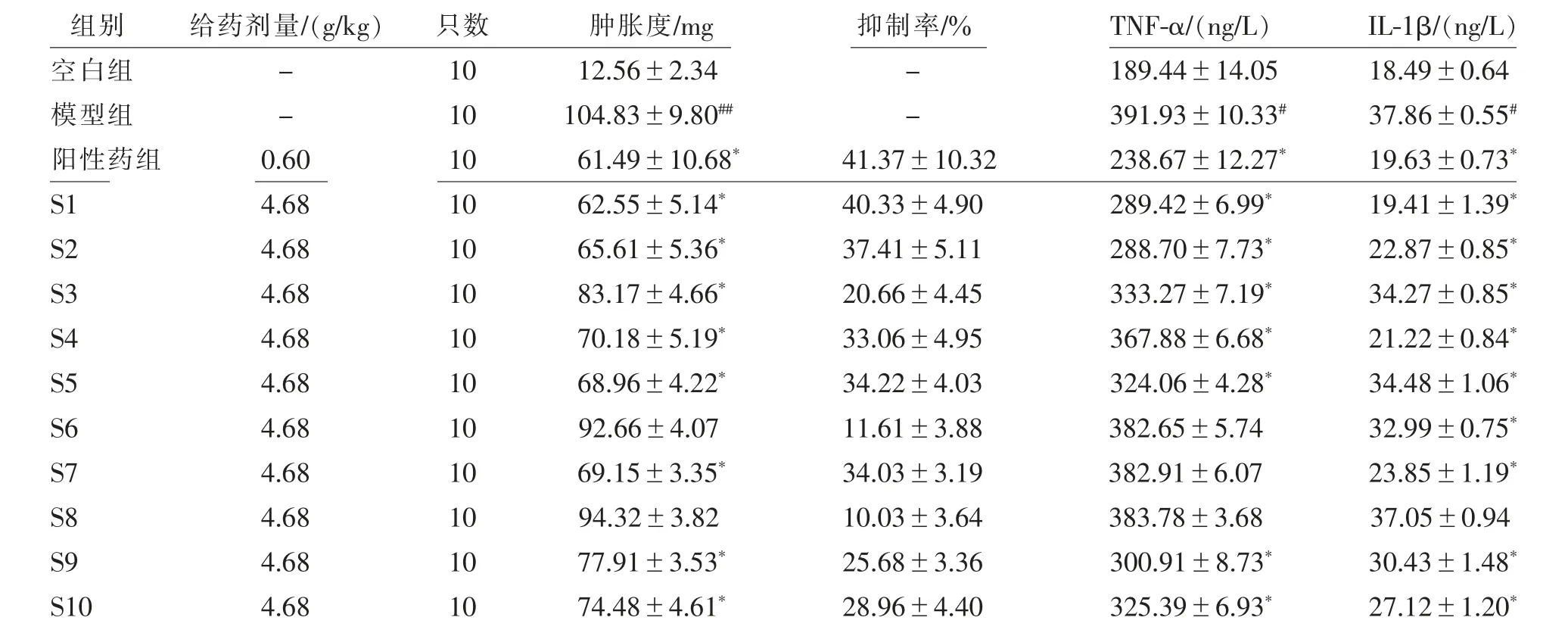
表6 各组小鼠足肿胀度、抑制率及血清TNF-α、IL-1β水平比较±s)
注:TNF-α为肿瘤坏死因子-α,IL-1β为白细胞介素-1β。与模型组比较,*P<0.05;
与空白组比较,#P<0.05,##P<0.01。
组别 给药剂量/(g/kg) 只数 肿胀度/mg 抑制率/% TNF-α/(ng/L) IL-1β/(ng/L)空白组 - 10 12.56±2.34 - 189.44±14.05 18.49±0.64模型组 - 10 104.83±9.80## - 391.93±10.33# 37.86±0.55#阳性药组 0.60 10 61.49±10.68* 41.37±10.32 238.67±12.27* 19.63±0.73*S1 4.68 10 62.55±5.14* 40.33±4.90 289.42±6.99* 19.41±1.39*S2 4.68 10 65.61±5.36* 37.41±5.11 288.70±7.73* 22.87±0.85*S3 4.68 10 83.17±4.66* 20.66±4.45 333.27±7.19* 34.27±0.85*S4 4.68 10 70.18±5.19* 33.06±4.95 367.88±6.68* 21.22±0.84*S5 4.68 10 68.96±4.22* 34.22±4.03 324.06±4.28* 34.48±1.06*S6 4.68 10 92.66±4.07 11.61±3.88 382.65±5.74 32.99±0.75*S7 4.68 10 69.15±3.35* 34.03±3.19 382.91±6.07 23.85±1.19*S8 4.68 10 94.32±3.82 10.03±3.64 383.78±3.68 37.05±0.94 S9 4.68 10 77.91±3.53* 25.68±3.36 300.91±8.73* 30.43±1.48*S10 4.68 10 74.48±4.61* 28.96±4.40 325.39±6.93* 27.12±1.20*
3.4 凤仙透骨草醇提物指纹图谱与抗炎活性关系
3.4.1 灰色关联度分析 以不同批次凤仙透骨草醇提物对小鼠药效指标抑制率为母序列,10批指纹图谱15个共有峰的峰面积为子序列,经过无量纲化、求差序列、两极最大值最小值、计算关联度等处理,分辨系数取0.5[15],所得关联度大小见表7。凤仙透骨草醇提物15个共有峰与药效指标的关联度均在0.7236以上,前6位共有峰与角叉菜胶致小鼠急性炎症具有较大关联。由此可知,凤仙透骨草醇提物发挥抗炎作用是多成分综合作用的结果。依据关联度大小,确定凤仙透骨草各特征成分对抗炎活性贡献的大小顺序为2>7>4>8>13>1>10>6>12>3>9>14>11>5>15。

表7 凤仙透骨草药材指纹图谱共有峰与各药效之间的关联度
3.4.2 PLS-DA VIP值表示自变量对因变量的解释程度,VIP值越大,自变量对因变量的解释能力越强[16]。利用SIMCA 14.1软件以凤仙透骨草指纹图谱15个共有峰面积为自变量,不同批次凤仙透骨草醇提物对小鼠药效指标为因变量,进行PLS-DA,回归系数及VIP值见图7、图8、图9、图10、图11、图12。由VIP值图可知峰14对小鼠足肿胀、血清IL-1β水平影响最大,峰7对血清TNF-α水平影响最大;
由回归系数图可知,15个共有峰均与足肿胀抑制率呈正相关,峰4、峰5、峰6、峰7、峰8、峰10、峰11、峰12、峰14与血清TNF-α水平呈负相关,峰1、峰2、峰3、峰4、峰6、峰7、峰8、峰9、峰13、峰14、峰15与血清IL-1β水平呈负相关。
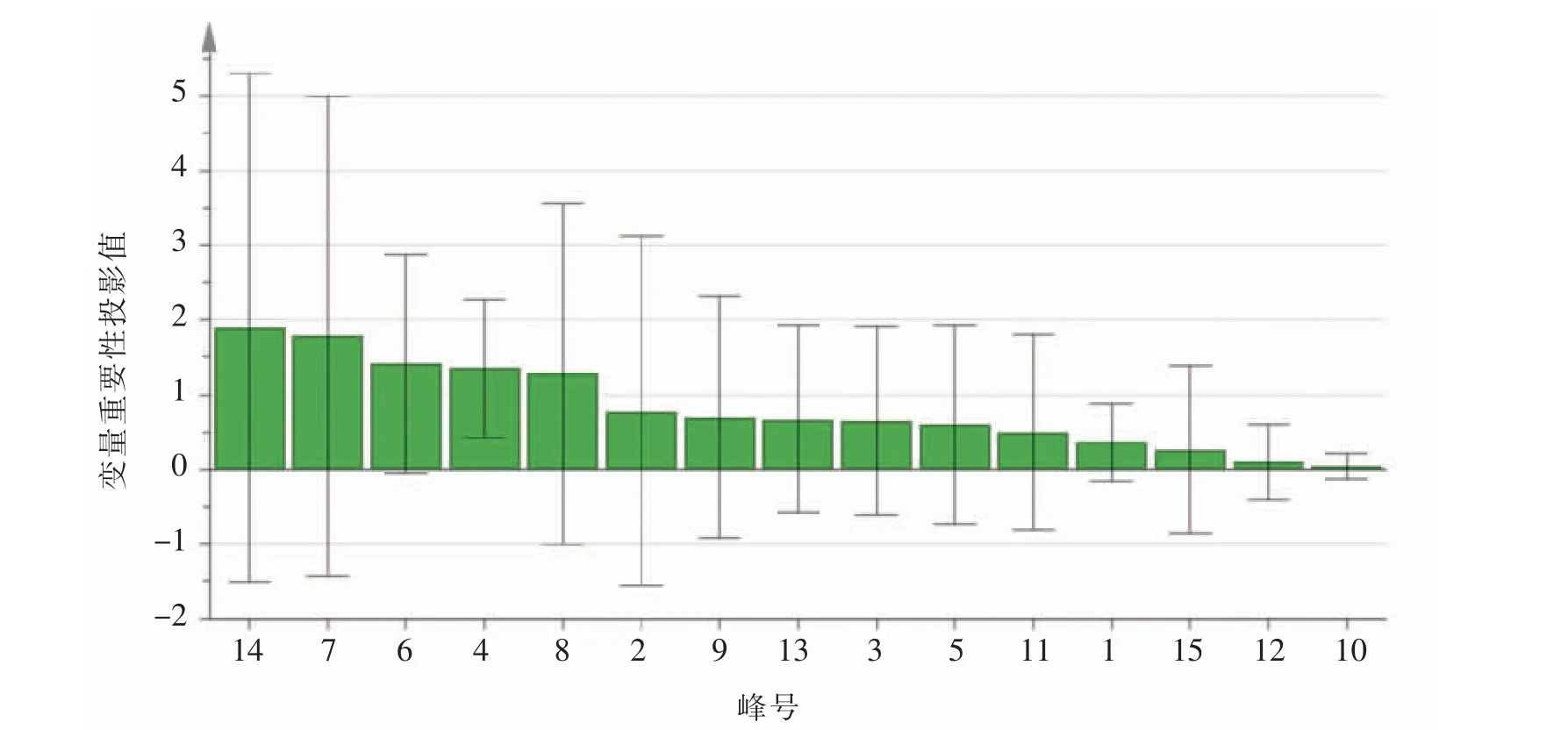
图7 凤仙透骨草药材共有峰与小鼠足肿胀抑制率变量重要性投影值图

图8 凤仙透骨草药材共有峰与小鼠血清肿瘤坏死因子-α水平变量重要性投影值图

图9 凤仙透骨草药材共有峰与小鼠血清白细胞介素-1β水平变量重要性投影值图

图10 凤仙透骨草药材共有峰与小鼠足肿胀抑制率的回归系数图

图11 凤仙透骨草药材共有峰与小鼠血清肿瘤坏死因子-α水平的回归系数图
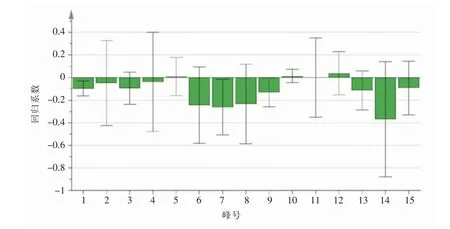
图12 凤仙透骨草药材共有峰与小鼠血清白细胞介素-1β水平的回归系数图
本研究通过对供试品溶液提取条件及色谱条件进行优化,进而建立了凤仙透骨草药材指纹图谱,相似度均在0.90以上,聚类分析及主成分分析得分图表明,药材质量存在产地交叉情况,因此药材质量评价不能局限于产地因素,应综合多方面因素评价药材质量。
从抗炎活性研究结果来看,不同产地凤仙透骨草醇提物对小鼠足肿胀抑制率、TNF-α、IL-1β浓度影响不同,但整体均表现为凤仙透骨草醇提物对足肿胀度、TNF-α及IL-1β含量均有不同程度的降低作用,推测可能因凤仙透骨草药材来源不同、内部化学成分差异造成抗炎活性的差异性。结合特征图谱来看,PLS-DA结果中峰4、峰6、峰7、峰8、峰14代表的物质可抑制小鼠足肿胀;
峰2、峰4、峰6、峰7、峰14代表的物质可降低小鼠血清中TNF-α水平;
峰6、峰7、峰8、峰14代表的物质可降低小鼠血清中IL-1β水平。综合PLS-DA及灰色关联度分析结果,峰2、峰4、峰6、峰7(2-甲氧基-1,4-萘醌)、峰8(槲皮素)、峰14(山柰酚)对发挥抗炎活性关联性较大,为凤仙透骨草药材质量控制提供参考依据,但峰2、峰4、峰6的结构鉴定、含量测定等方面还需进一步研究。
本研究成功建立了凤仙透骨草HPLC指纹图谱及其与抗炎活性的谱效关系,可以清晰地从指纹图谱中代表的化学成分与凤仙透骨草抗炎活性的相关性推测抗炎活性的物质基础。灰色关联度分析结果表明,15个共有峰与药效之间的关联度均在0.7236以上,说明凤仙透骨草发挥抗炎效果是成分群综合作用的结果,并非仅由个别成分决定,是多种成分的综合体现。本研究仅针对凤仙透骨草部分成分进行了抗炎活性的验证,其他成分药理活性尚有待进一步探究。
猜你喜欢 透骨草抗炎指纹 透骨草不同溶剂提取物对蚜虫的杀虫效果研究河北农业(2021年10期)2021-11-22像侦探一样提取指纹小哥白尼(趣味科学)(2021年11期)2021-02-28为什么每个人的指纹都不一样小天使·一年级语数英综合(2020年10期)2020-12-16秦艽不同配伍的抗炎镇痛作用分析中华养生保健(2020年7期)2020-11-16复方透骨草溶液质量标准的研究中成药(2018年5期)2018-06-06牛耳枫提取物的抗炎作用中成药(2017年9期)2017-12-19短柱八角化学成分及其抗炎活性的研究中成药(2017年10期)2017-11-16中药透骨草的化学成分及药理活性探究中国医药指南(2017年25期)2017-01-15基于自适应稀疏变换的指纹图像压缩自动化学报(2016年8期)2016-04-16熏硫与未熏硫白芷抗炎镇痛作用的对比研究中药与临床(2015年5期)2015-12-17