刘艺唐,丁孜涵,程文青,蔡哲旸,沈琳杰,郭卫,2
温州医科大学,浙江 温州 325035,1.眼视光学院(生物医学工程学院);
2.眼视光学和视觉科学国家重点实验室分子神经药理学实验室和眼-脑研究中心
外核苷酸焦磷酸酶/磷酸二酯酶-1 (ectonucleotide pyrophosphatase/phosphodiesterase-1, ENPP1)是最早发现的外核苷酸-焦磷酸酶/磷酸二酯酶家族成员,又称磷酸二酯酶1(phosphodiesterase 1)或CD203a。早期的研究发现,该酶在细胞外腺苷代谢过程中发挥重要作用。作为重要信号分子的腺苷,其细胞外的代谢受到严格的调控(见图1):除了经典的CD39-CD73腺苷代谢通路之外,尚存在CD38-ENPP1-CD73代谢途径,前者CD39可将胞外的ATP转化成AMP,而后AMP被CD73转化为腺苷,后者由CD38将胞外NAD+转化为ADPR,然后在ENPP1作用下转化为AMP,而后AMP被CD73转化为腺苷[1]。腺苷通过结合腺苷受体在睡眠、认知、运动、心血管、肿瘤、炎症等多种生理病理过程中发挥重要作用[2]。因此,腺苷代谢系统已成为重要的药物研发靶点[3],但针对ENPP1的药物研发进展较少。近些年的研究表明ENPP1是胞外环磷酸鸟苷-腺苷合成酶(cyclic guanosine monophosphateadenosine monophosphate, cGAMP)最主要的水解 酶[4],在肿瘤浸润等过程中发挥至关重要的作用。因此,其作为药物治疗靶点的价值值得重视。

图1 ENPP1参与胞外腺苷和cGAMP代谢的示意图
本文将在简要回顾ENPP1结构的基础上,重点介绍其在生物矿化、肿瘤、心脏损伤等生理病理过程中的作用,以及针对ENPP1靶点在酶替代疗法和小分子药物方面的研发进展。
在还原和非还原条件下,ENPP1分别为115 kDa和230 kDa蛋白[6]。2012年,KATO等[7]报道了ENPP1的晶体结构。ENPP1是一种多结构域蛋白(见图2),且为II型膜蛋白[8],主要包括两个N端生长素样结构域、一个磷酸二酯酶结构域和一个核酸酶样结构域。ENPP1通过不同的结构域参与不同的生物学过程:如催化和核酸酶样结构域参与矿化,生长素样结构域参与胰岛素信号转导。ENPP1有三个糖基化位点,它们增强了结构域间的相互作用[7]。新近的研究[9]发现单个组氨酸位点(H362)对于ENPP1底物选择性至关重要:该位点的突变可破坏2’-3’-cGAMP降解活性,但完好保持了该酶对其他底物的活性。值得注意的是,这个组氨酸位点活性在整个进化史中几乎是100%保守的。
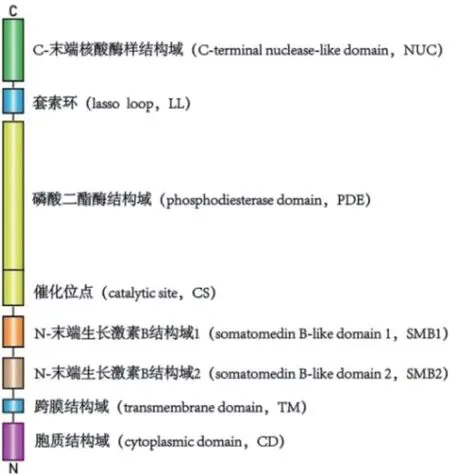
图2 ENPP1蛋白结构示意图
2.1 ENPP1与生物矿化 生物矿化是指由生物体通过生物大分子的调控生成无机矿物的过程,是骨骼、牙齿等发育过程中重要的环节。生物矿化由矿化底物无机磷(Pi)和矿化抑制物无机焦磷(PPi)的胞外浓度之间的平衡进行调节,该过程受到甲状旁腺激素、维生素D、维生素K、成纤维细胞生长因子23和磷酸酶等的调控[10]。ENPP1通过水解胞外核苷酸三磷酸盐(nucleotide triphosphates, NTPs)产生PPi负向调节骨矿化,而组织非特异性碱性磷酸酶通过水解NTPs和PPi产生Pi正向调节矿化。因此,ENPP1是哺乳动物中骨和软骨发育过程中至关重要的调控因子。目前发现多种遗传性矿化、钙处理或钙化相关疾病与ENPP1的功能突变有关,包括常染色体隐性低磷佝偻病2型[11]、脊柱后纵韧带骨化、婴儿期全身性动脉钙化[12-14]、钙化性冠状动脉病变[15]、CD73缺乏引起的动脉钙化和弹性假性黄瘤[16]等。值得注意的是,几乎所有ENPP1的疾病相关突变都存在于催化结构域或核酸酶样结构域内,影响ENPP1蛋白的稳定性,但不影响金属结合位点或糖基化位点[8]。
2.2 ENPP1与肿瘤 在人类癌症中,ENPP1的表达异常免疫细胞浸润减少、转移增加以及程序性细胞死亡蛋白1或程序性细胞死亡配体1单抗治疗的抵抗有关。通过分析多种不同组织来源的肿瘤(包括乳腺癌、肝癌、甲状腺癌、黏膜黑色素瘤等)的ENPP1 mRNA和蛋白的表达情况,发现在转移性肿瘤样本中ENPP1表达显著增加,在免疫细胞丰富的微环境中,癌细胞群显示较高的ENPP1表达。有研究发现,ENPP1可以两种不同的方式影响癌症,除腺苷代谢系统外,还可通过影响环磷酸鸟苷-腺苷合成酶(cyclic GMP-AMP synthase, cGAS)-STING(stimulator of interferon genes)[17]警报系统发挥作用。
在正常生理条件下,细胞外腺苷浓度会维持在较低的水平(<1 μmoL/L)。但在肿瘤微环境中,低pH、低氧环境会限制细胞的能量来源,导致胞外腺苷浓度高达100 μmoL/L,进而严重抑制免疫细胞的功能。此外,由于肿瘤细胞的高度更新特性,导致CD73和CD39表达上调并下调腺苷激酶,最终导致腺苷的生成增加而分解减少,使肿瘤中的腺苷水平远高于正常组织[18]。有研究发现,肿瘤来源的胞外cGAMP代谢路径会导致胞外腺苷的产生(见图1):在细胞外环境中,cGAMP被ENPP1水解后产生AMP和GMP,同时ATP被CD39去磷酸化产生AMP,两条途径来源的AMP可被CD73快速去磷酸化,形成腺苷[6,19]。
尽管ATP水解可能是原发肿瘤细胞胞外腺苷的主要来源,但ENPP1水解cGAMP作为腺苷来源的占比由于转移的进展而增加[20]。ENPP1缺陷小鼠表现出抵抗癌变或转移的能力,进一步提示在肿瘤发生发展过程中ENPP1介导腺苷产生的重要性[21]。
cGAS是一种胞质DNA感受器,感知病原DNA后激活cGAS-STING通路。该通路不仅介导天然免疫应答以抵抗多种含DNA的病原微生物感染,还能感知肿瘤来源的DNA而产生抗肿瘤免疫应答。随着癌细胞的分裂,DNA片段甚至整个染色体都可能会重复、突变或完全缺失,这就是所谓的染色体不稳定性。当癌细胞染色体的DNA进入细胞质,cGAS就会与其结合形成cGAMP。cGAMP作为警报信号可发挥双重作用:在细胞内,cGAMP激活名为STING的免疫反应;
大部分的cGAMP被转运到细胞外,作为邻近免疫细胞的警告信号,从而激活STING通路并启动免疫反应。新近的研究发现ENPP1会水解cGAMP,使肿瘤激活cGAS产生的促炎信号转化为免疫抑制[20]:通过对乳腺癌、肺癌和结直肠癌小鼠进行一系列实验,研究人员发现激活ENPP1可抑制免疫反应并增加癌症转移,而抑制ENPP1则会促进宿主的免疫反应并减少转移;
分析人类癌症样本发现,ENPP1的表达异常与癌症转移的增加及对免疫疗法耐受性的增加直接相关。
新近的研究[22]利用改进的小鼠乳腺癌模型确定ENPP1与局部区域复发密切相关:循环中的肿瘤细胞高表达ENPP1可通过自我接种机制促进肿瘤复发;
基因敲除小鼠和利用药理学阻断ENPP1可延长无复发生存期;
机制研究发现ENPP1产生的腺苷代谢物可增强结合珠蛋白(haptoglobin, HP)的表达,从而诱导髓样细胞浸润并促进网状结构形成;
在复发的人乳腺癌肿瘤中检测到ENPP1显著增加进一步提示两者之间的关系。总之,这些发现揭示了ENPP1/HP信号通路在肿瘤局部复发中的全新作用。
2.3 ENPP1与心脏缺血性损伤后修复 缺血性损伤后的心脏创伤愈合过程是多种细胞相互作用的精准的时空调控过程[23]。目前免疫细胞、内皮细胞和成纤维细胞相互作用的研究较多,但对于心脏成肌细胞在此过程中的作用尚不明确。近期的研究[24]发现,心脏损伤可诱导非成肌细胞(单细胞测序发现主要是成纤维细胞)上ENPP1异常高表达,ENPP1水解细胞外ATP形成AMP。在AMP作用下,心脏成肌细胞释放腺嘌呤和特定核糖核苷,这些分子可在乳清苷一磷酸步骤中断嘧啶生物合成,并诱导基因毒性应激和p53介导的循环型非成肌细胞的细胞死亡;
通过尿嘧啶或通过ENPP1/AMP途径的基因靶向治疗可拯救在心脏修复中发挥重要作用的非成肌细胞内的嘧啶生物合成途径,并增强心脏损伤后的修复;
研究者还筛选鉴定了小分子的ENPP1抑制剂,在心脏损伤后通过全身给药可挽救非成肌细胞中的嘧啶生物合成,并增强心脏修复和梗死后心脏功能。这些观察表明心肌细胞通过调节非成肌细胞的核苷酸代谢和嘧啶生物合成在心脏修复中发挥关键作用。
腺苷代谢系统已成为药物研发的热门靶点。早在2008年,美国食品药品监督管理局(FDA)批准腺苷A2A受体激动剂瑞加德松用于心肌再灌注成像。2019年,A2A受体拮抗剂伊曲茶碱获批用于帕金森病的治疗[25]。2015年底,FDA批准强生公司靶向CD38的抗体药物达拉木单抗上市,成为全球首个获批治疗多发性骨髓瘤的CD38单克隆抗体药物[26]。目前,针对CD73和CD39靶点的药物研发也取得了令人兴奋的进展[21],多款靶向A2A受体可用于肿瘤治疗的小分子化合物药物处于临床试验中[19,27]。然而,目前靶向ENPP1的药物进展缓慢。考虑到ENPP1的功能,针对异常ENPP1的酶替代疗法是先前研究的重点,但随着ENPP1在cGAS-STING通路中的调节作用被发现,其作为药物靶点的价值目前得到越来越多的重视。
3.1 ENPP1酶替代疗法 自二十世纪九十年代以来,酶替代疗法在治疗多种遗传罕见疾病的有效性和安全性已得到广泛证实,既挽救新生儿生命又改善患者生活质量[28-29]。酶替代疗法用于治疗ENPP1突变导致的功能缺失已成为重要的治疗策略。婴儿期全身性动脉钙化是一种威胁儿童早期生命的罕见疾病,主要由ENPP1基因的等位致病基因突变或ABCC6基因的突变引起。2015年ALBRIGHT等[30]开发了可溶性重组蛋白ENPP1-Fc,将ENPP1蛋白胞外域与免疫球蛋白IgG1的Fc蛋白域融合在一起,旨在恢复ENPP1或ABCC6缺失导致的生物矿化通路缺陷。近年来通过蛋白工程和糖基化修饰改造可将ENPP1-Fc的半衰期延长10倍以上[31],这促进了其未来的临床应用。在ENPP1缺乏的小鼠模型中,ENPP1-Fc可防止小鼠的死亡和血管钙化[30],并改善血压和心功能,可预防低磷血症性软骨病引起的内膜增生和骨骼并发症[32]。目前ENPP1-Fc用于治疗ENPP1缺乏症或ABCC6缺乏症已获得孤儿药资格,临床试验正在开展中。
3.2 ENPP1小分子抑制剂 激活STING可促进肿瘤免疫,但由于STING也有促进肿瘤的作用以及非选择性的系统性激活STING可能导致细胞因子风暴等安全性问题,目前STING激动剂的临床疗效不佳。正常情况下DNA分布在细胞核和线粒体中,仅在病原体入侵、肿瘤等病理情况才会进入胞质中。2’3’-cGAMP是胞质DNA经酶催化生成,正常细胞不含2’3’-cGAMP,此时,STING信号通路没有活性,也不能通过对ENPP1的抑制激活STING信号通路。ENPP1是目前发现的唯一能够水解2’3’-cGAMP的酶,而ENPP1抑制剂能够选择性地激活肿瘤细胞和肿瘤微环境中其他细胞的STING信号通路实现其高选择性,因此通过抑制ENPP1进而促进STING激活的策略受到重视。
目前,ENPP1的核苷酸类抑制剂大多是底物类似物,即腺嘌呤核苷酸类似物和衍生物。由于以核苷酸为基础的抑制剂具有与天然底物相似的结构[6], 因此它们的开发相对简单。但是目前的抑制剂也存在诸多问题:效力中等;
对ENPP1和其他胞外核苷酸酶的选择性还没有得到充分的研究;
自身的高酸度限制了口服生物利用度;
且它们的化学和代谢稳定性不高[33]。
目前针对ENPP1的非核苷酸抑制剂也在研发中,但多数还处于较早期的阶段。根据结构的不同,非核苷酸抑制剂大致可分为四类:多磺酸盐、多糖、多金属化合物、各种小杂环化合物。多磺酸盐类以活性蓝2和苏拉明为代表,它们在不同底物的作用下对ENPP1的抑制强弱有所不同[34-36],但两者的选择性都不高。肝素是最早报道的多糖类抑制剂[37],但其主要和凝血酶结合发挥作用,对ENPP1没有选择性[38]。多金属氧酸盐是以钨、钼或钒等重金属离子为中心原子,被氧原子包围的带负电荷的无机簇合物[39],其中多氧钨酸盐[TiW11CoO40]8-(PSBPOM141)被认为是迄今对ENPP1最有效的抑制剂[40],但由于PSB-POM141的负电荷和高相对分子质量,其口服应用受到限制[40]。多种杂环化合物也可作为ENPP1的抑制剂,其中噻唑苯并咪唑酮类化合物为代表,此类化合物对ENPP1表现出高选择性,但其水解性仍有待提高[41]。
ENPP1的结构特点决定了其功能的多样性,表现为:①该酶催化活性的多样性。原来关注较多的是在腺苷产生中的作用,近期发现其作为cGAMP水解酶的作用大大拓展了对于该酶功能的认知。②该酶发挥作用也可依靠非酶催化,例如在2型糖尿病中。ENPP1在胰岛素抵抗患者的骨骼肌、脂肪组织以及培养的皮肤成纤维细胞和培养的哺乳动物上皮细胞中过表达,进一步的研究发现,ENPP1直接与胰岛素受体的α亚基相互作用,通过降低受体的β亚基自磷酸化能力而抑制后续信号传导[42]。
虽然近些年来对于ENPP1结构和功能的理解取得了较多的进展,但是该领域仍然存在诸多问题有待深入研究:①除了本文提及的功能研究,现有的研究发现ENPP1基因突变与多种疾病(如孕前超 重[43]、自闭症谱系障碍[44])的发生相关联,但是具体的机制还有待深入研究。功能研究的进步得益于研究手段的发展,基因编辑等技术的飞速发展将有助于将点突变小鼠和条件性敲除小鼠用于ENPP1功能的研究。②目前对于ENPP1表达异常的调控研究和蛋白翻译后修饰水平的研究还较少,这些问题的理解将有助于深入认知该酶在病理生理过程中的作用。③考虑到酶替代疗法的局限性和肿瘤治疗的巨大需求,相信未来针对ENPP1的药物,将涌现出更多的开发策略。
猜你喜欢 核苷酸腺苷矿化 矿化剂对硅酸盐水泥煅烧的促进作用建材发展导向(2022年24期)2022-12-22单核苷酸多态性与中医证候相关性研究进展世界科学技术-中医药现代化(2022年3期)2022-08-22徐长风:核苷酸类似物的副作用肝博士(2022年3期)2022-06-30为什么越喝咖啡越困检察风云(2022年5期)2022-04-05大麦虫对聚苯乙烯塑料的生物降解和矿化作用环境卫生工程(2021年4期)2021-10-13基于复合胶凝材料的CO2矿化养护实验研究能源工程(2021年3期)2021-08-05腺苷受体对视网膜疾病的作用及相关中药研究进展中医眼耳鼻喉杂志(2021年2期)2021-07-21蛋白质腺苷化修饰研究进展科技创新与应用(2021年16期)2021-01-04铁矾渣中有价金属的微生物矿化-浮选回收可能性和前景矿产综合利用(2020年1期)2020-07-24Acknowledgment to reviewers—November 2018 to September 2019Journal of Sport and Health Science(2019年6期)2019-11-26