江戎琦,邓杰,孟恩清,吴昊
南京医科大学第一附属医院肿瘤科,江苏 南京 210029
近年来,肿瘤代谢已经成为肿瘤研究的热门领域。肿瘤细胞具有无限增殖的特点,依赖于它独特的代谢方式,即肿瘤代谢重编程[1]。这种代谢方式的改变可以满足肿瘤细胞快速增殖时旺盛的能量和物质需求,帮助细胞适应缺氧的肿瘤微环境,进而为肿瘤的增殖、侵袭、迁移等生物活动提供能量和物质支持[2]。
在人类基因组中,有3/4的DNA可以被转录,但只有2%能够编码蛋白质,其余绝大多数的转录物为非编码RNA(non-coding RNA,ncRNA)[3],主要包括3 大类:短链非编码RNA、长链非编码RNA(long non-coding RNA,lncRNA)和环状RNA(circular RNA,circRNA)。许多实验结果表明,ncRNA 能够参与各种生理和病理过程,发挥着重要的生物学功能,尤其是与肿瘤的产生和发展密切相关[4-6]。随着生物信息学和高通量测序技术的发展,许多研究者发现这些ncRNA同样具有编码蛋白的潜能,其编码的微肽/蛋白在生物体内同样发挥着关键的作用,如代谢、肌肉发育、胚胎发育、癌症的发生发展等[7-10]。
虽然ncRNA 编码的微肽/蛋白在一系列生物过程中功能已经得到证实,然而对于它们在肿瘤代谢中的作用仍然知之甚少。因此本文重点讨论了ncRNA 编码的微肽/蛋白在肿瘤代谢重编程和肿瘤发生发展中发挥的重要作用,并期望为未来的肿瘤治疗提供一个新方向。
1.1 lncRNA编码微肽
lncRNA 是一类长度超过200 个核苷酸大小的RNA 序列,由于缺乏编码性开放阅读框(open reading frame,ORF),在过去被纳为ncRNA[11]。随着生物信息学和高通量测序技术的发展,许多实验证明部分lncRNA 上存在一个或多个短开放阅读框(short open reading frame,sORF)[12],这些sORF 能够编码出小于100 个氨基酸(amino acid,aa)大小的具有生物活性的微肽[13]。
1.2 circRNA编码蛋白
circRNA 是一类共价闭合环状RNA,没有5′端帽子和3′端poly A 尾的结构。以前普遍认为,真核细胞中蛋白质的合成是通过5′帽依赖的的翻译途径,因此circRNA被纳入ncRNA的范畴。但是,近几年的研究发现,有些circRNA 可以通过内部核糖体进入位点(internal ribosome entry site,IRES)启动非5′帽依赖的翻译方式编码蛋白质,而缺乏IRES 的circRNA 也可以通过滚环扩增(rolling circle amplification,RCA)机制翻译蛋白质。还有部分circRNA存在大量的N6-腺苷酸甲基化(N6-methyladenosine,m6A)修饰,这些甲基化修饰可以像IRES 一样驱动circRNA翻译蛋白质[14]。
肿瘤的代谢与正常组织不同,为了快速适应缺氧、营养匮乏的微环境,其代谢模式会发生改变,进而获取更多的能源物质以及生物合成的原料,这就是所谓的“肿瘤代谢重编程”[15]。代谢重编程在不同组织来源的肿瘤以及肿瘤发生发展的不同阶段广泛存在,包括葡萄糖代谢、脂质代谢、谷氨酰胺代谢等[16-17]。已有多项研究证实ncRNA 编码微肽/蛋白参与了肿瘤代谢重编程的驱动和调控。
2.1 ncRNA编码微肽/蛋白调控葡萄糖代谢
无论是肿瘤细胞还是正常细胞,葡萄糖都是主要的能源物质。正常情况下,葡萄糖转化为丙酮酸后,有两条途径产生能量。一种是在有氧情况下,丙酮酸进入线粒体参与三羧酸循环(tricarboxylic acid cycle,TCA cycle),然后偶联氧化磷酸化(oxidative phosphorylation,OXPHOS)产生大量ATP,为细胞提供能量。另一种则是在无氧或缺氧条件下,丙酮酸不进入线粒体,而是在细胞质中被转化为乳酸并产生少量ATP,即糖酵解过程。
肿瘤细胞利用葡萄糖的方式与正常细胞截然不同,即使在氧气充足的情况下,大部分肿瘤细胞会优先选择糖酵解的方式产生能量,这一现象被称为有氧糖酵解或Warburg效应[18]。实际上糖酵解是一种低效的产能方式,但肿瘤细胞可以通过这种方式,竞争性消耗大量的葡萄糖,为其迅速增殖提供能量;
而肿瘤细胞通过糖酵解所生成的中间代谢产物,还可以参与磷酸戊糖途径[19](pentose phosphate pathway,PPP)以及丝氨酸代谢途径[20],为肿瘤细胞的复制提供生物大分子[21]。多项研究发现,肿瘤的发生发展与糖代谢途径关键酶的异常表达和调控密切相关[22]。
丙酮酸激酶(pyruvate kinase,PK)是糖酵解过程中的关键酶,可以将磷酸烯醇丙酮酸转化为丙酮酸,并产生ATP。PK 有4 种同工酶,分别为L 型、R型、M1 型、M2型,其中PKM1 和PKM2 是由PKM 基因的单个mRNA 转录产物通过交替剪接形成的,PKM2主要参与介导有氧糖酵解途径,而PKM1介导OXPHOS 代谢途径[23]。有学者发现,PKM2 在肿瘤细胞中出现明显上调[24],并且PKM2 能够诱导肿瘤细胞发生代谢重编程,即从正常的OXPHOS 代谢途径转变为有氧糖酵解途径并产生大量乳酸,塑造一个利于肿瘤生长的微环境[25]。
Huang等[26]的研究发现,lncRNA 编码的微肽可以通过调控PKM2 的表达,从而调控肿瘤代谢重编程,影响肿瘤的发生与发展。首先,Yan等[26]利用实时定量聚合酶链式反应(quantitative real-time PCR,qRT-PCR)、微阵列数据集发现,与正常组织相比,无论是原发还是转移性结肠癌组织中的lncRNA——HOXB-AS3均出现显著下调,Huang等[26]推测HOXB-AS3可能作为肿瘤抑制因子,在肿瘤发生发展中起着重要作用。之后又通过核糖体分析发现HOXB-AS3可以编码出一条53aa大小的微肽,并通过一系列体内外试验证实HOXB-AS3编码的微肽能够抑制结肠癌的进展,而非HOXB-AS3 本身。实验中发现,HOXB-AS3肽能够竞争性结合mRNA剪切抑制分子——核内不均一核糖核蛋白A1(heterogeneous Nuclear Ribonucleoprotein A1,hnRNP A1)上的RNA结合结构域RGG中的精氨酸残基,阻止了此精氨酸残基与PKM mRNA 外显子9 序列的结合,从而阻断了hnRNP A1 对PKM 剪切的调控作用,抑制了PKM2 剪切体的形成,促使PKM1 剪切体的形成,介导细胞OXPHOS 代谢途径,抑制结肠癌细胞的糖代谢重编程,从而抑制结肠癌的增殖和转移(图1)。
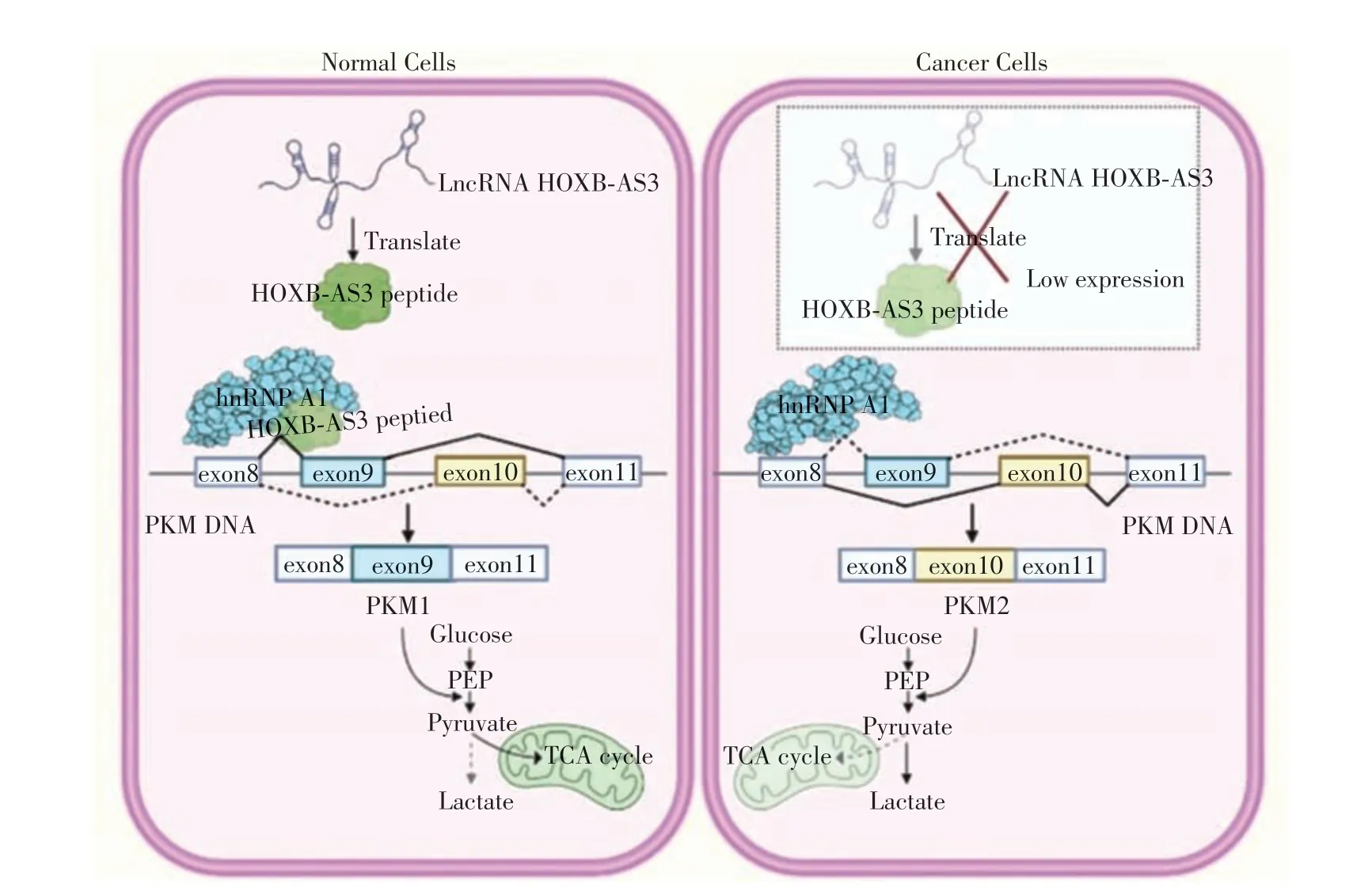
图1 HOXB-AS3肽竞争性结合hnRNPA1,拮抗hnRNPA1介导的PKM剪接调控Figure 1 HOXB-AS3 peptide competitively binds to hnRNPA1 and antagonizes the regulation of PKM splicing mediated by hnRNPA1
果糖-1,6-二磷酸酶(fructose -l,6-Bisphosphatase,FBP)是糖异生过程的关键酶,可将糖酵解途径的中间产物1,6-二磷酸果糖逆转为6-磷酸果糖,促使糖酵解向OXPHOS 的代谢转换,从而抑制潜在的Warburg 效应[27]。FBP 分为肝果糖-1,6-二磷酸酶(FBP1)和肌果糖-1,6-二磷酸酶(FBP2)2 个亚型。已有多项研究表明在肾透明细胞癌、胃癌、乳腺癌、肝癌、结肠癌等多种肿瘤中存在FBP1 表达及功能的下调,并且与患者的预后有明显相关性[28]。FBP1的缺失对于诱发肿瘤细胞的代谢重编程及肿瘤侵袭转移发挥着重要作用,比如在基底样乳腺癌细胞中,FBP1 的缺失可以诱导糖酵解过程,导致葡萄糖摄取增加,促进PKM2剪接体的形成,并且维持肿瘤在缺氧环境下ATP 的合成[29]。FBP1 除了参与糖酵解过程,同样也是Snail 基因的下游靶点,Snail 作为E-钙黏蛋白的关键转录抑制因子,能够介导肿瘤细胞上皮-间充质转化(epithelial-mesenchymal transition,EMT),增强肿瘤细胞的侵袭作用,同时Snail能够参与FBP1的启动子区甲基化,抑制FBP1的表达[30]。
目前已经发现有ncRNA 编码蛋白可以通过调控FBP1的表达,从而调控肿瘤代谢重编程,影响肿瘤的发生发展。例如,Pan等[31]利用Sanger 测序和RNase R 实验证实了结肠癌细胞中环状RNA-circFNDC3B的存在,同时利用qRT-PCR发现与正常人的结肠上皮细胞系相比,结肠癌细胞系中CircFNDC3B的表达显著降低,并且提示预后不良。之后Pan等[31]进一步通过序列分析,发现circFNDC3B上存在一个大于其一圈长度的ORF(长度为657nt),并通过液相质谱分析(liquid chromatography-mass spectrometry,LC-MS),发现其能编码一条218aa 大小的蛋白。之后又通过一系列体内外实验证实这个circFNDC3B编码蛋白对于结肠癌细胞的增殖和侵袭发挥着关键作用。这个218aa 的蛋白能够调控Snail/FBP1 信号轴,通过负调控Snail的表达,抑制肿瘤EMT过程,同时减低Snail对FBP1的抑制效应,增强FBP1的表达,促使了从糖酵解向OXPHOS 的代谢重编程,最终抑制结肠癌细胞的增殖和侵袭转移(图2)。
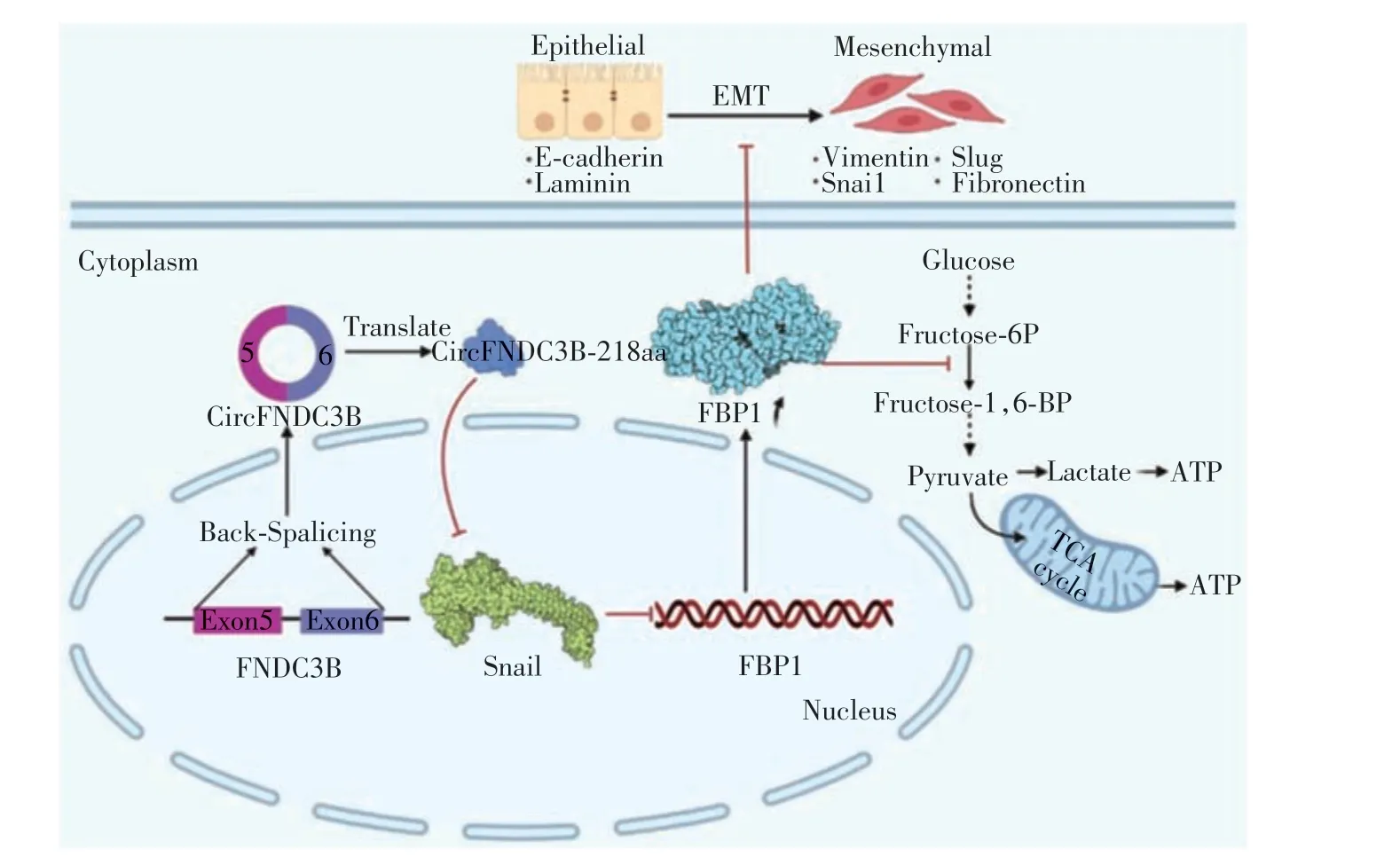
图2 circFNDC3B编码蛋白能够负调控Snail的表达,从而增强FBP1的表达Figure 2 A proteinencoded by circFNDC3B negatively regulates Snail expression and thus enhances FBP1 expression
2.2 ncRNA编码微肽/蛋白调控脂质代谢
除了异常的葡萄糖代谢外,肿瘤细胞也可以从脂质代谢中获得能量,包括脂肪酸(fatty acid,FA)的摄取、脂质的从头合成、脂肪酸β氧化(fatty acid βoxidation,FAO)等[32]。相关研究发现ncRNA编码微肽/蛋白可以与某些转录因子相互作用,调控与代谢相关基因的转录激活,从而调控肿瘤脂质代谢重编程。例如转录调控因子Zuotin相关因子1(Zuotin-related factor 1,ZRF1),已被发现在多种恶性肿瘤中高表达,并且与不良预后显著相关[33]。
过去发现转录因子CUT样同源框1(Cut like homeobox 1,CUX1)在神经母细胞瘤(neuroblastoma,NB)中明显上调,与NB的发生发展密切相关[34]。之后Yang等[35]通过Sanger 测序和CircRNADb 数据库发现CUX1 的9~11 号外显子可以剪接形成一个含ORF 的环状RNA-ecircCUX1,同时ecircCUX1 可以编码出1个113aa大小的核蛋白p113。Yang等[35]发现与正常组织相比,NB 组织和细胞系中均出现了ecircCUX1 和p113 的高表达,与NB 不良预后相关,并且其他恶性肿瘤中也检测出p113 高表达。之后作者进一步通过免疫共沉淀、质谱分析和RNA测序等方法发现p113能与ZRF1和辅助因子溴结构域蛋白4(bromodomain protein 4,BRD4)相互作用,形成p113/ZRF1/BRD4 转录调控复合物,诱导醛脱氢酶3家族成员A1(aldehyde dehydrogenase 3 family member A1,ALDH3A1)、NADH 泛醌氧化还原酶亚单位A1(NADH:ubiquinone oxidoreductase subunit A1,NDUFA1)和NADH 泛醌氧化还原酶复合体组装因子5(NADH:ubiquinone oxidoreductase complex assembly factor 5,NDUFAF5)的转录激活,促进FA 的生成、FAO 和增强线粒体复合物Ⅰ的活性,从而诱导NB 细胞的脂质代谢重编程和ATP 的生成,促进NB 的发生发展(图3)。并且Yang等[35]还利用Peptiderive server 设计了一个靶向阻断p113 和ZRF1 之间相互作用的抑制性细胞穿透肽(ZIP-12),通过体外实验证实ZIP-12 能够与p113 相结合,阻断p113与ZRF1的相互作用,并且能够抑制NB细胞的脂质代谢重编程,从而抑制NB的进展。因此,p113可能成为一种新的NB 预后生物标志物,同时p113/ZRF1/BRD4轴可能成为NB治疗的新靶点。

图3 ecircCUX1编码的p113,促进NB细胞脂质代谢重编程Figure 3 P113 encoded by ecircCUX1 promotes lipid metabolism reprogramming in NB cells
2.3 ncRNA 编码微肽/蛋白通过影响线粒体功能直接调控能量代谢
在真核细胞中,线粒体是将葡萄糖、脂质以及谷氨酰胺代谢等主要代谢过程整合的重要枢纽,线粒体OXPHOS 途径就是将各种物质氧化所产生的能量通过线粒体内膜上的复合体I-IV形成电子传递链(electron transfer chain,ETC)传递给ADP,最后通过ATP 合成酶(复合物V)将ADP 转化为ATP,维持细胞能量代谢的动态平衡。
过去认为肿瘤细胞主要依赖有氧糖酵解的代谢方式获取能量,同时会抑制正常的OXPHOS 途径。ATP 合成酶作为线粒体OXPHOS 途径的关键酶,其活性和表达在许多癌症中均出现了下调,同时许多实验证实促进线粒体OXPHOS 代谢途径,可以抑制肿瘤的进展[36]。
但是,线粒体的功能与肿瘤进展的关系并非我们想象的那么简单。有学者发现,一些癌症仍主要通过线粒体OXPHOS 途径来合成ATP,而非通过上调糖酵解途径[37]。例如,Chekulayev等[38]发现结直肠癌(colorectal cancer,CRC)可能不是一种完全依赖Warburg 效应的肿瘤,因为在CRC 细胞中表现出比正常结直肠细胞更高的OXPHOS 发生率。同时一项CRC的原位研究进一步发现,CRC细胞的总糖酵解能力与周围正常结直肠细胞相似,但CRC细胞的呼吸频率要高得多[39]。因此,线粒体功能失调与不同恶性肿瘤之间的关系仍需要进一步探索。
目前发现ncRNA 编码的微肽可以通过调控线粒体的功能直接调控肿瘤细胞的能量代谢,从而影响肿瘤发生发展。如Ge等[40]通过核糖体测序、lncRNA 衍生微肽数据库和ORF-Finder 分析,发现lncRNA-LINC00467 可以编码出一个94aa 大小的未知微肽,作者将其命名为ATP 合成酶相关肽(ATP synthase-associated peptide,ASAP)。同时发现LINC00467 和ASAP 在CRC 组织中的表达明显高于邻近正常组织,与CRC 不良预后相关。ASAP 的亚细胞定位于线粒体内,Ge等[40]通过一系列实验证实ASAP 能与ATP 合成酶的亚单位α(ATP5A)和γ(ATP5C)结合,增强它们之间的相互作用,提高ATP合成酶的活性,促进CRC 的OXPHOS 过程,从而促进CRC的发生发展(图4)。因此,靶向抑制ASAP可能成为治疗CRC的新方法。

图4 ASAP通过增强ATP合成酶的活性,促进肿瘤细胞的氧化磷酸化过程Figure 4 ASAP promotes oxidative phosphorylationof tumor cells by enhancing the activity of ATP synthase
ncRNA 编码的微肽/蛋白不仅能通过调控代谢相关酶的表达和转录因子来调控肿瘤代谢重编程,还能通过调控线粒体的功能影响肿瘤的能量代谢,从而影响肿瘤的发生发展。
这些ncRNA 编码微肽/蛋白的功能研究丰富了我们对癌症调控机制的认识,为我们靶向肿瘤细胞代谢重编程提供了许多新的治疗靶点。但目前仍存在许多问题,对于ncRNA编码性的研究仍处于初级阶段,目前发现的ncRNA 编码的微肽/蛋白仅占极小一部分,能够鉴定出具有生物学功能的更是少之又少。不过,相信随着质谱、RNA测序、核糖体图谱分析等技术的发展和进步,未来能够发现越来越多的与肿瘤相关ncRNA 编码的微肽/蛋白,这也意味着一个个新的肿瘤预后标志物和抗癌药物干预靶点的出现,为癌症的研究提供新的方向。
综上所述,深入了解代谢重编程中ncRNA编码的微肽/蛋白介导的调控机制,将有助于人们认识肿瘤发生发展的机制。同时,代谢相关的ncRNA编码的微肽/蛋白也能作为潜在的肿瘤诊断/预后标志物和治疗靶点,为肿瘤的治疗做出更大的贡献。
猜你喜欢 糖酵解线粒体编程 线粒体自噬在纤维化疾病中作用的研究进展中华实用诊断与治疗杂志(2022年1期)2022-08-31棘皮动物线粒体基因组研究进展海洋通报(2021年1期)2021-07-23编程,是一种态度少先队活动(2021年2期)2021-03-29线粒体自噬与帕金森病的研究进展生物学通报(2021年4期)2021-03-16元征X-431实测:奔驰发动机编程汽车维修与保养(2021年8期)2021-02-16编程小能手学生天地(2020年17期)2020-08-25纺织机上诞生的编程数学大王·低年级(2020年3期)2020-03-12糖酵解与动脉粥样硬化进展中国循证心血管医学杂志(2020年11期)2020-01-08白头翁皂苷PSA对SW480人结直肠癌细胞糖酵解途径关键蛋白及调节因子HIF-1α的影响中成药(2019年12期)2020-01-04放射对口腔鳞癌细胞DNA损伤和糖酵解的影响中华老年口腔医学杂志(2016年4期)2017-01-15