刘欢欢,张婷,王敏,于银萍,苏联麟,季德,陆兔林,李林
(1.南京中医药大学药学院,江苏 南京 210023;2.国家教育部中药炮制规范化及标准化工程研究中心,江苏 南京 210023)
当归为伞形科植物当归AngeliaSinensis(Oliv.) Diels的干燥根,味甘,性温,归心、肝、脾经,具有补血活血、祛瘀生新的功效,被医家誉为“妇科要药”。《中国药典》2020年版主要利用其中的阿魏酸和挥发油含量测定对其进行质量评价[1],而当归单一化学成分的含量高低并不能直接指征当归饮片补血活血的药效优劣,因此该方法不能完全反映当归质量[2-4]。
目前,中药及其饮片多以有限个成分的定性、定量分析来控制其质量优劣,部分品种甚至没有含量测定项,因此化学测定不能有效表征其药效水平,较难满足现代中医药的发展需求。如常用消食药鸡内金,《中国药典》2020年版对其质量评价仅限于性状、检查等常规的理化检测[1],与其关键生物活性相关性不高,难以准确反映其临床功效。黄伟等[5]建立了一种基于胃蛋白酶活性的鸡内金促消食效价测定法,能够直观反映鸡内金消食化积的临床功效,也为神曲、麦芽等消食类中药质量控制提供参考。因此,为更好保障中药饮片临床使用的安全有效,有必要在现有化学测定的基础上增加生物活性测定,以综合评价其质量。
诸多研究显示,当归具有补血功效,主治血虚之症,可以有效改善贫血,其作用机制主要是促进造血祖细胞增殖,提高血红蛋白水平[6-10]。本实验拟结合血红蛋白检测技术,从补血活性层面探索建立当归饮片生物效价方法,从而在化学测定的基础上补充药效检定,以期完善当归现行质量标准体系,并为其他补血类中药生物活性测定及其质量控制提供新思路[11-13]。
1.1 仪器
INC0108型二氧化碳培养箱(德国Memmert);Synergy H1型多功能酶标仪(美国Biotek);FA1104N型电子天平(上海菁海仪器有限公司);Eclipse 80i型倒置显微镜(上海衡浩仪器有限公司)。
1.2 试剂
人类髓性白血病K562细胞、RPMI 1640细胞培养基(南京贝佳生物科技有限公司);胎牛血清(上海李记生物科技有限公司);CCK-8试剂盒(上海碧云天生物技术有限公司);二甲基亚砜(DMSO,南京翼飞雪生物科技有限公司);氯化血红素(Hemin,上海源叶生物科技有限公司,5 g·瓶-1,纯度98%);过氧化氢(H2O2,国药集团化学试剂有限公司,批号:20160325,纯度30%);乙酸(上海申博化工有限公司,批号:1801101)。
1.3 药材与饮片
1~15号当归饮片购自甘肃、河北等不同地区,经南京中医药大学陈建伟教授鉴定,均为伞形科植物当归Angelicasinensis(Oliv.) Diels干燥根的加工品。分别取批号为1804002、18010261、20180101的3批生当归饮片,按照《中国药典》2020年版收载的炮制工艺加工制备得到酒当归饮片[14],按照《甘肃省中藏药材炮制规范》收载的炮制方法制备得到土炒当归饮片[15],编为16~21号。分别取批号为2018-03-09、2018-03-20、2018-03-08的3批当归药材,加工制备得到当归头、当归身、当归须饮片,编为22~30号(表1)。

表1 当归饮片样品采集情况表
2.1 供试品溶液的制备
取100 g当归饮片样品,加入8倍量水,浸泡30 min后煎煮3次,每次3 h,合并煎液并浓缩至相同体积,冻干后即为当归饮片提取物。干燥提取物用RPMI 1640培养基溶解,制成供试品溶液,置冰箱冷藏室(0~4 ℃)保存备用。
2.2 标准品溶液的制备
取65.2 mg Hemin,以10 mL的RPMI 1640培养基溶解,所得Hemin溶液质量浓度为1×104μmol·L-1,实验中稀释至相应工作浓度,作为本方法的标准品。
2.3 联苯胺染液的制备
分别配制0.5%、10%的乙酸溶液和1%的H2O2溶液,取联苯胺20 mg,用10 mL的0.5%乙酸溶液溶解,得到质量浓度为2 mg·mL-1的联苯胺溶液。
2.4 细胞培养
选用人类髓性白血病K562细胞系,使用含10%胎牛血清的RPMI 1640培养基进行培养,每2~3 d传代1次,取对数生长期细胞进行实验。
2.5 加药培养与检测
调整细胞浓度并接种于6孔细胞培养板,24 h后加药培养;取样品溶液,以0.5剂距配置多个剂量组,按照表2加入对应药物并充分混匀,共培养4 d。为维持细胞生长和分化所必要的营养,每2.5 d换液1次。反应完成后,按照1 000 r·min-1离心10 min收集细胞,每组加入60 μL联苯胺溶液和60 μL的H2O2溶液,避光反应30 min,加入600 μL的10%乙酸溶液,混匀后于570 nm处测定吸光值(ABS)。每组平行3孔,每孔重复测定2次,取其平均值。血红蛋白含量(相对值)按照公式(1)计算:
(1)
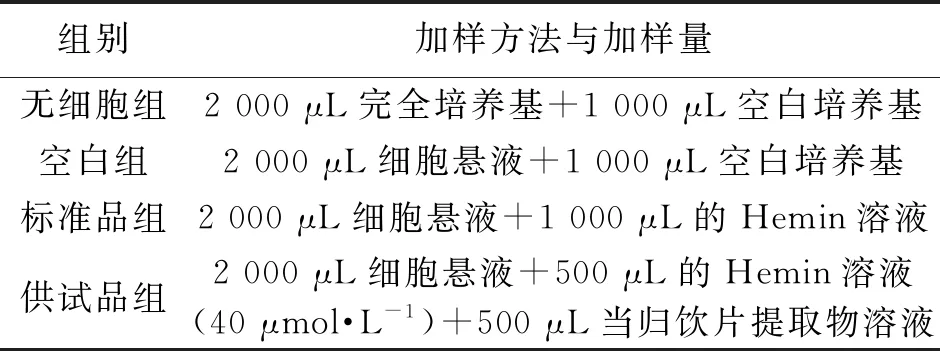
表2 加样方法与加样量
2.6 供试品浓度选择和效价测定
实验前期,对Hemin和当归饮片提取物进行大范围的浓度筛选,分析得到标准品和供试品不同浓度对血红蛋白含量(相对值)的影响,选择效应显著且量效相关的浓度范围,在此范围内探究并计算当归饮片补血效价。
本实验以Hemin为标准品,设定供试品当归饮片估示效价A为100 U·mg-1。按照生物检定量反应平行线测定法进行实验设计,标准品组设置高、中、低3个剂量组ds1、ds2、ds3分别为0.326、0.652、1.304 U·mL-1,实验组设置高、中、低3个剂量组dt1、dt2、dt3分别为0.024、0.048、0.096 U·mL-1(表3),操作步骤同2.5项下。分析方法参考《中国药典》2020年版附录1431生物检定统计法[16],按照公式(2)进行计算。
(2)
注:常数2.51是效价计算所需数值,根据《中国药典》2020年版所收载的1431生物检定统计法,本研究选用量反应平行线测定法,设置高低剂量比为1∶0.5,由此确定效价计算所需数值为2.51。

表3 检测结果表
3.1 当归补血活性检测和量效关系考察
标准品Hemin和当归样品的量效曲线图形状基本一致,低浓度时无明显促进血红蛋白生成作用,随着样品浓度增高,促进作用增强,但高浓度时由于药物产生毒性作用导致血红蛋白生成量减少。如图1所示,量效曲线图基本符合“S”曲线趋势,提示当归与Hemin的补血作用趋势在一定范围内基本相同。

图1 Hemin(A)和当归饮片(B)补血活性量效曲线图
3.2 线性关系考察
分别以标准品Hemin和当归样品对数剂量考察线性关系,结果如下:Hemin线性方程为:y=0.332 6lnx+0.511 0,R2=0.991 4,在5.18~40.00 μmol·L-1范围内显示良好的线性关系(图2A);当归样品饮片线性方程为:y=0.452 9lnx+1.744 5,R2=0.990 7,在0.39~3.00 μg·mL-1范围内显示良好的线性关系(图2B)。说明此反应类型在一定范围内适用生物检定中的量反应平行线测定法进行效价测定。
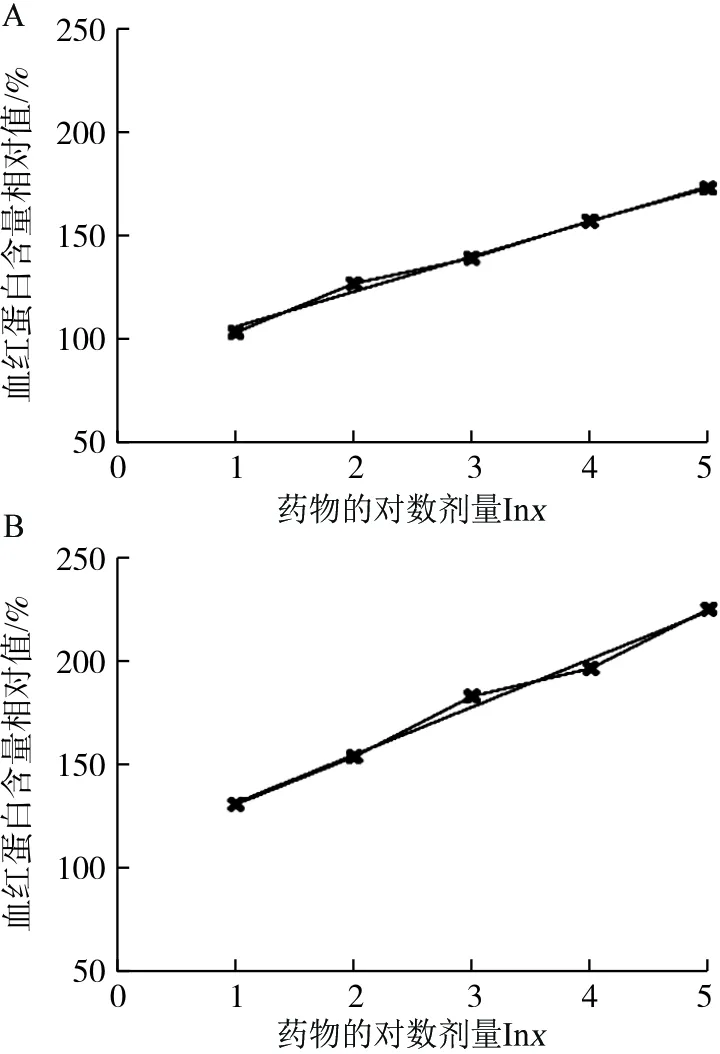
图2 Hemin(A)和当归饮片(B)补血活性线性考察
3.3 效价计算
3.3.1 可靠性检验 当归样品可靠性检验结果分析:试品间差异不显著(P>0.05),说明供试品和标准品效价无明显差别;回归项差异显著(P<0.01),说明随着样品质量浓度的降低,血红蛋白含量(相对值)有规律地降低;偏离平行线差异无显著意义(P>0.05),说明供试品和标准品呈平行直线关系(表4)。综上所述,所测结果有效。

表4 当归样品生物效价(3·3)法可靠性测验结果
3.3.2 效价与可信限 根据《中国药典》2020年版所载的量反应平行线测定法,结合表3与公式2所示进行计算,得到当归样品测得效价PT=1 358.37 U·mg-1,效价可信限率FL=6.37%,即表示该样品效价在1 285.625~1 458.766 U·mg-1范围内是可信的。
3.4 方法学考察
3.4.1 精密度 取相同质量浓度的当归样品的供试品溶液6份,检测得到血红蛋白含量(相对值)分别为110.57%、111.26%、109.48%、112.96%、112.47%、111.35%,RSD值为1.26%,表明仪器精密度良好。
3.4.2 重复性 取当归样品的干燥提取物5份,分别按照1.2项下的制备和检测方法计算补血效价,5次结果分别为1 427.754、1 292.922、1 392.497、1 463.447、1 358.423 U·mg-1,RSD值为4.73%,表明该方法具有较好的重复性。
3.5 样品检测结果与分析
1~15号当归饮片购自甘肃、河北等不同地区代表性企业,测得效价差别明显,表明该方法可以有效区分不同来源、不同批次的当归饮片(图3A)。13~15号生当归饮片炮制得到16~18号酒当归饮片以及19~21号土炒当归饮片;测得13~21号当归不同炮制饮片效价差别明显,表明该方法可以对相同来源、不同炮制方法所得饮片进行区分。中医药传统理论认为生当归质润,具有补血、调经、润肠通便的功能;酒当归辛温,有增强活血散瘀之功;土炒当归苦温,健脾和血,补血而不滑肠。本方法检测结果显示,不同炮制品的补血效应排序为:生当归>土炒当归>酒当归(图3B),这与酒当归主活血、土炒当归温和入药的传统理论是相符合的。22~30号当归饮片分别为当归头、当归身、当归须各3批,以上当归不同入药部位测得效价差别明显,表明该方法可以对相同来源、不同入药部位进行区分;此外,本方法检测结果显示,不同入药部位的补血效应排序为:当归身>当归头>当归须(图3C),这与“头止血,身和血,梢破血”的传统理论是相符合的。
中药的化学成分复杂、药理作用广泛,仅对少数成分进行质控不能完全反映其质量和临床疗效。在化学分析的基础上增加生物活性测定,全面评价饮片质量,是完善中药质量标准体系的有益补充,也是保证临床用药安全有效的重要方法。本文以当归为研究对象,探索性地对其补血药效相关的生物活性检定方法进行研究。
K562细胞源于一位慢性髓系白血病患者的腹水,是此类疾病中第一个实现人工培养的细胞[17]。K562胞内蛋白表达与红系祖细胞相近,可诱导其定向红系分化[18-20],相对于造血干细胞,该细胞不仅满足体外研究红系分化的需要,又具有易获得易培养的优势,是本文体外补血活性测定方法的最优选择。红系分化是指从造血干细胞到最终脱核释放成熟红细胞的过程,是当归补血功效研究的关键环节,但存在分化周期较长、晚期细胞识别困难等问题;而血红蛋白产生于红系分化过程,其含量升降可体现红细胞水平变化及其临床意义[21]。研究表明,当归补血的作用机制主要是促进造血干细胞增殖,提高血红蛋白水平[22-24];而Hemin作为生物补铁剂,可从外源大幅提高血红蛋白合成原料,从而诱导K562细胞向红系分化[25]。综上,本研究结合血红蛋白检测技术,以当归饮片为供试品,以Hemin为标准品,从补血活性层面探索建立当归饮片生物效价方法,以期量化当归饮片的补血水平。

图3 不同批次(A)、炮制方法(B)、入药部位(C) 当归饮片的补血效价
实验表明,本方法的开发过程及结果均符合《中国药典》2020年版所载的生物活性测定指导原则和生物检定统计法的各项要求,将此方法应用于不同来源、炮制方法、入药部位的当归饮片,可以得到稳定可靠的补血效价。其中,生、土、酒当归,当归身、头、尾的补血效价排序结果,也在一定程度上证明了传统中医用药的科学性。综上,本研究将与饮片功效高度相关的补血生物效价方法引入当归饮片质量评价中,从而改善了目前当归及其他大多饮片的质量控制方法依赖成分、忽视药效的现状。这为建立基于补血生物活性的当归饮片质量标准提供了试验依据,为进一步规范当归饮片的炮制工艺和临床应用提供了理论指导,同时也为完善其他补血类中药的生物检定和质量标准提供了参考。
猜你喜欢 效价饮片炮制 情绪效价的记忆增强效应:存储或提取优势?心理学探新(2022年1期)2022-06-07基于电子舌的白及及其近似饮片的快速辨识研究世界科学技术-中医药现代化(2021年5期)2021-11-05不同等级白芷饮片HPLC指纹图谱中成药(2019年12期)2020-01-04炮制专家王琦论现代中药炮制研究的“2个时期3个阶段”中成药(2018年12期)2018-12-293种姜汁炮制后厚朴对大鼠胃黏膜损伤的抑制作用中成药(2018年9期)2018-10-09清半夏炮制工艺的优化中成药(2018年9期)2018-10-09应用HyD在仔猪断奶早期可提高维生素D的效价猪业科学(2018年5期)2018-07-17如何提高抗生素效价管碟测定法的准确性中国当代医药(2015年8期)2015-03-01饮片与免煎颗粒剂治疗偏头痛效果比较中国中医药现代远程教育(2014年21期)2014-03-01生物效价法测定大黄炮制品活血化瘀功效中成药(2014年9期)2014-02-28