王 佳,姜克东,周士进,龚 芳
[1.荆州市第二人民医院急诊2 科,湖北荆州 434000;
2.湖北文理学院附属医院(襄阳市中心医院)心内科,湖北襄阳 441021]
脓毒症是一种全身性炎症反应,可导致许多器官(包括心脏器官)功能障碍,严重脓毒症的病死率高达20%~30%[1]。脓毒症诱发的心肌病是脓毒症和败血性休克过程中普遍存在的并发症之一。在细胞和分子水平上,炎症、凋亡被认为是脓毒症和脓毒症心肌病的关键病理生理现象[2]。因此,研究脓毒症心肌病的详细机制有助于探索新的治疗方案。来自革兰氏阴性细菌的脂多糖(lipopolysaccharide,LPS)介导促炎和促凋亡活性,被公认为脓毒症中最有特征的激活剂[3]。在这项研究中,LPS 被用来诱发脓毒症。越来越多的证据表明,长度超过200 nt 的长链非编码RNA(long noncoding RNA,lncRNA)参与了脓毒症[4],探索lncRNA 在脓毒症的病理生理过程中的机制可能有助于寻找有效的治疗靶标。LINC00707 在几种疾病中异常上调,并与炎症反应和细胞凋亡相关[5-6]。然而,LINC00707 在脓毒症中的功能仍不清楚。微小RNA(microRNA,miR)是长度为21-25 nt 的高度保守的非编码RNA 分子。大量研究表明,脓毒症中各种miR 的表达发生改变[7]。资料显示,miR-338-3p 可抑制多种人类肿瘤的发生和发展,例如结直肠癌[8]、肺癌[9]。MiR-338-3p 也被证明在急性肾损伤下调[10]。在急性脑梗死患者中,血浆miR-338-3p 浓度下调,且miR-338-3p 与C 反应蛋白浓度负相关,其中C 反应蛋白是动脉粥样硬化的关键炎症因子[11]。但miR-338-3p 在脓毒症发展过程中的功能需要进一步探索。这项研究旨在检查LINC00707 对LPS 诱发的心肌细胞损伤的影响及其所涉及的潜在机制,以期在分子水平上为脓毒症心肌病患者的治疗提供希望。
1.1 材 料
本研究中包括的所有程序均已获得荆州市第二人民医院的机构审查委员会的批准。从参与者处获得了书面知情同意书。于2018 年1 月至2019 年6 月,招募荆州市第二人民医院确诊收治的57 例脓毒症患者作为研究对象。排除以下情况的患者:(1)最近3个月内接受免疫抑制药物治疗;
(2)怀孕或哺乳;
(3)严重的慢性疾病,如心脏、肝脏、肾脏和肺部;
(4)患有实体肿瘤或血液系统恶性肿瘤;
(5)人免疫缺陷病毒感染。患者临床基线资料基本一致。从健康检查中心招募57 名与脓毒症患者年龄和性别相似,没有全身性炎症、无脓毒症或其他严重感染病史、没有肿瘤病史或心脏和肾脏功能障碍的健康志愿者,作为健康对照。从脓毒症患者和健康对照中采集外周血样本2 mL,3 000 r·min-1离心10 min分离血清样品,保存在-80℃用于RNA提取。
大鼠心肌细胞H9C2(美国典型培养物保藏中心),肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附测定法(enzyme-linked im⁃munosorbent assay,ELISA)试剂盒、白细胞介素-6(interleukin-6,IL-6)ELISA 试剂盒(美国R&D Systems),膜联蛋白V(annexin V)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)染色试剂盒(美国BD Biosci⁃ence),活化半胱氨酸蛋白酶-3(cleaved-cysteinyl aspartate specific proteinase-3,cleaved-caspase-3)兔抗(美国Abcam),聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜(美国GE Health),PrimeScriptTMRT 试剂盒(日本宝日医),SYBR GREEN qPCR Su⁃per Mix(美国Invitrogen),LINC00707 小干扰RNA(si-LINC00707)、阴性对照siRNA(si-NC)、miR-338-3p mimic/inhibitor(anti-miR-338-3p)、阴性对照(miR-NC/anti-miR-NC)(上海GenePharma)。
1.2 测定LINC00707 表达情况
使用Trizol 提取脓毒症患者血清RNA。为了分析LINC00707,使用PrimeScriptTMRT 试剂盒将总RNA 反转录为cDNA,并将SYBR GREEN qPCR Super Mix 用于实时定量聚合酶链反应(quantitative real time polymerase chain reaction,qRT-PCR)。实验中使用的引物序列如下:LINC00707 正向为5"-CCAACAGGGTATCAGAATTCTC-3",反 向 为5"-TGCTGACAATAGCCATTAGG-3";
内 参GAPDH 正向为5"-TGGTATCGTGGAAGGACTCAT-3",反向为5"-GTGGGTGTCGCTGTTGAAGTC-3"。使用Ap⁃plied Biosystems7500 检测系统进行qRT-PCR。使用2-ΔΔCT方法计算LINC00707 的相对倍数变化。
1.3 细胞培养与脂多糖损伤
H9C2细胞在含有5%二氧化碳的培养箱中,于37℃并在补充有100 μg·mL-1链霉素、100 μg·mL-1青霉素和10%胎牛血清的Dulbecco"s Modified Eagle培养基(DMEM)中培养。LPS损伤时,以10 μg·mL-1LPS 诱导24 h[12]复制脓毒症模型。
1.4 实验分组
H9C2 细胞分为NC 组(对照)、LPS 组(10 μg·mL-1LPS)、LPS+si-NC 组(转染si-NC+10 μg·mL-1LPS)、LPS+si-LINC00707 组(转染si-LINC00707+10 μg·mL-1LPS)、LPS+miR-NC 组(转染miR-NC+10 μg·mL-1LPS)、LPS+miR-338-3p 组(转染miR-338-3p mimic+10 μg·mL-1LPS)、LPS+si-LINC00707+anti-miR-NC 组(转染si-LINC00707 与anti-miRNC+10 μg·mL-1LPS)、LPS+si-LINC00707+antimiR-338-3p 组(转染si-LINC00707 与anti-miR-338-3p+10 μg·mL-1LPS)。使 用Lipofectamine 2000 试剂进行上述转染,24 h 后用10 μg·mL-1LPS诱导H9C2 细胞。
1.5 测定炎症因子TNF-α、IL-6 的浓度
根据制造商推荐的方案,使用高灵敏度TNF-α ELISA 试剂盒、IL-6 ELISA 试剂盒分析H9C2 细胞培养上清液中TNF-α 和IL-6 的浓度。用酶标仪测量450 nm 处的光密度,并根据标准曲线分析炎症因子TNF-α、IL-6 数据。
1.6 流式细胞仪检测H9C2 细胞的凋亡
处理后,收集H9C2 细胞(1×106),用冷磷酸盐缓冲液(PBS)洗涤,并重悬于500 μL 1×结合缓冲液中,然后与Annexin V-FITC(5 μL)和PI(10 μL)混合,将混合物在室温下黑暗中放置15 min,并使用Beckman Coulter 流式细胞仪进行凋亡分析。
1.7 Western blot检测cleaved-caspase-3蛋白的表达
在细胞裂解液中于4℃裂解H9C2 细胞30 min,并用二辛可宁酸法测定总蛋白。将等量的蛋白通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,然后转移到PVDF 膜上。接下来,将PVDF 膜与一抗和二抗一起孵育。本研究中使用的一抗和二抗包括抗cleaved-caspase-3(1∶1 000 稀释度)和IgG-HRP 二抗(1∶10 000 稀释度)。β-肌动蛋白(β-actin;
1∶1 000 稀释度)用作上样对照。最后,使用电化学发光溶液探测PVDF膜。通过Quantity One 软件对蛋白条带进行定量和分析。
1.8 双荧光素酶活性实验分析LINC00707 对miR-338-3p 的靶向调控
Stabase 软件用于LINC00707 和miR-338-3p 的结合位点预测。构建含有miR-338-3p 结合位点的LINC00707-野生型(wild type,WT)及突变型(mutant type,MUT)片段,并将其克隆到psi-CHECK2载体中,分别命名为LINC00707-WT和LINC00707-MUT。使用Lipofectamine 2 000试剂在H9C2细胞中转染miR-338-3p mimic 或miR-NC 和LINC00707-WT 及MUT 报告基因载体。使用Promega 双荧光素酶报告基因测定系统测定48 h 后H9C2 细胞的海肾和萤火虫的萤光素酶活性比。另转染pcD⁃NA-LINC00707、pcDNA、si-LINC00707 和si-NC 于H9C2 细胞中,记为LINC00707 组、pcDNA 组、si-LINC00707 组 和si-NC 组,48 h 以qRT-PCR 测 定LINC00707 和miR-338-3p 表达。
1.9 统计学分析
在SPSS 22.0 软件中进行数据的统计分析。计量资料以()表示,组间比较采用t检验,多组间差异通过单因素方差分析进行,组间两两差异通过SNK-q检测进行。以P<0.05 为差异有统计学意义。
2.1 脓毒症患者血清LINC00707 表达情况
57 例脓毒症患者血清LINC00707 表达水平(2.14±0.25)比健康对照(1.00±0.13)增加了1.14 倍左右(t=30.544,P<0.05)。
2.2 LPS 诱导的H9C2 细胞LINC00707 表达情况
在10 μg·mL-1LPS 诱 导 的H9C2 细 胞 中,LINC00707 表达水平(1.93±0.15)比对照NC(1.00±0.07)增加0.93 倍左右(t=16.855,P<0.05)。
2.3 si-LINC00707 抑制LPS 处理的H9C2 细胞凋亡和炎症因子表达
LPS 组H9C2 细 胞 中LINC00707 表 达 水 平、TNF-α、IL-6 的浓度高于NC 组,并且cleaved-cas⁃pase-3 蛋白表达水平和细胞凋亡率也高于NC 组(P<0.05)。H9C2 细胞转染si-LINC00707 后,LPS+si-LINC00707组LINC00707表达水平、TNF-α、IL-6的浓度以及cleaved-caspase-3 蛋白表达水平、细胞凋亡率均低于LPS+si-NC 组(P<0.05),见表1、图1。
表1 si-LINC00707 抑制LPS 处理的H9C2 细胞凋亡和炎症因子表达 [n=9,±s]

表1 si-LINC00707 抑制LPS 处理的H9C2 细胞凋亡和炎症因子表达 [n=9,±s]
注:与NC 组比较,*P<0.05;
与LPS+si-NC 组比较,1)*P<0.05
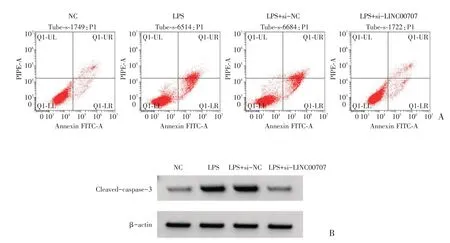
图1 si-LINC00707 抑制LPS 处理的H9C2 细胞凋亡和cleaved-caspase-3 蛋白表达水平(A:流式细胞仪检测H9C2 细胞的凋亡;
B:Western blot 检测cleaved-caspase-3 蛋白的表达)
2.4 LINC00707 靶向miR-338-3p,调控miR-338-3p 的表达
Stabase 软件中预测的LINC00707 和miR-338-3p 靶向结合位点见图2。MiR-338-3p 组转染LINC00707-WT的H9C2细胞荧光素酶活性比miRNC组减少了0.58倍左右(P<0.05),转染LINC00707-MUT 的H9C2 细胞荧光素酶活性在miR-338-3p组与miR-NC 组之间无明显差异(P=0.492),见表2。LINC00707 组H9C2 细 胞 的LINC00707 表 达 水 平(2.43±0.15)比pcDNA 组(1.00±0.08)增加,miR-338-3p 表达水平(0.45±0.03)比pcDNA 组(1.00±0.10)减少(P<0.05),si-LINC00707 组H9C2 细胞的LINC00707 表达水平(0.34±0.01)比si-NC 组(1.02±0.09)减少(P<0.05),miR-338-3p 表达水平(1.91±0.14)比si-NC 组(0.99±0.07)增加(P<0.05)。
表2 miR-NC 或miR-338-3p mimic 与LINC00707 报告质粒共转染H9C2 细胞后双荧光素酶活性检测 [n=9,±s]

表2 miR-NC 或miR-338-3p mimic 与LINC00707 报告质粒共转染H9C2 细胞后双荧光素酶活性检测 [n=9,±s]
注:与miR-NC 组比较,*P<0.05

图2 Stabase 对LINC00707 和miR-338-3p 结合进行预测示意图
2.5 miR-338-3p 抑制LPS 处理的H9C2 细胞凋亡和炎症因子表达
H9C2 细胞中转染miR-338-3p mimc 后,LPS+miR-338-3p 组miR-338-3p 表达水平高于LPS+miR-NC 组,TNF-α、IL-6 的浓度以及cleaved-cas⁃pase-3 蛋白表达水平、细胞凋亡率均低于LPS+miR-NC 组(P<0.05),见表3、图3。
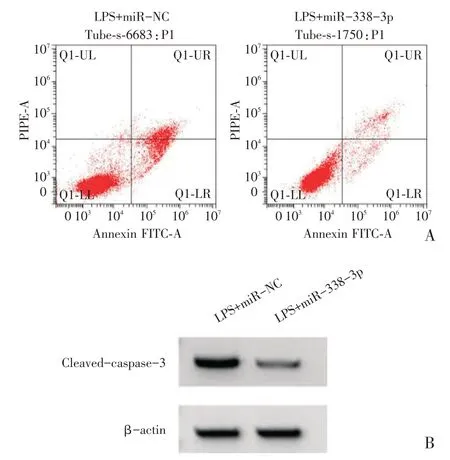
图3 miR-338-3p 抑制LPS 处理的H9C2 细胞凋亡和cleaved-caspase-3 的蛋白表达(A:流式细胞仪检测H9C2细胞的凋亡;
B:Western blot 检测cleaved-caspase-3 蛋白的表达)
表3 miR-338-3p 抑制LPS 处理的H9C2 细胞凋亡和炎症因子表达 [n=9,±s]
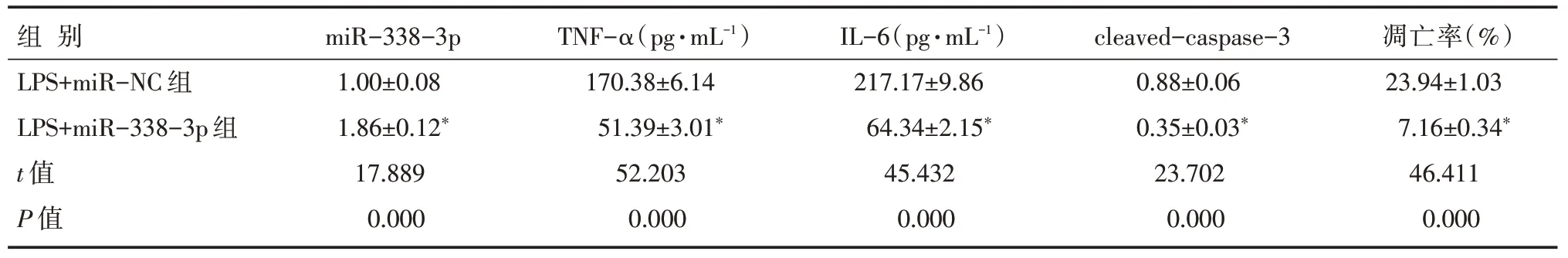
表3 miR-338-3p 抑制LPS 处理的H9C2 细胞凋亡和炎症因子表达 [n=9,±s]
注:与LPS+miR-NC 组比较,*P<0.05
2.6 anti-miR-338-3p 逆 转si-LINC00707 对LPS处理的H9C2 凋亡和炎症因子表达的影响
H9C2 细胞中转染si-LINC00707 与anti-miR-338-3p 后,LPS+si-LINC00707+anti-miR-338-3p 组miR-338-3p 表达水平低于LPS+si-LINC00707+anti-miR-NC 组,TNF-α、IL-6 的浓度以及cleavedcaspase-3 蛋白表达水平、细胞凋亡率均高于LPS+si-LINC00707+anti-miR-NC 组(P<0.05),见表4、图4。
表4 anti-miR-338-3p 可以逆转si-LINC00707 对LPS 处理的H9C2 凋亡和炎症因子表达的影响 [n=9,±s]

表4 anti-miR-338-3p 可以逆转si-LINC00707 对LPS 处理的H9C2 凋亡和炎症因子表达的影响 [n=9,±s]
注:与LPS+si-LINC00707+anti-miR-NC 组比较,*P<0.05

图4 anti-miR-338-3p 逆转si-LINC00707 对LPS 处理的H9C2 凋亡和cleaved-caspase-3 蛋白表达(A:流式细胞仪检测H9C2 细胞的凋亡;
B:Western blot 检测cleaved-cas⁃pase-3 蛋白的表达)
目前认为脓毒症中的心肌损伤机制与炎性因子密切相关。革兰氏阴性细菌是引起脓毒症的主要病原体。这些细菌细胞壁中的LPS 是脂质和多糖复合物,可以激活单核细胞和巨噬细胞,引起许多病理生理变化,包括释放大量促炎因子,例如TNF-α 和IL-6[13]。研究显示,LPS 可通过升高心肌组织中TNF-α、IL-6 的浓度来加重脓毒症小鼠的心脏功能障碍或H9C2 细胞的体外损伤[14]。此外,凋亡是脓毒症和败血性心脏病的关键原因[15]。本研究在LPS 刺激的H9C2 细胞模型中进行研究,发现LPS 治疗可诱导H9C2 细胞中TNF-α、IL-6 的表达,增加细胞凋亡率和凋亡执行蛋白cleavedcaspase-3 表达,导致细胞凋亡和炎症损伤,与前人研究[13,16]吻合。
本研究发现,脓毒症患者血清和LPS 诱导的H9C2细胞中LINC00707上调,因此推测LINC00707在脓毒症中起着至关重要的作用。研究表明,LINC00707调节癌细胞的增殖、凋亡和侵袭等[17-18]。根据报道,在LPS 处理的神经细胞PC-12 中,LINC00707 表达上调,LINC00707 的抑制通过靶向miR-30a-5p 减轻LPS 诱导的PC-12 细胞炎症和细胞凋亡,具体表现为抑制LINC00707 降低IL-1β、IL-6 和TNF-α 的浓度,并抑制细胞凋亡[5]。在LPS 处 理 的MRC-5 细 胞 中,LINC00707 升 高,LINC00707 的敲低通过充当miR-223-5p 的海绵减轻MRC-5 细胞中LPS 触 发 的 损 伤[6]。但 是,LINC00707 对脓毒症心肌病炎症和凋亡的作用仍不清楚。转染si-LINC00707 敲减LINC00707 后,LPS 诱导的H9C2 细胞中TNF-α 及IL-6 的浓 度、cleaved-caspase-3 蛋白表达和凋亡率均降低,提示敲减LINC00707 减轻了LPS 诱导的炎症和H9C2细胞凋亡,与前述报告类似。这些结果表明敲减LINC00707 在LPS 处理的H9C2 细胞中具有抗凋亡和抗炎作用。
此外,本研究还评估了LINC00707对LPS处理的H9C2 细胞凋亡和炎症发挥作用的潜在分子机制。lncRNA 可以充当miRNA 的分子海绵,并起竞争内源性RNA 的作用[19]。在结直肠癌中,LINC00707 通过使miR-206 变海绵促进增殖和转移[20]。本实验的机理研究表明,通过Stabase 和双荧光素酶活性实验分析,miR-338-3p 是LINC00707 的靶标。MiR-338-3p 在消炎中起重要作用,在LPS 处理的16HBE 细胞中,miR-338-3p 被下调,miR-338-3p过表达减弱了LPS 诱导的16HBE 细胞炎性损伤[21]。在心肌梗死中,H9C2 细胞与过表达miR-338 的外泌体共培养时,细胞凋亡率降低,caspase3荧光强度增加[22]。此外,miR-338 被鉴定为心肌细胞缺氧/复氧诱导的自噬和自噬细胞死亡的新型抑制剂[23]。本研究发现,LINC00707 与miR-338-3p 靶向结合,并负调控miR-338-3p 表达。miR-338-3p mimc 降低LPS 诱导的H9C2 细胞中TNF-α 及IL-6 的浓度、cleaved-caspase-3 蛋白表达水平和细胞凋亡。另外,si-LINC00707 抑制LPS处理的H9C2 细胞凋亡和炎症因子表达的效果被anti-miR-338-3p 所逆转,这表明敲减LINC00707通过上调miR-338-3p 来抑制LPS 诱导的心肌细胞凋亡和炎症。
综上所述,本研究证明了LINC00707 在脓毒症患者血清和LPS 诱导的心肌细胞中高表达,敲减LINC00707 通过靶向miR-338-3p 来治疗LPS 引起的心肌细胞炎性损伤和细胞凋亡,这可能为脓毒症心肌病的治疗铺平了道路。
猜你喜欢 荧光素酶脓毒症试剂盒 6种非洲猪瘟荧光PCR试剂盒对比试验湖南畜牧兽医(2021年6期)2022-01-24农药残留快速检测试剂盒的制备方法及其应用研究食品安全导刊(2021年21期)2021-08-30NNMT基因启动子双荧光素酶报告系统的构建及其与SND1靶向关系的验证天津医科大学学报(2021年4期)2021-08-21不同双荧光素酶方法对检测胃癌相关miRNAs靶向基因TIAM1的影响中日友好医院学报(2021年1期)2021-04-14血清IL-6、APC、CRP在脓毒症患者中的表达及临床意义中华养生保健(2020年4期)2020-11-16重组双荧光素酶报告基因质粒psiCHECK-2-Intron构建转染及转染细胞萤火虫荧光素酶和海肾荧光素酶表达山东医药(2020年9期)2020-05-20试剂盒法制备细胞块的效果及其技术要点天津医科大学学报(2019年6期)2019-08-13脓毒症的病因病机及中医治疗进展中国中医急症(2019年10期)2019-05-214种试剂盒提取病理组织切片中裂头蚴DNA效果的比较中国人兽共患病学报(2018年7期)2018-07-31脓毒症早期诊断标志物的回顾及研究进展中华老年多器官疾病杂志(2016年9期)2016-04-28