李明源 ,王继莲 ,姚拓 ,王振龙 ,张惠荣 ,柴加丽 ,刘晓婷 ,李青璞
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中‐美草地畜牧业可持续发展研究中心,甘肃 兰州 730070;
2.喀什大学生命与地理科学学院,新疆帕米尔高原生物资源与生态自治区重点实验室,新疆 喀什 844006)
1‐氨基环丙烷‐1‐羧酸(1‐aminocyclopropane‐1‐car‐boxylic acid,ACC)是高等植物内源激素乙烯合成的直接前体,当植物遭受生物(如病原体感染)或非生物(如高温、盐渍、重金属等)胁迫时,往往会引起体内乙烯的大量合成[1-3]。但高浓度的乙烯会严重抑制植物生长,对农牧业生产极为不利。有研究表明,一些土壤有益菌可分泌ACC脱氨酶,能将ACC水解成a-酮丁酸盐和氨,从而降低逆境中植物体内的乙烯水平[1,4-5]。现已证实,通过微生物来源的 ACC 脱氨酶降低植物内源乙烯水平是植物与土壤微生物共同进化过程中应对逆境胁迫的一项关键策略[6-8]。微生物通过水解其直接前体ACC降低植物乙烯浓度,增强植物抗逆性。作为回报,ACC可被这些微生物用作营养来源。植物和微生物之间的这种互惠关系有望被用于缓解植物在逆境环境中的生长压力。
植物促生菌(Plant Growth-Promoting Bacteria,PGPB)是一类能对植物产生直接或间接促生作用的土壤有益菌[9]。产ACC脱氨酶是PGPB促进植物生长和增强抗逆性的重要机制之一[2]。植物遭受逆境时,体内会积累大量的ACC,其中部分ACC通过ACC氧化酶转化为乙烯;
同时,大量的ACC以根系分泌物的形式释放到根际土壤中,吸引能以ACC为营养的微生物在根际集聚[10]。这些微生物通过分解ACC,在实现自身营养繁殖的同时降低了根际的ACC浓度,致使植物根系内外形成ACC浓度差,促使体内ACC顺浓度梯度释放到土壤中,最终减少植物体内的乙烯积累并产生促进作用[10-11]。
祁连山是我国西北地区重要的生态安全屏障。为获得适用于该地区农牧业可持续发展所需生物肥料的优良菌种,本研究以前期从祁连山高寒草地优势牧草根际或根内分离的具有固氮、溶磷功能的PGPB为材料,筛选产ACC脱氨酶菌株,并通过盆栽接种实验评估其对低温胁迫下植物生长的影响。研究结果将对深入理解PGPB作用机制以及研制适用于高寒草地的生物菌肥提供理论依据。
1.1 菌种来源
供试菌株为实验室前期从甘肃农业大学天祝高山草原生态系统试验站(代号TZ),地理位置为N 37°11′、E 102°48′,海拔 2 884 m、中国科学院海北高寒草甸生态系统定位研究站(代号MY),地理位置N 37°37"、E 109°11",3 240 m 的高寒草地优势牧草根际或根内分离保存的PGPB,共821株(表1)。所有菌株经LB培养基活化后备用。

表1 供试菌株来源Table 1 Information of tested strains
1.2 培养基
采用DF和ADF培养基[12]筛选有ACC脱氨酶活性的菌株,ADF培养基即用ACC(3.0 mmol/L,过滤灭菌)代替DF培养基中的(NH4)2SO4。Hogland"s营养液参照文献[1]配制。
1.3 主要试剂与设备
实验所用试剂和设备为:ACC和α‐丁酮酸(分析纯)购自Sigma公司;
MDA、SOD、POD和CAT检测试剂盒购于北京索莱宝科技有限公司;
细菌基因组DNA提取试剂盒(OMEGA,USA);
紫外可见分光光度计(TU‐1901,北京普析通用仪器有限责任公司),光照培养箱(SPX‐GB‐300F,上海跃进医疗器械有限公司)。
1.4 产ACC脱氨酶菌株的筛选
参照Penrose等[12]方法,以点种法将供试菌株分别接种至DF和ADF培养基上,15 ℃培养3~5 d,每天观察菌落生长情况。在连续3次传代培养过程中,若ADF培养基上的菌落生长情况明显好于DF培养基,则说明该菌株能够以ACC为唯一氮源生长,即能合成ACC脱氨酶。
定量分析:将阳性菌株接入5 mL液体LB培养基 ,15 ℃ 、180 r/min 培 养 36 h,8 000×g、4 ℃ 离 心10 min弃上清。沉淀经不含(NH4)2SO4的DF液体洗涤2次后重悬于7.5 mL的ADF液体中,15 ℃、180 r/min培养 36 h,8 000×g、4 ℃离心 10 min弃上清液。沉淀再经0.1 mol/L Tris‐HCl(pH值7.6)洗涤2次,加入600 μL的0.1 mol/L Tris‐HCl(pH值8.5)重悬菌体沉淀,加入30 μL甲苯后涡旋振荡30 s以裂解菌体。取100 μL甲苯化的菌液通过Bradford法测定菌体蛋白量表征其生物量。剩余的甲苯化菌液参照Glick等[12]方法测定ACC脱氨酶活性。分别以牛血清白蛋白和α‐丁酮酸为标准物绘制标准曲线计算菌株ACC脱氨酶活性。酶活性是指单位时间内,菌体蛋白催化ACC脱氨分解为a‐丁酮酸的微摩尔数,单位:μmol/(mg∙h)。
1.5 产ACC脱氨酶菌株16S rRNA基因扩增与系统发育分析
通过细菌基因组DNA提取试剂盒提取阳性菌株DNA,以通用引物27F和1 492R[13]扩增 16S rRNA基因,PCR产物送由杨凌天润奥科生物科技有限公司完成测序。测序结果提交http://ezbiocloud.net/数据库比对分析,利用MEGA 7.0软件以邻近法(Neighbor-Joining)构建系统发育树,Bootstrap 值为 1000。
1.6 植物促生实验
选用祁连山高寒草地人工补播主要牧草品种—垂穗披碱草(Elymus nutans)为供试植物,栽培方式为沙培。种子经1%的NaClO溶液表面消毒5 min,无菌水冲洗3遍后均匀播种于塑料杯中(口径9.5 cm×底径6.0cm×杯高13 cm,每杯装约500 g灭菌河沙),置于光照培养箱培养(25 ℃,光照14 h、黑暗10 h,湿度为60%~70%,光强度为4 000 lx)。实验分接种处理(接种产ACC脱氨酶菌株)和对照(接种无菌LB液体)。待幼苗生长至14 d后进行接种和低温胁迫。供试菌株先经LB液体培养基于15 ℃、180 r/min培养36~48 h,调整培养液D600nm值为0.8(细胞浓度约1×1010CFU/mL)。细菌接种量为3 mL/杯,每种菌接种5杯。设置 25、18、12、8、4 ℃共 5个温度梯度,不同温度下胁迫处理48 h后,取样通过试剂盒测定植株地上部茎、叶中主要抗氧化酶(SOD、CAT和POD)活性及MDA含量,以无水乙醇浸提取法测定叶绿素含量。实验结束后收获幼苗,每个塑料杯中随机选取5株,采用卷尺测定株高;
利用游标卡尺测量茎粗;
采用根系扫描仪(LA2400 Scanner,Epson Expression 10000XL)扫描根系,得到总根长、根表面积、平均根直径和根尖数等数据;
分别将植株地上和地下部分装入纸袋,于烘箱105 ℃杀青30 min后调至70 ℃烘干至恒重,用分析天平测定地上和地下部干重。
1.7 数据统计分析
采用SPSS 25.0和Origin 2021软件对实验数据进行统计分析和绘图;
通过One Way ANOVA和Dun‐can法进行方差分析和多重比较(α=0.05)。图表数据为平均值±标准差。
2.1 产ACC脱氨酶菌株的筛选
根据ADF与DF培养基上菌落生长情况,从821株供试菌株中初筛得到19株产ACC脱氨酶菌株(图1)。通过定量分析菌株ACC脱氨酶活性,并按照Pen‐rose和Glick的建议,以ACC脱氨酶活性不低于20 nmol/(mg·h)作为活性菌株筛选标准,最终得到11株酶活性较高的菌株(表2)。其中TZnG2菌株的酶活性最高,达 3.42±0.12 μmol/(mg·h),但酶活性大于1 μmol/(mg·h)的菌株仅有 4株。

图1 ACC脱氨酶活性菌株定性筛选Fig.1 Qualitative screening of ACC deaminaseproducing strains
2.2 产ACC脱氨酶菌株系统发育分析
经16S rRNA基因测序和系统发育分析,11株产ACC脱氨酶菌株分别属于欧文氏菌属(Erwinia)、假单 胞 菌 属(Pseudomonas)、黄 杆 菌 属(Flavobacte⁃rium)、不动杆菌属(Acinetobacter)和贪噬菌属(Var⁃iovorax)5个不同细菌属(表2,图2),其中以欧文氏菌属(4株)占比最多,占总菌数的36.36%;
假单胞菌属3株,占27.27%;
黄杆菌属2株,占18.18%;
不动杆菌属和贪噬菌属各1株,分别占9.09%。
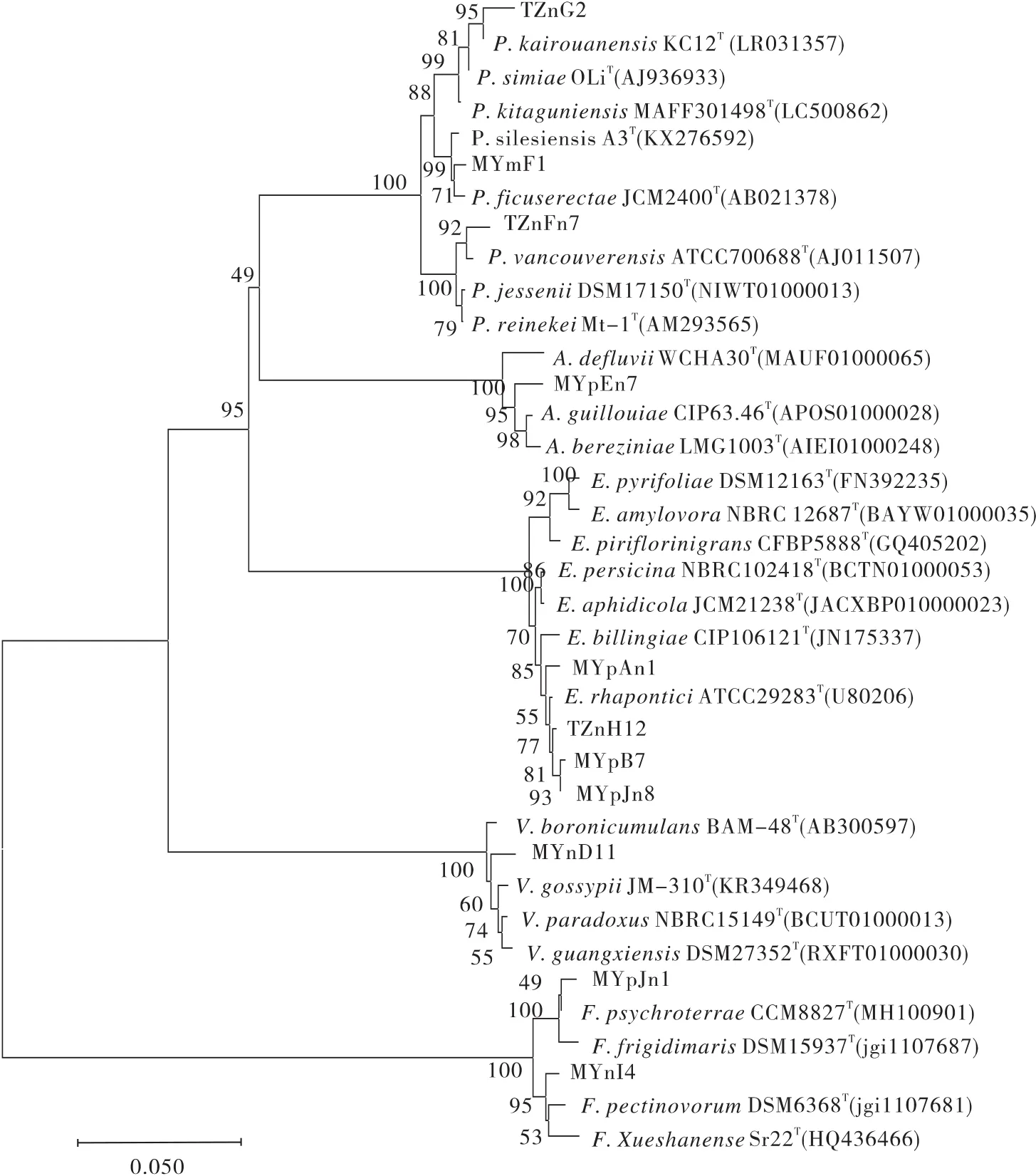
图2 产ACC脱氨酶菌株系统发育分析Fig.2 Phylogenetic analysis of ACC deaminase-producing strains

表2 11株产ACC脱氨酶菌株的酶活性与分类地位Table 2 Enzyme activity and classification status of 11 ACC deaminase-producing strains
2.3 接种产ACC脱氨酶菌株对低温胁迫下垂穗披碱草生长的影响
选取 ACC 脱氨酶活性大于 1 μmol/(mg∙h)的 4株菌(TZnG2、MYnI4、MYnD11和TZnFn7)接种垂穗披碱草幼苗,结果表明,它们对垂穗披碱草生长和生物量积累均有积极影响(表3)。相比对照组,接菌处理显著促进了株高、茎粗、地上干重和地下干重的增长。其中以MYnI4对株高促生作用最大,相比对照增加了22.96%。对茎粗、地上和地下干重促进作用最突出的均为菌株TZnG2,分别增长了29.09%、126.38%和186.67%。除接种菌株TZnFn7外,其他菌株均对根系发育有明显促进作用,尤以MYnI4作用最明显(表4)。但接种菌株TZnFn7减少了根尖数量,具体原因尚不明确。

表3 低温胁迫下接种产ACC脱氨酶菌株垂穗披碱草的生长状况Table 3 Growth states of E.nutans inoculated with ACC deaminase-producing strains under low temperature stress

表4 低温胁迫下接种产ACC脱氨酶菌株垂穗披碱草的根系发育状况Table 4 Root growth states of E.nutans inoculated with ACC deaminase-producing strains under low temperature stress
2.4 接种产ACC脱氨酶菌株对低温胁迫下垂穗披碱草植株叶绿素含量的影响
随温度降低,对照组植株叶片叶绿素a含量逐渐减少(图3‐A),相比25 ℃处理,4 ℃时下降了30.27%。但接种产ACC脱氨酶菌株后,叶绿素a呈现出随温度下降呈先降低后升高的趋势,且变化幅度变小。比较之下,接种TZnFn7效果最显著,相比25 ℃,叶绿素a含量在4 ℃仅下降了2.08%。
与叶绿素a含量变化趋势相似,伴随温度降低,对照组叶绿素b含量显著减少(图3‐B)。叶绿素b含量在4℃时相比25 ℃下降了47.82%。但接种TZnFn7后叶绿素b含量表现出先降低后升高趋势,其中在12℃时含量最低,仅为25 ℃时的84.55%,随后逐渐升高,4 ℃时的叶绿素b含量达到25 ℃时的93.79%。其它接种处理呈现出与对照相似的规律,叶绿素b含量随温度降低而下降,但总体下降趋势减缓。
随温度降低,对照组类胡萝卜素含量呈逐渐下降趋势,相比25 ℃,在4 ℃时下降了18.65%。但接种菌株TZnFn7和MYnI4后表现出先下降后升高趋势,在4 ℃时,类胡萝卜素含量分别为25 ℃时的96.64%和105.01%(图3‐C)。接种 TZnG2和MYnD11后植株类胡萝卜素含量变化规律与对照相似,但相比对照下降趋势平缓。

图3 低温胁迫下接种产ACC脱氨酶菌株垂穗披碱的草叶绿素含量Figure 3 Chlorophyll content of E.nutans inoculated with ACC deaminase-producing strains under low temperature stress
2.5 接种产ACC脱氨酶菌株对低温胁迫下垂穗披碱草抗氧化酶活性的影响
2.5.1 对低温胁迫下植株SOD的影响 SOD是植物体内极为重要的抗氧化酶,随着温度降低,各处理植株茎叶中SOD酶活性均呈现出逐渐升高趋势(图4‐A)。但接种菌株处理后,SOD酶活性表现出一定规律的波动变化。接种TZnG2和TZnFn7后在25 ℃到12 ℃时SOD酶活性逐步升高,但在8 ℃时降低,4 ℃时又再次升高。而接种MYnD11和MYnI4在18 ℃时酶活性最低,后随温度降低而逐步升高。
2.5.2 对低温胁迫下植株POD的影响 随着温度降低,无论对照还是接种处理,POD活性总体呈现出先升高后降低再上升的趋势(图4‐B)。接种TZnG2后在8 ℃时POD活性达到最高值,相比25 ℃时提高了42.98%。接 种 TZnFn7、MYnD11和 MYnI4后在25 ℃到12℃时POD活性逐渐升高,8 ℃时下降,而在4 ℃时又升高且达到最高值,相比25 ℃分别提高了9.48%、74.27%和42.55%。相比之下,对照组变化幅度更大,POD活性在12 ℃时最低,相比25 ℃时下降了21.97%,8 ℃时最高,相比25 ℃时提高了35.93%。
2.5.3 对低温胁迫下植株内CAT的影响 随温度降低,接种菌株与对照植株茎叶中CAT活性均呈现出先上升后下降的趋势,且波动幅度均不大(图4‐C)。除接种菌株MYnI4在8 ℃时酶活力变化较大外,其余菌株与对照在各温度下均无显著差异。
2.5.4 对低温胁迫下植株内MDA含量的影响MDA是植物细胞膜脂过氧化的分解产物,其含量变化可反映植物遭受逆境损伤的程度。随着温度降低,接种菌株和对照植株茎叶中MDA含量均呈上升趋势(图4‐D)。相比而言,对照植株内MDA积累更快,除12 ℃外,其他温度下接种菌株与对照之间无显著差异。

图4 低温胁迫下接种产ACC脱氨酶菌株垂穗披碱草植株的抗氧化酶活性Fig.4 Antioxidant enzyme activity of Elymus nutans inoculated with ACC deaminase-producing strains under low temperature stress
乙烯是一种重要的植物内源激素,能作为信息分子在植物细胞之间传递进而实现对植物生长发育的调节。当植物遭受高温、冷害、盐碱等逆境胁迫时会增强细胞内ACC合成酶活性,导致产生大量乙烯进而对植物生长不利。产ACC脱氨酶的PGPB能降解植物乙烯合成的直接前体ACC而赋予植物对盐碱胁迫[1,2,11]、冷胁迫[14]及干旱胁迫[15]等多种逆境的耐受性,被认为是提高植物抗逆性的有效途径。
Li等[16]将阴沟肠杆菌Enterobacter cloacaeUW4中的ACC脱氨酶基因(acdS)导入大肠杆菌(Esch⁃erichia coli)、巴西固氮螺菌(Azospirillumbrasilense)及恶臭假单胞菌(Pseudomonas putida)等细菌中,发现阳性转化菌株都能促进油菜幼苗根的生长。而失去ACC脱氨酶基因的负突变株也同时失去促生能力,说明产ACC脱氨酶是PGPB促进植物生长的关键机制之一。Onofre-Lemus等[17]研究发现,产ACC脱氨酶是伯克霍尔德菌属(Burkholderia)的普遍特征,能调节番茄乙烯水平并促进其生长。本研究将产ACC脱氨酶菌株接种低温胁迫下的垂穗披碱草幼苗获得了相似结果,进一步验证产ACC脱氨酶菌株能有效减缓低温对垂穗披碱草幼苗的损害,增强其抵御低温胁迫能力,发挥促生作用。
优良菌种是研制功能性生物菌肥的基础。目前,筛选产ACC脱氨酶菌株的方法主要有定向富集法[12],即以ACC为唯一氮源配制培养基进行筛选与培养;
或针对编码ACC脱氨酶基因的acdS基因设计特异性引物,借助PCR手段进行筛选。相比之下,传统的定向富集法耗时较长,工作量巨大而效率低;
PCR法快捷、灵敏、高效,但依赖于特异性高的引物设计和PCR反应条件。因此,两种方法各有利弊,需根据实际操作选择应用。
低温是影响植物生长和限制其地理分布的重要胁迫因素,它能通过破坏植物细胞结构和引起生理生化代谢紊乱而对植物产生伤害[18]。冷胁迫下,植物细胞叶绿素合成受阻,细胞膜脂过氧化产物丙二醛大量积累,活性氧增多而使细胞膜系统功能丧失和结构改变,为消除活性氧,细胞内抗氧化酶(如SOD、POD、CAT等)活性迅速升高[19]。因此,MDA含量变化及抗氧化防御酶活性是低温胁迫下植物应激反应的重要监测指标。研究表明,分泌ACC脱氨酶的PGPB能通过诱导植物细胞抗氧化酶活性进而提升抗逆能力[20]。Singh将 ACC 脱氨酶菌株Stenotrophomonas maltophiliaSBP‐9接种小麦,发现其能提高小麦应对非生物胁迫的能力,促进其在逆境下的生长[21]。Habib等[22]将 产 ACC 脱 氨 酶 菌 株Enterobactersp.UPMR18接种秋葵,可以提高幼苗在高盐胁迫下的发芽率、生长参数和叶绿素含量,而且秋葵植株内抗氧化酶(SOD、APX和CAT)活性也有效提高。
何敏等[23]从青藏高原北部退化草原的土壤中分离到的短杆菌属Brevibacteriumsp.TS22和蕈状芽孢杆菌Bacillus mycoidesTS27具有较高ACC脱氨酶活性,在10 ℃环境下接种早熟禾和老芒麦实验表明,它们能有效促进株高、根长、地上和地下部干重的增长,但促生效果因植物和菌种的不同而有所不同。Tara等[24]从芦荟根际分离得到1株具有多种促生属性的耐冷短杆菌Brevibacterium frigoritoleransSMA23,在10 ℃低温下对小麦生长有积极影响。李玫等[25]在低温胁迫下对海榄雌幼苗进行接种PGPB试验,结果表明接种PGPB能有效增强海榄雌幼苗抗寒能力并促进其生长,且PGPB的混合接种比单一接种效果更佳。刘维红等[14]采用定向富集法从不同蔬菜根际筛选到多株ACC脱氨酶活性菌株,选取活性最高的LA1、XG32和YC1接种番茄幼苗,发现3株菌能明显缓解低温胁迫对番茄初生苗的伤害,促进其生长,且浇菌液接菌促生效果优于浸种接菌。因此,土壤中产ACC脱氨酶菌株的开发应用是提升植物抗逆性的有效策略,对盐碱地的高效应用以及增强植物应对生物或非生物胁迫有重要意义。
从祁连山高寒草地的821株细菌中筛选得到11株有ACC脱氨酶活性的菌株,被区分为5个不同菌属,其中有 4株酶活性大于 1 μmol/(mg·h),具有进一步开发应用价值。接种产ACC脱氨酶菌株能有效减缓低温胁迫下垂穗披碱草叶绿素含量下降,提高SOD、POD和CAT等抗氧化酶活性,促进植物生长。
猜你喜欢 碱草脱氨酶叶绿素 原生草美文(2022年18期)2022-10-20西藏3 种野生披碱草农艺性状分析西藏农业科技(2021年4期)2021-04-18痰液中的腺苷脱氨酶浓度的检测在肺结核诊治中的应用当代临床医刊(2021年1期)2021-04-01NaHCO3和Na2CO3胁迫对碱茅和披碱草种子萌发、幼苗生长和生理指标的影响*中国科学院大学学报(2021年2期)2021-03-18提取叶绿素阅读(科学探秘)(2020年8期)2020-11-06青海高原披碱草属种间天然杂种的细胞学鉴定植物研究(2019年6期)2019-11-15锌对白菜和香葱叶绿素含量的影响研究绿色科技(2019年2期)2019-05-21桃树叶绿素含量与SPAD值呈极显著正相关中国果业信息(2019年1期)2019-01-05恶臭假单胞菌UW4中趋化受体蛋白的克隆、表达及鉴定天津农业科学(2018年5期)2018-06-23结核性脑膜炎脑脊液腺苷脱氨酶检测的临床意义及应用价值中国医药指南(2018年3期)2018-03-23