孙皓月,李文刚,俞世康,伍德洋,陈汉发,杨洁,宋朝鹏,贾宏昉,谢良文*
农艺与调制
上部叶脂质代谢与烟叶褐变的关系研究
孙皓月1,李文刚2,俞世康3,伍德洋4,陈汉发4,杨洁3,宋朝鹏1,贾宏昉1,谢良文2*
1 河南农业大学烟草学院,河南郑州 450000;
2 四川省烟草公司,四川成都 610000;
3 四川省烟草公司广元市公司,四川广元 628000;
4 四川省烟草公司凉山州公司,四川西昌 615000
【目的】为明确烤烟上部叶脂质代谢对烟叶褐变的影响。【方法】以云烟87和中川208两个品种的上部叶为试验材料,利用转录组学、透射电镜、扫描电镜和荧光实时定量PCR(qRT-PCR)技术从细胞生物学和分子层面对脂质氧化与上部烟叶的褐变关系进行系统的研究。【结果】(1)相比云烟87,易褐变的中川208上部叶褐变速度更快,且叶片达五成的褐变时间更短,褐变反应更剧烈;
进一步的转录组GO分析和KEGG富集分析结果显示中川208上部叶差异基因在脂类代谢(亚麻酸和亚油酸代谢)富集较多,表明脂质代谢与上部叶烟叶褐变密切相关。(2)对比云烟87,中川208上部叶成熟期角质层厚度明显增加,蜡质层破碎薄片明显增多,总脂肪酸含量、亚麻酸含量及脂氧合酶(LOX)酶活显著高于云烟87,表明中川208上部叶脂类代谢较旺盛,易发生脂质氧化。(3)qRT-PCR结果表明中川208上部叶中脂类代谢途径关键基因、、、等的表达量显著高于云烟87,其中脂质氧化关键基因表达量上调2.27倍【结论】相比云烟87上部烟叶,中川208上部叶褐变反应更剧烈,烟叶中的脂肪酸代谢更旺盛,脂类物质更易发生氧化反应,表明脂肪酸代谢引起的脂质氧化是中川208上部烟叶易褐变的一个重要因素。
上部叶;
脂质代谢;
褐变;
转录组学
上部烟叶因其致密的组织结构、丰富的物质积累,有助于提高卷烟产品的烟气浓度和丰富烟香[1],但在实际生产中也常见挂灰、杂色等问题。烟叶香气成分的形成与褐变反应密切相关,而另一方面烟叶褐变程度的加大也制约着烟叶商品等级与可用性。近年来,对烤烟褐变问题的研究多集中于多酚氧化酶及多酚类引起的酶促褐变反应,通过平衡施肥、改进采烤方式、喷施生长调节剂等方法显著减轻上部叶褐变情况[2-4]。在果蔬作物方面,有研究认为褐变的发生与脂质代谢有着密切的联系,低温胁迫下不饱和脂肪酸含量变化和脂质过氧化作用导致马铃薯褐变度降低[5];
去除蜡质脂质的果实褐斑病发病率降低[6];
延缓双孢蘑菇的脂质过氧化进程可降低其褐变指数[7],这些研究都表明果蔬类的脂质代谢和氧化是影响改变褐变进程的重要因素之一。云烟87烟叶作为主栽品种易考性耐烤性好,对比中川208烤后烟叶杂色比例较少[8-9]。为了明确脂质氧化是否参与烟叶的褐变过程,本研究选择烤烟品种云烟87和易褐变的中川208上部叶为适供材料,以转录组学分析为切入点,利用扫描电镜、透射电镜和qRT-PCR技术从细胞生物学和分子层面对脂质代谢与上部烟叶的褐变关系进行系统研究,对改善上部叶烘烤技术、提高上部叶的烘烤质量、降低烟农的经济损失、减少烟叶资源的浪费有重要意义。
1.1 试验材料
试验于2020—2021年在广元市剑阁县普安镇基地开展,供试烤烟品种为云烟87和易褐变的中川208,选取上部叶16~20叶位为供试材料。
1.2 试验设计
选择地势平坦、排水条件良好的地块,行株距为1.20 m×0.5 m,以当地优质烤烟生产方式,进行施肥和中耕管理。中部叶完全采摘后,采取长势大小一致、健康无病害的上部叶,每个品种各选取10片烟叶立即运往实验室,采用半叶法将烟叶一分为二并去除主脉,一半叶片4℃保存用于超微结构观察,一半叶片放入液氮内速冻后置于-80℃冰柜储存用于酶活性与转录组测定,其余叶片用于观察采后颜色变化,每个处理3次重复。
1.3 测定项目及方法
1.3.1 采后颜色变化测定
每品种选取5片用于采后颜色变化的测定,参考《YC/T 311—2009烤烟品种烘烤特性评价》[10]的方法,将采收烟叶悬挂放置于保持黑暗环境的室温中,从烟叶采收完成时每隔24 h进行褐变比例统计,测定变褐程度、变褐速度。
1.3.2 超微结构分析测定
参考郑小雨的方法[11],选取叶片第5到第7支脉之间右侧相同的位置,用手术刀切成1 mm×1 mm的小块,立即放入2.5%戊二醛溶液(pH 7.2~7.4,0.1 mol·L-1PBS缓冲液配制)中固定。透射电镜观察角质层:用1%锇酸(pH 7.2~7.4,0.1 mol·L-1PBS缓冲液配制)固定,经纯丙酮脱水后用Epon812环氧树脂包埋聚合。用Leica EM UC6 Miultracut超薄切片机(Leica Microsystems GmbH,Wetzlar,Germany)切出超薄切片,用醋酸双氧铀和柠檬酸铅双重染色,再用JEM-1400Plus型透射电镜(日本电子)进行观察并拍照,每个处理观察10个视野。扫描电镜观察表皮蜡质:置于4℃冰箱固定,随后进行反复脱水清洗干燥,置于日立S-3000扫描电镜下观察拍照,每个处理10个视野。用软件Photoshop 2020进行标注处理。
1.3.3 烟草叶片RNA提取及测序
提取样品总RNA并使用DNase消化DNA,用带有Oligo(dT)的磁珠富集真核生物mRNA;
加入打断试剂将mRNA打断成短片段,以打断后的mRNA为模板,用六碱基随机引物合成一链cDNA,然后合成二链cDNA,并使用试剂盒纯化成双链cDNA;
将纯化的双链cDNA再进行末端修复、加A尾并连接测序接头,然后进行片段大小选择,最后进行PCR扩增;
通过构建好的文库用Agilent 2100 Bioanalyzer质检合格后,使用Illumina平台进行上机测序,由上海欧易生物有限公司完成。
1.3.4 差异表达基因的注释及分析
由Illumina测序所得的数据进行质控(QC),以确定测序数据是否适用于后续分析。通过比较不同样本间数据,依据DESeq进行差异基因分析,并使用nbinom Test函数计算差异比较的值和Fold Change值。以Fold Change≥2且<0.05为条件筛选DEGs。选取差异基因数目大于2的GO条目,利用超几何分布检验计算差异编码基因列表中富集值,再对值经多重检验纠正后得到q值,进而判断差异基因在该GO中出现富集的情况,对其功能进行描述,阐明差异在基因功能上的体现。利用 KEGG 数据库对差异蛋白编码基因进行 Pathway 分析(结合 KEGG 注释结果),并用超几何分布检验的方法计算每个 Pathway 条目中差异基因富集的显著性。
1.3.5 差异基因qRT-PCR分析
按照Invitrogen公司的Real Master Mix(SYBR Green)试剂盒说明书进行荧光实时定量qRT-PCR。根据转录组测序结果筛选出有差异的脂类代谢基因:实时定量的实验数据以烟草组成型表达基因(GenBank: L18908.1)为内参基因,进行3次重复试验,采用2-ΔΔCt算法进行分析。假设目的基因在胁迫处理下的表达量是对照(正常培养)的N倍,N = 2-ΔΔCt,ΔΔCt = Treat(Ct样品-CtL25)-CK(Ct样品-CtL25)。
表1 烟叶脂类代谢相关基因的定量PCR引物序列

Tab.1 Quantitative PCR primer sequences of tobacco leaf lipid metabolism-related genes
1.3.6 LOX活性的测定
脂氧合酶(LOX)活性按照北京索莱宝科技有限公司生产的酶活试剂盒按照说明书方法进行测定。
1.3.7 脂肪酸含量测定
脂肪酸等成分检测方法采用下列标准:《YC/T288—2009烟草及烟草制品多元酸(草酸、苹果酸和柠檬酸)的测定气相色谱法》[12]。
1.3.8 统计分析
使用检验比较两个样本组,结果用平均值和相应的标准误差表示,使用SPSS 21.0进行统计分析。图片使用Origin 2018软件绘制。
2.1 采后烟叶颜色变化
由图1A可知,中川208上部叶在65 h时开始褐变,148 h时达五成褐变,168 h时达到八成褐变,云烟87上部叶73 h启动褐变,在152 h褐变至五成,在168 h达到八成褐,说明中川208上部叶的褐变速度快于云烟87上部叶。由图1B可知,中川208上部叶的褐变启动时间显著早于云烟87上部叶,褐变至五成、八成时间均极显著早于云烟87,说明中川208上部叶褐变反应剧烈程度较高。
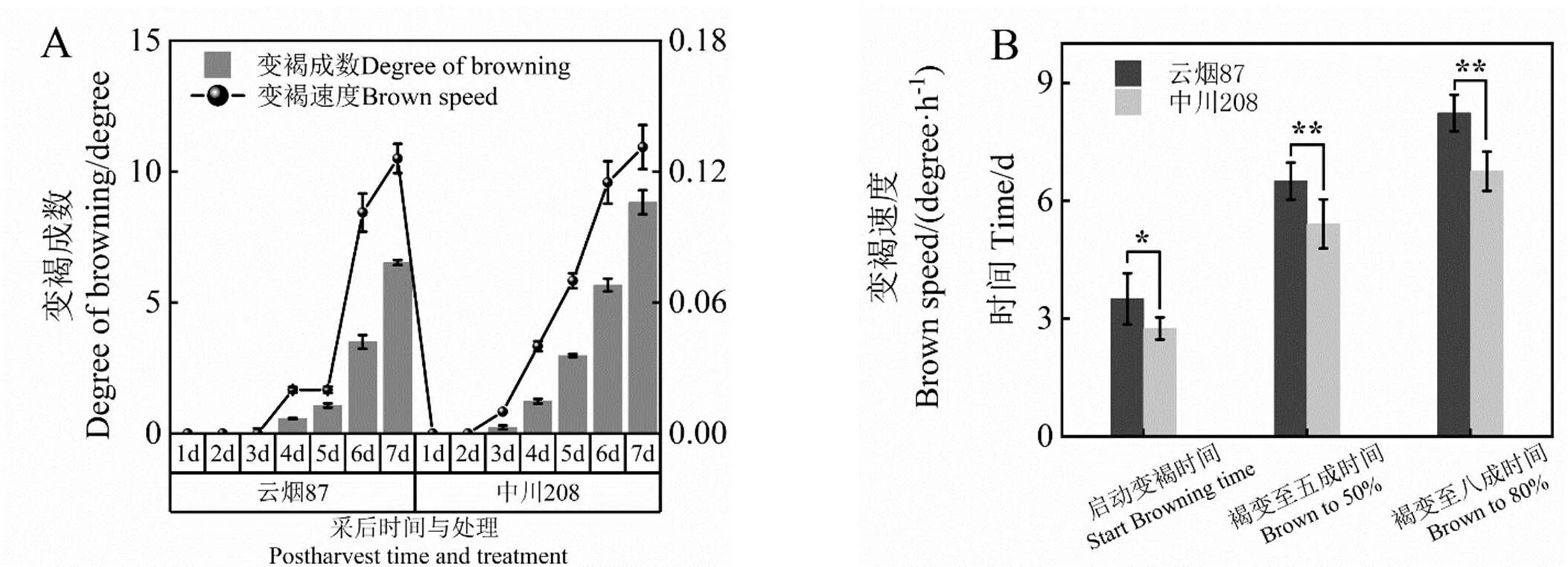
注: *和**分别表示在P<0.05和P<0.01水平差异显著,下同。
2.2 烟叶转录组差异基因分析
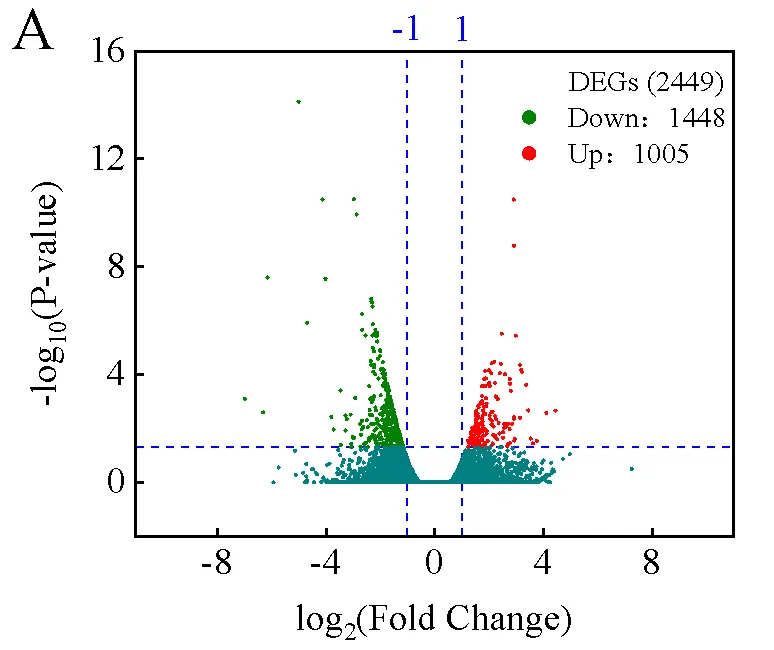
烟叶转录组基因显著性差异表达情况结果如图2A所示,中川208对比云烟87上部叶共有2453个差异表达基因(DEGs),包括1005个上调基因和1448个下调基因。差异表达基因的GO分析结果表明(图2B),差异表达基因主要富集在17个生物过程、9个细胞组成、7个分子功能方面,其中生物过程主要富集在防御反应,甘油、鞘脂类代谢,极长链脂肪酸、脂肪酶生物合成过程等;
细胞组成主要富集在等离子体膜、核、核小体等;
分子功能主要富集在酚氧化酶活性、甘油三酯脂肪酶活性、催化活性等。KEGG富集结果分析表明(图2C),差异表达基因被注释到202个通路中。其中主要富集通路(<0.05)参与碳氮代谢中的氨基酸(苯丙氨酸代谢和精氨酸、脯氨酸代谢)和糖代谢(氨基糖和核苷酸糖代谢),而次生代谢主要是酚类代谢(苯丙酮类代谢和黄酮类生物合成)和脂类代谢(亚麻酸和亚油酸代谢)等。
2.3 烟叶细胞超微结构观察
由图3所示,中川208上部叶角质层较厚,达7.138 μm,是云烟87上部叶的1.6倍。烟叶成熟期蜡质层呈破碎菱形晶体状,中川208上部叶蜡质层晶体破碎薄片较多且面积较大,主要集中分布于气孔附近,直径3 μm以上的蜡质颗粒达35个,高于云烟87上部叶2.3倍。说明对比云烟87上部叶,中川208烟叶角质层更厚,蜡质晶体含量更多,脂肪族化合物具有旺盛的生理代谢活性。

注:C:角质层;
W:细胞壁;
PM:质膜。
2.4 烤后烟叶的脂肪酸含量分析
烤后烟叶中7种脂肪酸的检测结果如图4A所示,肉豆蔻酸(C14:1)、棕榈酸(C16:0)、硬脂酸(C18:0)、花生酸(C20:0)、亚油酸(C18:2)、油酸和亚麻酸(C18:1、C18:3)含量均呈现出相同的趋势,中川208上部叶总脂肪酸含量显著高于云烟87上部叶,达到了1.13倍。其中,中川208上部叶亚油酸含量为3.03 mg/g,是云烟87上部叶的1.2倍,达到极显著差异,中川208上部叶肉豆蔻酸、油酸与亚麻酸分别显著增加了0.06 mg/g和0.16 mg/g。
由图4B可知,中川208上部鲜烟叶LOX酶活性显著高于云烟87上部叶,酶活增加了62.68%,说明中川208上部叶在一定程度上饱和与不饱和脂肪酸的积累较多,脂质降解氧化能力更强。
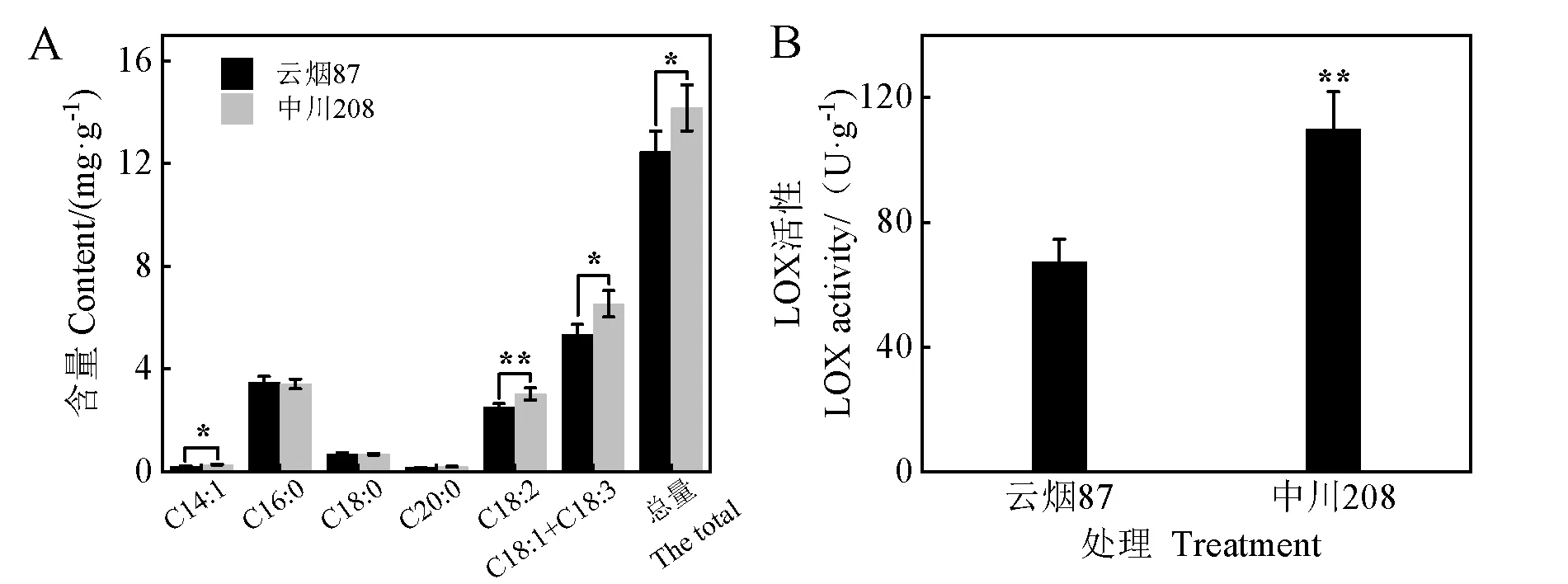
图4 烤后烟叶脂肪酸含量分析(A)与鲜烟LOX酶活性(B)
2.5 烟叶中脂肪酸代谢途径关键基因表达
烟叶脂肪酸代谢途径中关键基因的检测结果如图5所示,与云烟87上部叶相比,中川208上部烟叶中、、、、等基因表达量均显著上调,与转录组脂类代谢差异基因测定结果相一致,尤其是和基因,分别上调7.83和2.27倍,达到极显著差异。
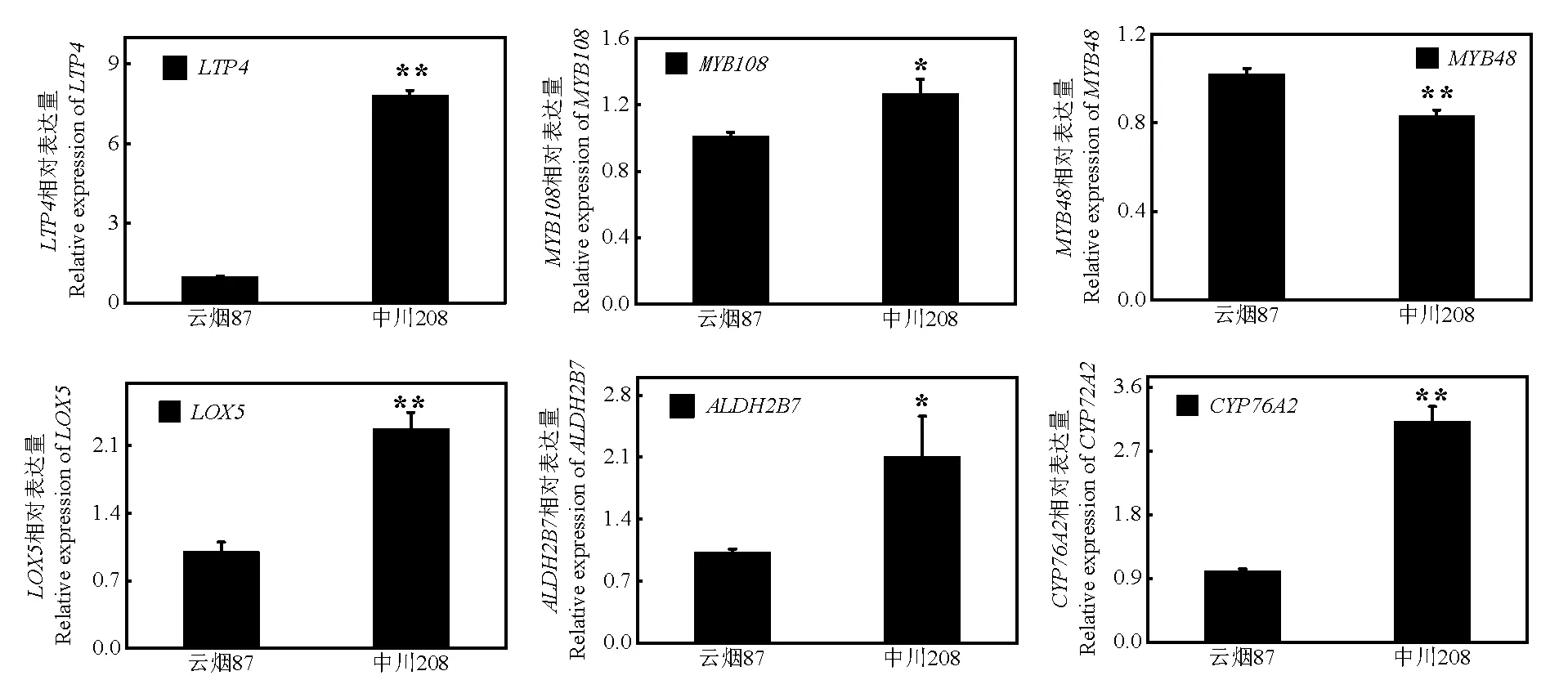
图5 脂肪酸代谢途径关键基因
云烟87与中川208的烟叶褐变差异基因富集在15个通路中,其中酚类代谢、脂质代谢、氨基酸代谢、糖代谢等通路可能是造成两品种褐变差异的重要原因。本研究发现烟叶褐变下脂肪酸代谢途径相关差异基因的表达变化与影响蝴蝶兰、茄子、苹果等褐变的调控基因表达结果相类似[13-15]。也与茶树新梢组培褐变后研究发现通过渗透调节次生代谢物质、激素调节和角质蜡质保护来抵御胁迫逆境[16]的结果相吻合。
酚类、黄酮类是植物果蔬酶促褐变的重要底物,当细胞膜系统被破坏时,酚类物质、类黄酮的氧化迅速转变成大量醌,最终导致褐变[17-18],这是目前经典的褐变机制。除了酚类物质,糖苷类、脂质类也可能是褐变的底物,但是相关研究较少。脂质代谢途径的关键酶被发现参与果蔬褐变,如ATP参与脂质的合成与脂肪酸的去饱和作用,影响膜的生理功能和理化性能[19-21],导致膜脂过氧化作用加剧,细胞间分割作用打破导致酶和底物结合,最终产生褐变[22-23]。本研究以不同品种烟叶为研究材料,结果显示与云烟87相比,更易发生褐变的中川208上部叶中脂类代谢差异显著,表明脂质代谢在中川208上部烟叶褐变过程中发挥关键作用,这与前人在其它果蔬上的研究相一致。
烟叶角质层主要由角质和蜡质组成。角质是一种由甘油、羟基脂肪酸及环氧脂肪酸组成的聚酯聚合物。蜡质沉积在表皮细胞最外层形成蜡质晶体,主要由脂肪族化合物(烷烃、脂肪酸、初级醇、醛)组成[24],大量研究表明植物脂肪酸代谢(脂质氧化)与蜡质层形成密切相关,蜡质层可以作为研究脂肪酸代谢的一个参考指标[25-26]。目前关于烟叶蜡质形成的生理生化和分子机制研究还未见详细报道。本研究发现中川208上部叶角质蜡质层明显增厚,同时在烟叶表面发现大量已经坍塌破碎的蜡质晶体,烟叶中脂肪酸含量显著提高。LOX是参与烟叶生长过程中脂质代谢途径的关键酶[27],LOX通过诱导不饱和脂肪酸中亚麻酸和亚油酸的氧化从而影响叶片的脂质氧化进程,中川208易褐变鲜烟叶中LOX活性显著增加,不饱和脂肪酸氧化更剧烈,增加了不饱和脂肪酸油酸、亚麻酸、亚油酸以及饱和脂肪酸肉豆蔻酸、硬脂酸和花生酸相对含量的积累。
本研究发现中川208上部叶脂质代谢途径关键基因、、、基因表达量显著提高。细胞色素P450中链羟化酶(CYP)家族成员,与角质生物合成中羟基化密切相关[28]。ALDHs是一个超家族蛋白,它依赖于NAD(P),能氧化许多内源依赖性酶、脂肪族和芳香族醛,生成羧 酸[29]。其中脂质转移蛋白(LTPs)被证明很可能有助于角质单体通过细胞壁向角质层的转运[30],中川208上部叶基因表达量与云烟87相比,增加了7.83倍,表明该基因在蜡质层形成过程中起关键作用,这中川208上部叶表皮蜡质积累量大相一致;
脂氧合酶基因家族(LOXs)参与调控脂氧合酶的活性和功能,在调控脂质氧化过程中发挥重要作用[31],中川208上部叶基因的表达量增加了2.27倍,与LOX酶活增加结果相一致。类基因参与蜡质的生物合成与转录,对蜡质合成途径中信号传导与调控起十分重要的作用[32],等上游调控因子表达量在两个品种中也具有显著差异,暗示MYB家族基因在两个品种的脂肪酸代谢途径中发挥关键作用。
综上,本研究初步从转录组、细胞生物学、物质代谢和分子层面系统深入分析了云烟87和中川208在上部叶脂质氧化与烟叶褐变中的差异,为证明脂质氧化参与烟叶褐变提供了理论依据。虽然本研究初步证实了脂质氧化影响烟叶的褐变,但是在分子水平上的证据仍不充分,后期将通过目的基因克隆和转基因技术进一步明确脂质代谢关键基因在调控烟叶褐变过程中的功能。
与云烟87相比,易褐变的中川208上部叶脂质代谢相关基因显著上调表达,脂肪酸代谢旺盛,角质层(包含蜡质层)增厚,烟叶表面蜡质积累量大。中川208上部叶较多的脂肪酸底物和较高的LOX酶活性是其烟叶发生脂质氧化产生褐变的一个重要因素。
[1] 刘婷. 三种农艺措施对提高烤烟上部烟叶可用性效果的研究[D].泰安: 山东农业大学, 2018.
LIU Ting. Effects of three agronomic measures on improving the availability of upper tobacco leaves of flue-cured tobacco [D]. Shandong Agricultural University, 2018.
[2] 仙立国,黄一兰,王松峰,等. 翠碧一号鲜烟叶素质及烘烤特性研究[J]. 中国烟草学报,2020, 26(3):66-73.
XIAN Liguo, HUANG Yilan, WANG Songfeng, et al. Study on quality and curing characteristics of CB-1 fresh leaves[J]. Acta Tabacaria Sinica, 2020, 26(3):66-73.
[3] 高娅北,娄晓平,张保全,等. 烤烟红花大金元不同素质上部烟叶烘烤特性研究[J]. 西南农业学报,2019, 32(10):2459-2465.
GAO Yabei, LOU Xiaoping, ZHANG Baoquan, et al. Southwest China journal of agricultural sciences, 2019, 32(10):2459-2465.
[4] 宋洋洋,张小全,杨铁钊,等. 烟叶采收成熟度对烘烤过程中酶促棕色化反应相关指标的影响[J]. 西北植物学报,2014, 34(12): 2459-2466.
SONG Yangyang, ZHANG Xiaoquan, YANG Tiezhao, et al. Effects of harvesting maturity on enzymatic browning reaction parameters of tobacco leaves during curing [J]. Acta botanica boreali-occidentalia sinica, 2014, 34(12): 2459-2466.
[5] 舒启琼,罗小波,李飞,等. 马铃薯抗寒研究进展[J]. 植物生理学报, 2021, 57(6):1171-1178.
SHU Qiqiong, LUO Xiaobo, LI Fei, et al. Potato cold hardiness research progress[J]. Journal of plant physiology, 2021, 57(6): 1171-1178.
[6] Ladaniya M S. Physico-chemical, respiratory and fungicide residue changes in wax coated mandarin fruit stored at chilling temperature with intermittent warming[J]. Journal of Food Science & Technology, 2011, 48(2):150-158.
[7] 李静,李霞,陈翠松,等. GABA处理对双孢蘑菇活性氧代谢和膜脂过氧化的影响[J]. 食品工业科技,2019, 40(3):275-280.
LI Jing, LI Xia, CHEN Cuisong, et al. Effects of GABA treatment on active oxygen metabolism and membrane lipid peroxidation of[J]. Science and Technology of Food Industry, 2019, 40(3):275-280.
[8] 张玉,刘杨,王元英,等. 烤烟新品种中川208的选育及特征特性[J]. 中国烟草科学,2019,40(05):1-7.
ZHANG Yu, LIU Yang, WANG Yuanying, et al. Breeding and characteristics of a new flue-cured tobacco variety zhongchuan 208[J]. Chinese tobacco science,2019,40(05):1-7.
[9] 肖志君,裴晓东,邓小华,等. 南方稻作烟区不同品种上部烟叶烘烤特性差异[J]. 核农学报,2017,31(11):2213-2220.
XIAO Zhijun, PEI Xiaodong, DENG Xiaohua, et al. Journal of nuclear agricultural sciences,2017,31(11):2213-2220.
[10] 国家烟草专卖局. YC/T 311—2009 烤烟品种烘烤特性评价[S]. 北京:中国标准出版社,2009.
State Tobacco Monopoly Administration. YC/T 311—2009 Baking characteristics evaluation of flue-cured tobacco varieties[S]. Beijing: Standards Press of China, 2009.
[11] 郑小雨,李常军,路晓崇,等. 烤烟不同成熟期色素含量变化及其与叶绿体超微结构的关系探究[J]. 中国农业科技导报,2020, 22(10):60-68.
ZHENG Xiaoyu, LI Changjun, LU Xiaochong, et al. Changes of pigment content and its relationship with chloroplast ultrastructure in flue-cured tobacco at different maturity stages[J]. China"s agricultural science and technology leader, 2020, 22 (10) : 60-68.
[12] 国家烟草专卖局. 烟草及烟草制品多元酸的气相色谱法:YC/ T288—2009[S]. 北京:中国标准出版社,2009.
State Tobacco Monopoly Administration. Determination of polyacids in tobacco and tobacco products by gas chromatography: YC/T288—2009[S]. Beijing: Standards Press of China, 2009.
[13] XU Chuanjun,ZHENG Biyu,HUANG Junmei,et al. Genome- wide transcriptome and expression profile analysis of phalaenopsis during explant browning[J].PLOSONE,2015,10(4).
[14] LIUX,ZHANGA,SHANGJ,etal. Studyonbrowningmechanismoffresh-cuteggplant (L.) basedonmetabolomics, enzymaticassaysandgeneexpression[J].ScientificReports,2021,11(1).
[15] TANG T, XIE X, REN X,et al. A difference of enzymatic browning unrelated to PPO from physiology,targeted metabolomics and gene expression analysis in Fuji apples[J]. Postharvest Biology and Technology, 2020, 170:111323.
[16] WEI Chaoling, YANG Hua, WANG Songbo, et al. Draft genome sequence of Camellia sinensis var. sinensis provides insights into the evolution of the tea genome and tea quality.[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(18):E4151-E4158.
[17] 郭丹,韩英群,魏鑫,等. 鲜切苹果冷藏期间品质与褐变生理变化关系[J]. 河南农业科学,2020, 49(8):173-180.
GUO Dan, HAN Yingqun, WEI Xin, et al. Relationship between quality and physiological changes of fresh cut apple during cold storage[J]. Henan agricultural sciences, 2020, 49(8):173-180.
[18] 李京赞,刘玉德,石文天,等. 植物果蔬的褐变及抑制的研究[J]. 包装与食品机械,2019, 37(1):63-68.
LI Jingzan, LIU Yude, SHI Wentian, et al. Study on browning and inhibition of fruits and vegetables [J]. Packaging and food machinery, 2019, 37(1):63-68.
[19] HUANG Xiaozhen, ZHANG Yao, ZHANG Xiaoyan, et al. Long-chain base kinase1 affects freezing tolerance in[J]. Plant Science An International Journal of Experimental Plant Biology, 2017, 259:94.
[20] Christelle, Dutilleul, Heidy, et al. Evidence for ACD5 ceramide kinase activity involvement inresponse to cold stress[J]. Plant, Cell & Environment, 2015, 38(12):2688-2697.
[21] 赵颖颖,陈京京,金鹏,等. 低温预贮对冷藏桃果实冷害及能量水平的影响[J]. 食品科学,2012, 33(4):276-281.
ZHANG Yingying, CHEN Jingjing, JIN Peng, et al. Effects of prestorage at low temperature on chilling injury and energy level of frozen peach fruit [J]. Food science, 2012, 33(4):276-281.
[22] 张柳,王铮,张亚婕,等. 烟草叶片衰老期过程中的蛋白质组学分析[J]. 植物生理学报,2014, 50(4):488-500.
ZHANG Liu, WANG Zheng, ZHANG Yajie, et al. Proteomic analysis of leaf aging in tobacco[J]. Plant physiology journal, 2014, 50(4):488-500.
[23] 牛浩,段卫东,汪代斌,等. 采后烟叶颜色变化与能量代谢的关系[J]. 中国烟草学报,2021, 27(4):51-58.
NIU Hao, DUAN Weidong, WANG Daibin, et al. Study on the relationship between energy metabolism and color change of tobacco leaves after harvest[J]. Acta Tabacaria Sinica, 201, 27(4):51-58.
[24] 杨绿竹,王馨雨,王蓉蓉,等. 柑橘果皮角质层及其对采后贮藏保鲜影响的研究进展[J]. 食品科学, 2020, 41(7):234-244.
YANG Lvzhu, WANG Xinyu, WANG Rongrong, et al. Advances in studies on cuticle of citrus peel and its effects on storage and preservation after harvest [J]. Food Science, 2020, 41(7):234-244.
[25] 张婧,陈梦词,马清,等. 植物ABCG转运蛋白研究进展[J]. 草业学报,2015, 24(7): 180-188.
ZHANG Jing, CHEN Mengci, MA Qing, et al. Research progress of ABCG transporter in plants [J]. Acta prataculturae sinica, 2015, 24(7): 180-188.
[26] 陈伟,刘德春,杨莉,等. 植物表皮蜡质及相关基因研究进展[J]. 植物生理学报,2016, 52(8):1117-1127.
CHEN Wei, LIU Dechun, YANG Li, et al. Research progress of plant epidermal wax and related genes [J]. Plant physiology journal, 2016, 52(8):1117-1127.
[27] 罗子敬,孙宇涵,卢楠,等. 杨树耐盐机制及转基因研究进展[J]. 核农学报,2017, 31(3):482-492.
LUO Zijing, SUN Yuhan, LU Nan, et al. Progress in poplar salt tolerance mechanism and transgenic studies [J]. Journal of nuclear agricultural sciences,2017,31(3):482-492.
[28] 段瑞君,王爱东,陈国雄. 植物角质层基因研究进展[J]. 植物学报,2017, 52(5):637-651.
DUAN Ruijun, WANG Aidong, CHEN Guoxiong. Research progress in plant cuticle genes[J]. Chinese journal of botany,2017,52(5):637-651.
[29] 刘美兰,华园榕,龙洪旭,等. 油桐乙醛脱氢酶基因ALDH2B4和ALDH2B7的克隆与表达分析[J]. 植物生理学报,2017, 53(8): 1459-1467.
LIU Meilan, HUA Yuanrong, LONG Hongxu, et al. Cloning and expression analysis of acetaldehyde dehydrogenase geneandfrom[J]. Journal of plant physiology,2017,53(8):1459-1467.
[30] 李晓佩,王思宁,史晶晶,等. 植物表皮蜡质合成及调控因子WIN/SHN的研究进展[J]. 生物技术通报,2020, 36(12):129-136.
LI Xiaopei, WANG Sining, SHI Jingjing, et al. Plant epidermal wax synthesis and regulatory factor WIN/SHN research progress[J]. Biotechnology Bulletin, 2019, 36(12):129-136.
[31] 胡位荣,刘顺枝,张昭其,等. 荔枝果实采后脂氧合酶活性的变化[J]. 华中农业大学学报,2005(3):285-289.
HU Weirong, LIU Shunzhi, ZHANG Zhaoqi, et al. Changes of lipoxygenase activity in litchi fruit after harvest[J]. Journal of Huazhong Agricultural University, 2005(3):285-289.
[32] 张敏,顾勇,张永辉,等. 四川不同产区烟叶脂氧合酶活性及基因表达水平的差异[J]. 贵州农业科学,2017, 45(8):9-12.
ZHANG Min, GU Yong, ZHANG Yonghui, et al. Differences in lipoxygenase activity and gene expression levels in tobacco leaves from different producing areas in Sichuan[J]. Guizhou Agricultural Sciences, 2017, 45(8): 9-12.
Study on the relationship between lipid metabolism and browning of upper tobacco leaves
SUN Haoyue1, LI Wengang2, YU Shikang3, WU Deyang4, CHEN Hanfa4, YANG Jie3, SONG Zhaopeng1, JIA Hongfang1, XIE Liangwen2*
1 College of Tobacco, Henan Agricultural University, Zhengzhou 450000, China;2 Sichuan Tobacco Company, Chengdu 610000, China;3 Guangyuan Tobacco Company of Sichuan Province, Guangyuan 628000, Sichuan, China;4 Liangshan Tobacco Company of Sichuan Province, Xichang 615000, China
[Background and Objective]This study aims to clarify the effects of lipid metabolism in upper leaves of flue-cured tobacco on leaf browning.In this study, the relationship between lipid oxidation and Browning of the upper leaves of Yunyan 87 and Zhongchuan 208 were systematically studied by means of transcriptomics, transmission electron microscopy, scanning electron microscopy and real-time quantitative PCR(RT-PCR) in cell biology and molecular level.(1) Compared with Yunyan 87 tobacco leaves, Zhongchuan 208 tobacco leaves were browning faster, and the time for leaves to become 50% brown was shorter, and the browning reaction was more intense; Further transcriptomic GO analysis and KEGG enrichment analysis showed that the differential genes in the upper leaves of Zhongchuan 208 were enriched in lipid metabolism (linolenic acid and linoleic acid metabolism), suggesting that lipid metabolism was closely related to the browning of the upper leaves. (2)The cuticle was significantly thickened, the broken wax layer and thin slices were obviously increased in Zhongchuan 208 tobacco leaves. The total fatty acid content, linolenic acid content, and lipoxygenase (LOX) enzyme activity were significantly higher than those of the control, indicating that the lipid metabolism of easy-browning tobacco leaves is relatively vigorous and lipid oxidation is prone to occur. (3) The lipid metabolism genes,,,were screened out from the obtained differentially expressed genes, the expression of which were up-regulated in Zhongchuan 208 tobacco leaves according to qRT-PCR analysis. Among them, the expression ofa key gene of lipid oxidation, was up-regulated by 2.27 times.Compared with the upper leaves of Yunyan 87, the browning reaction of the upper leaves of Zhongchuan 208 is more intense, and the fatty acid metabolism in the tobacco leaves is more vigorous and the lipids are more susceptible to oxidation reactions. The results indicate that lipid oxidation caused by fatty acid metabolism is an important factor for the browning of Zhongchuan 208 tobacco leaves.
upper tobacco leaves; lipid metabolism; browning; transcriptomics
四川省烟草公司科技重点项目“提升上部叶烘烤质量的关键技术研究与应用”(NO:SCYC202116)
孙皓月(1998—),硕士研究生,主要研究方向:烟草调制与加工,Email:sally_sun.zz@foxmail.com
谢良文(1979—),高级农艺师,主要从事技术管理与烟叶生产技术方面研究,Email:652814038@qq.
20021-12-15;
2022-04-07
Corresponding author. Email:652814038@qq.com
孙皓月,李文刚,俞世康,等. 上部叶脂质代谢与烟叶褐变的关系研究[J]. 中国烟草学报,2022,28(4). SUN Haoyue, LI Wengang, YU Shikang, et al. Study on the relationship between lipid metabolism and browning of upper tobacco leaves[J]. Acta Tabacaria Sinica, 2022, 28(4). doi:10.16472/j.chinatobacco.2021.T0232
猜你喜欢 蜡质中川褐变 外源乙烯处理对黄冠梨果皮褐变和货架期品质的影响农业工程学报(2022年6期)2022-06-27三种李果皮蜡质的结构与成分比较核农学报(2022年6期)2022-05-20果实蜡质的研究进展辽宁农业科学(2021年6期)2021-12-02闭排罐新式在线清洗技术研究和应用科学与财富(2021年31期)2021-03-08糜子叶片表皮蜡质的组分及晶体结构分析干旱地区农业研究(2020年6期)2020-02-0310个山东主栽石榴品种果实褐变及其相关酶活性比较山东农业科学(2016年11期)2016-12-17影响牡丹石榴外植体褐变的因素分析江苏农业科学(2016年9期)2016-11-28中川美術館秘蔵·中国の硯人民中国(日文版)(2015年10期)2015-04-16中川美術館秘蔵·中国の硯人民中国(日文版)(2015年9期)2015-03-20苹果酒的生产工艺研究热带农业工程(2014年1期)2014-08-19