康新玥,魏敏,江森,王欢,郭学武,2,肖冬光,2,武晓乐,2,陈叶福,2*
1(天津科技大学 生物工程学院,天津,300457)2(工业发酵微生物教育部重点实验室(天津科技大学),天津,300457)
GB/T 13662—2018《黄酒》中定义黄酒是以稻米、黍米、小米、玉米、小麦、水等为主要原料,经加曲和/或部分酶制剂、酵母等糖化发酵剂酿制而成的发酵酒。黄酒酒度较低,酒体醇香,富含蛋白质、氨基酸等多种有益人体健康的物质,深受消费者喜爱[1]。近年来,随着消费水平的提高,消费者不仅关注风味口感,还越来越关注健康,而黄酒中的高级醇含量在发酵酒中较高,是限制黄酒行业发展的制约性因素之一[2]。黄酒中的高级醇主要包括异戊醇、异丁醇、正丙醇、苯乙醇等。适量的高级醇赋予黄酒以醇厚感,但是高级醇含量过高不仅影响其风味口感,而且会对人体产生不适感甚至毒害作用,使饮用者饮后易醉、易晕眩且不利人体健康,其含量过低也会导致黄酒风味寡淡,酒体不丰盈[3-6]。因此,调控黄酒中的高级醇含量对于黄酒行业的发展意义重大。
目前研究表明,黄酒等发酵酒中的高级醇主要由酿酒酵母代谢产生,其生成途径主要是氨基酸分解代谢途径和糖代谢途径。在酿酒酵母中降低脱羧酶(PDC酶系)、醇脱氢酶(ADH酶系)的活性同时提高醛脱氢酶(ADL酶系)的活性,可以达到降低高级醇生成量的目的。乙醛脱氢酶属于酿酒酵母丙酮酸脱氢酶旁路(pyruvate dehydrogenase bypass,PDB)中的酶,氧化乙醛生成乙酸[7]。本实验室前期研究表明过表达乙醛脱氢酶基因ALD6可降低52.8%的高级醇,但ALD6基因的过表达也提高了酵母的乙酸生成量(为出发菌株的3.6倍),这在一定程度上影响了酵母的生长和发酵性能,且乙酸含量过高会对酒体协调性产生不利影响[8]。
常用的启动子主要有组成型和诱导型2种,组成型启动子大多为强启动子,某些基因不需要过强的表达量,否则会导致产物毒性或代谢负担,对生长代谢有负面影响[9]。诱导型启动子则是在特定培养条件下才有诱导基因表达的能力,可以通过调节诱导条件来掌控基因表达的水平,Phxts是受葡萄糖浓度诱导的HXT系列启动子,对不同浓度葡萄糖的响应程度及亲和力存在差异[10],可达到根据不同糖浓度动态调控ALD6基因表达的目的。黄酒发酵是双边发酵,发酵过程中的糖浓度是动态变化的,因此,本研究采用动态调控策略[11-12],选用6种HXT系列的糖诱导型启动子(Phxt1、Phxt2、Phxt3、Phxt4、Phxt5、Phxt7)过表达ALD6基因构建重组菌株,在具有降低高级醇效果的同时,降低其对酵母生长和发酵产生的不利影响,为生产舒适健康的黄酒提供思路。
1.1 材料与试剂
1.1.1 菌株与质粒
本研究所用菌株与质粒见表1。
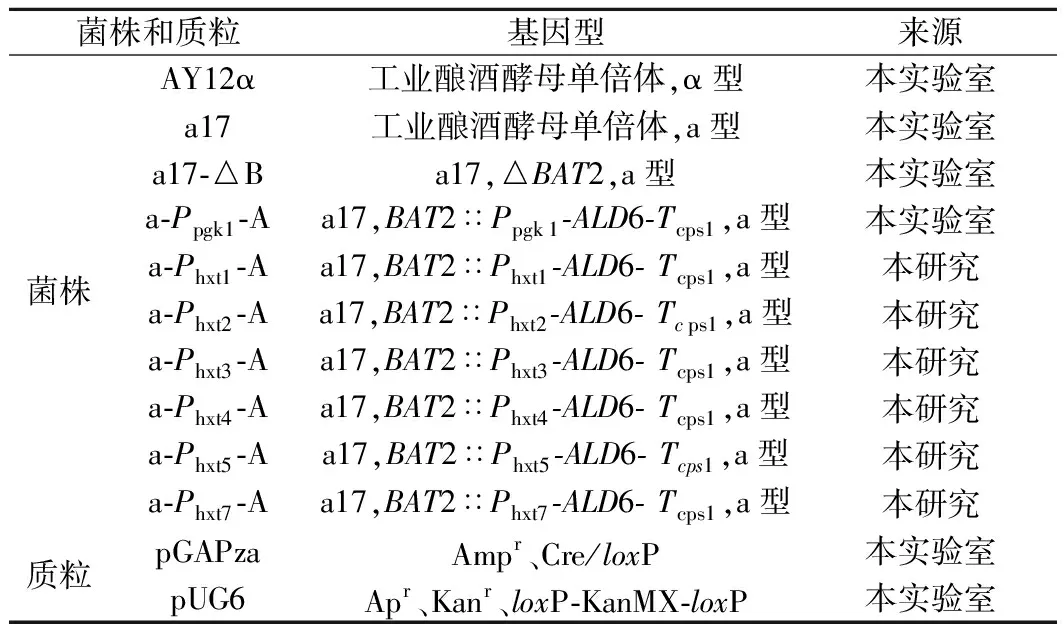
表1 菌株和质粒Table 1 Strains and plasmids
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract-peptone-dextrose,YEPD)培养基(g/L):酵母浸粉10、蛋白胨20、葡萄糖20,115 ℃,灭菌20 min。
LB培养基(g/L):酵母浸粉5、蛋白胨10、NaCl 10,121 ℃,灭菌20 min。
半乳糖诱导培养基(g/L):半乳糖10,蛋白胨20,酵母浸粉10,121 ℃,灭菌20 min。
一级种子培养基(g/L):将玉米糖化清液糖度调至8° Bx,酵母浸粉5。
二级种子培养基(g/L):将玉米糖化清液糖度调至12° Bx,酵母浸粉5。
1.2 仪器与设备
22331Harmburg型PCR扩增仪,德国Eppendorf公司;
PowerPacTM型电泳仪,美国Bio-Rad公司;
Bioscreen全自动凝胶成像仪,上海谓载商贸发展有限公司;
7890A型气相色谱、1100型高效液相色谱,安捷伦科技;
StepOne实时荧光定量PCR,美国AB公司。
1.3 实验方法
1.3.1 重组菌株的构建
根据美国国家生物信息中心(National Center of Biotechnology Information,NCBI)报道的酿酒酵母的基因序列使用Primer 5.0软件设计PCR引物,用于构建重组菌株及验证。通过查阅文献及在NCBI上确定诱导型启动子的序列用于构建不同启动子过表达ALD6基因的重组菌株。引物序列见表2。

表2 PCR引物Table 2 PCR primers

续表2
本实验在前期改造菌株a-Ppgk1-ALD6的基础上更换诱导型启动子,以诱导型启动子Phxt3为例说明用启动子Phxt3过表达ALD6基因构建重组菌株a-Phxt3-A的过程,实验均以a-Ppgk1-ALD6(该菌株在BAT2位点过表达ALD6基因,其中启动子为Ppgk1,终止子为Tcps1)基因组为模板,分别使用引物对B3-U/D、A3-U/D和P3-U/D进行PCR扩增,获得上同源臂BA、ALD6-Tcps1-BB和启动子Phxt3片段;
以质粒PUG6为模板,使用引物K3-U/D进行PCR扩增,得到KanMX片段。通过醋酸锂转化法将BA,ALD6-Tcps1-BB,Phxt3,KanMX片段全部导入酵母细胞,酵母自身通过胞内DNA assembly实现多片段的组装,并由同源臂介导的同源重组将目的基因表达整合到过表达位点[13],同源重组过程如图1所示。
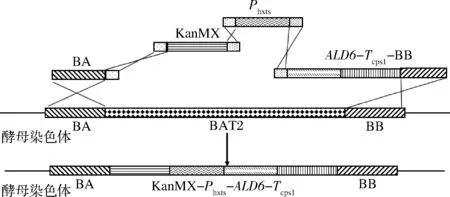
图1 Phxts启动子过表达ALD6酿酒酵母菌株同源重组过程Fig.1 Homologous recombination process of overexpression ALD6 with Phxts promoter in Saccharomyces cerevisiae
在含有300 μg/mL G418抗性的YEPD培养基上筛选重组菌株。以提取重组菌株的基因组DNA为模板,以菌株a-Ppgk1-ALD6基因组为阴性对照,用验证引物YZ-BAT2-U/D、YC-U/YA-D、H3-U/D对转化子进行验证。其余菌株验证引物前2对均与举例引物相同,第3对引物为对应序号标记验证引物。
通过醋酸锂转化法将pGAPza质粒导入重组菌株,挑取转化子于半乳糖培养基中培养12 h,稀释涂布于YEPD培养基。将长出的单菌落在YEPD培养基和含300 μg/mL G418抗性的YEPD培养基进行点板,挑出在G418抗性培养基上不生长而在YEPD培养基上生长的菌株,提取其基因组进行PCR验证。若以该基因组为模板PCR扩增KanMX片段,不能得到1 600 bp左右的条带,而以转化前重组菌株的基因组为模板能扩增得到该基因片段,即说明菌株成功去除KanMX筛选标记。
1.3.2 过表达基因转录水平测定
将酵母接种于5 mL YEPD液体试管,180 r/min、30 ℃培养12 h,然后取500 μL转接于5 mL YEPD液体试管,相同条件培养4 h后,采用由TaKaRa公司提供的试剂盒Yeast Processing Reagent (for total RNA preparation) Code No.9089,按操作说明书收集菌体、提取总RNA;
然后进行RNA逆转录、去除DNA;
最后采用仪器Applied Biosystems 7300/7500 Real Time PCR System,以UBC6基因为内参基因进行Real Time PCR实验,测定待测菌株的mRNA水平。本实验RNA的逆转录、去除DNA以及Real Time PCR实验所用试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)由TaKaRa公司提供[14]。
1.3.3 生长曲线测定
首先用接种环在斜面刮取一环酵母菌株于5 mL YEPD液体培养基试管中,180 r/min,30 ℃,培养12 h。振荡混匀菌液后,分别取10、20、30和40 μL菌液转入含有1 mL液体YEPD的EP管中。然后取300 μL加入100孔深孔板,取300 μL YEPD液体培养基做空白对照,30 ℃培养24 h,之后每隔0.5 h测其在600 nm处的吸光度值。以培养时间为横轴,OD600为纵轴,绘制菌株的生长曲线。
1.3.4 发酵实验
发酵种子液培养:取酵母菌接种到装有5 mL一级种子培养基的试管,30 ℃静置24 h,然后将其全部接入含有45 mL二级种子培养基的150 mL三角瓶,30 ℃静置20 h。
大米清液制备:
大米→蒸煮→液化→糖化→过滤灭菌→接菌发酵
操作要点:大米蒸煮后加3 000 mL蒸馏水、耐高温α-淀粉酶500 μL、麦曲150 g,70 ℃水浴90 min。糖化酶500 μL,60 ℃水浴8 h,过滤得大米糖化清液。每瓶142 mL分装至250 mL三角瓶。按种子培养的方法培养酵母种子液,然后接种7.5 mL菌液于上述瓶中密封发酵。
传统黄酒发酵工艺流程[4]:
大米→蒸煮→摊晾→拌曲→接菌→补水发酵
操作要点:大米和水按质量比1∶1蒸煮0.5 h。摊晾冷却1 h。大曲的用量为大米的15%(质量分数),拌匀装入500 mL三角瓶。接菌700万个/g,米和水按质量比1∶1补加水,混匀密封,30 ℃发酵7 d。
1.3.5 检测方法
按照GB/T 13662—2018《黄酒》中斐林试剂法测定还原糖,酒精计比重法[15]测定酒精度,根据称重确定CO2排放量。
采用高效液相色谱法测定发酵液中乙酸含量[7]:Aminex HPX-87H色谱柱,柱温60 ℃,进样量10 μL,流动相为5 mmol/L H2SO4,流速0.6 mL/min,检测器为示差折光检测器。
采用气相色谱法测定馏出液高级醇的生成量[16]:气相色谱仪Agilent 7890C,进样口温度200 ℃,检测器温度200 ℃。进样量1 μL,分流比10∶1。载气为高纯度N2,流速2.0 mL/min。起始柱温50 ℃,保持8 min,再以5 ℃/min的升温速度升温至120 ℃,保持5 min。
2.1 糖诱导型启动子过表达ALD6基因酿酒酵母的构建
2.1.1ALD6基因过表达菌株的构建与验证
利用6种HXT系列糖诱导型启动子Phxt1、Phxt2、Phxt3、Phxt4、Phxt5和Phxt7构建过表达ALD6的重组菌株a-Phxt1-A,a-Phxt2-A,a-Phxt3-A,a-Phxt4-A,a-Phxt5-A和a-Phxt7-A,挑选转化子进行PCR验证。以a-Phxt3-A菌株的构建为例,构建过程如1.3.1所述,对重组菌株a-Phxt3-A的验证结果如图2所示。用引物YZ-BAT2-U/D、YC-U/YA-D、H3-U/D对转化子进行验证,上游验证引物YZ-BAT2-U/D,得到2 694 bp的条带;
中游验证引物H3-U/D,得到3 430 bp的条带;
下游验证引物YC-U/YA-D,得到1 691 bp的条带,对照均无条带。由图2可知,PCR验证结果与预期一致,说明菌株构建成功。之后通过1.3.1的方法去除重组菌株KanMX抗性标记。
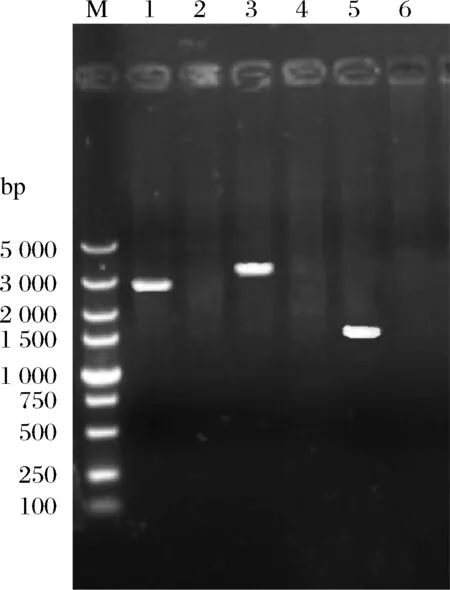
图2 重组菌株a-Phxt3-A的PCR定点验证Fig.2 PCR verification of the recombinant strain a-Phxt3-A注:M:DL5 000 bp Marker;
泳道1、3和5分别为重组菌株a-Phxt3-A的上、中和下游验证,泳道2、4和6为其阴性对照
2.1.2 基因表达水平的测定
按照1.3.2对ALD6基因表达量进行定量分析,结果如图3所示。
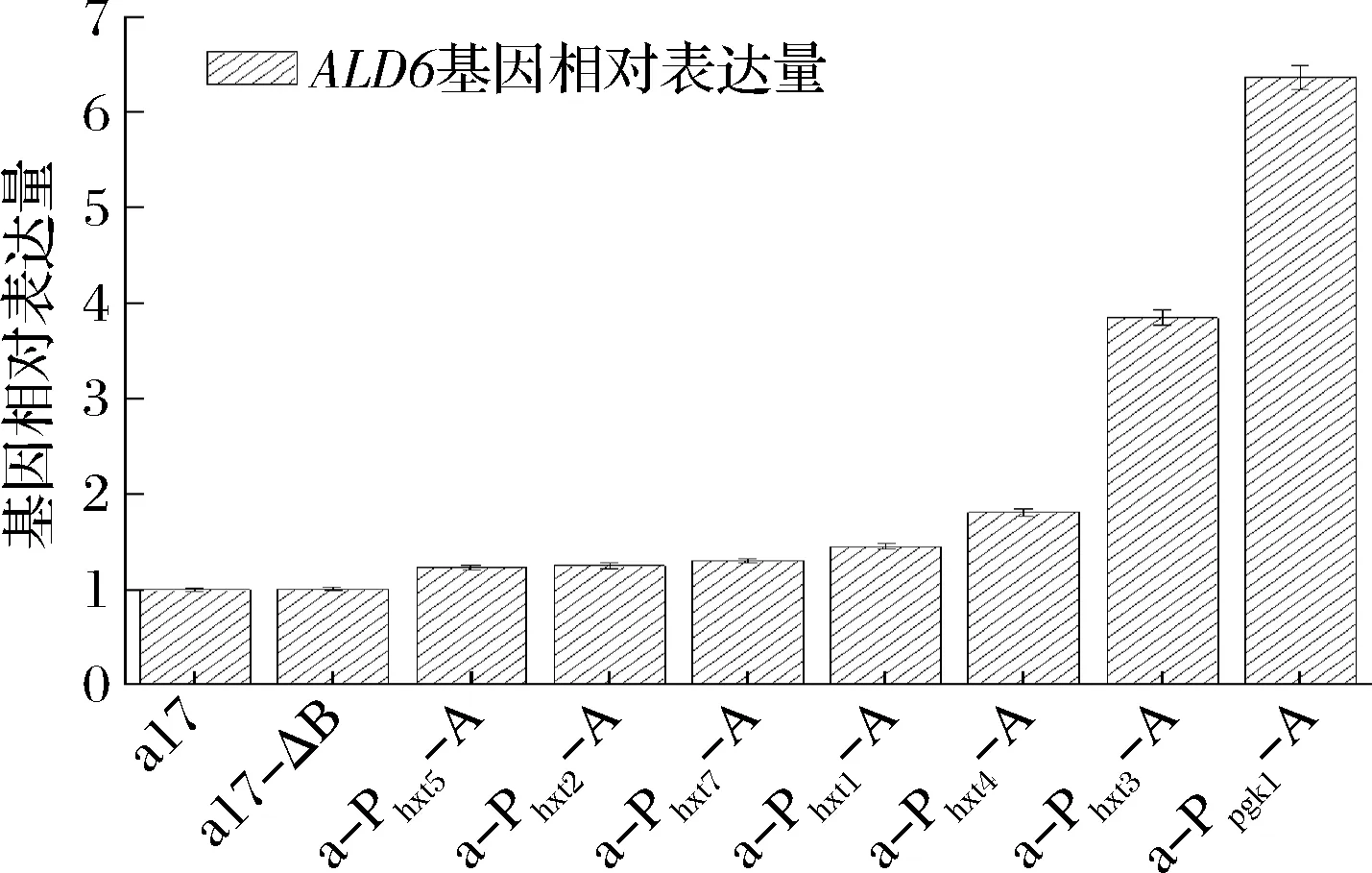
图3 出发菌株和重组菌株的ALD6基因表达量结果Fig.3 Result of ALD6 expression level in the original and recombinant strains
其中a-Ppgk1-A、a-Phxt3-A、a-Phxt4-A、a-Phxt1-A、a-Phxt7-A、a-Phxt2-A和a-Phxt5-A中ALD6基因表达量分别是出发菌株的6.37、3.85、1.81、1.45、1.3、1.25、1.22和1.05倍,诱导型启动子Phxt3对ALD6基因的表达产生的效果仅次于组成型强启动子Ppgk1。本实验使用普通YEPD培养基作为培养条件(葡萄糖浓度在20 g/L左右),若改变培养基条件,糖诱导型启动子调控ALD6基因表达的强度可能也会改变。因此图3中的ALD6基因的相对表达量仅能证明诱导型启动子过表达ALD6基因重组菌株构建成功。
2.2 出发菌株和重组菌株的生长性能
2.2.1 YEPD培养基条件下的生长曲线
按照材料与方法1.3.3测定各菌株在YEPD培养基中的生长曲线,结果如图4所示,相较于出发菌,过表达ALD6的重组菌株生长对数期的生长速率和稳定期时的生物量均略低,说明过表达ALD6基因可能影响酵母生长。而采用诱导型启动子过表达ALD6菌株的生长性能比a-Ppgk1-A稍好,这表明诱导型启动子的强度弱于组成型启动子Ppgk1,其调控ALD6表达对酵母的生长性能影响相对较小。此条件下的生长曲线可说明糖诱导型启动子Phxts在YEPD培养基的条件下表达强度弱于组成型启动子Ppgk1,由于Phxts启动子对葡萄糖浓度的响应强度不同,此培养条件与黄酒发酵条件下的糖浓度有很大差别,故后续采用大米清液体系测定各菌株生长性能。
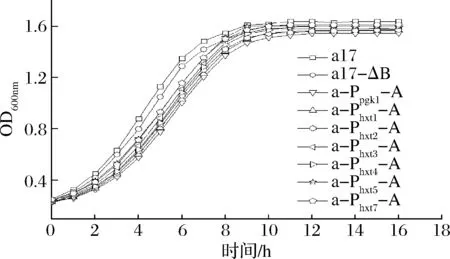
图4 出发菌株和重组菌株的生长曲线Fig.4 Growth curve of the original and recombinant strains
2.2.2 大米清液体系中的生长性能
传统黄酒发酵属于半固态发酵,无法直接测定发酵过程中各菌株的生长性能,为测定在黄酒发酵条件中各菌株的生长性能,按1.3.4大米清液体系模拟传统黄酒发酵体系,调节初始葡萄糖浓度70 g/L左右,发酵时每隔2 h取样检测600 nm处吸光度,以OD600值来衡量菌株在大米清液体系中的生长性能。由图5可知,过表达ALD6基因的重组菌株在0~12 h的生长速率均低于出发菌株,说明过表达ALD6基因影响酵母生长。最终重组菌株a-Ppgk1-A生物量显著低于其余菌株,a-Phxt1-A略低于出发菌,但重组菌株a-Phxt2-A、a-Phxt3-A、a-Phxt4-A、a-Phxt5-A和a-Phxt7-A最终生物量与出发菌株没有显著差异,再次验证了在大米清液体系中,采用诱导型启动子(Phxt2、Phxt3、Phxt4、Phxt5、Phxt7)调控ALD6基因的过表达可相对减弱其对酵母生长性能的影响。
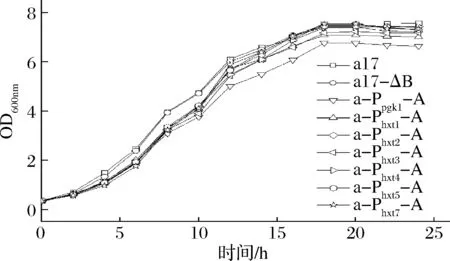
图5 出发菌株和重组菌株在大米清液体系中的生长曲线Fig.5 Growth curve of the original and recombinant strains in supernatant of rice wine fermentation
2.3 出发菌株和重组菌株的发酵性能
将出发菌株a17和重组菌株a17-△B、a-Ppgk1-A、a-Phxt1-A,a-Phxt2-A,a-Phxt3-A,a-Phxt4-A,a-Phxt5-A和a-Phxt7-A按照1.3.4的方法进行传统黄酒发酵,发酵结束后测定各菌株的CO2排放量、酒精度和发酵液中还原糖剩余量。如表3所示,采用诱导型启动子Phxts过表达ALD6基因的菌株还原糖余量相较于出发菌稍高,但低于重组菌株a-Ppgk1-A,且对酒精生成量和CO2排放量几乎没有影响。而重组菌株a-Ppgk1-A还原糖余量最高,CO2排放量和酒精度均低于出发菌和其他重组菌株,说明组成型启动子Ppgk1过表达ALD6基因对菌株发酵性能影响最大,与本实验室前期研究结果一致。综上所述,过表达ALD6基因对酵母发酵性能会产生影响,但采用诱导型启动子过表达ALD6基因可相对改善这一现象。
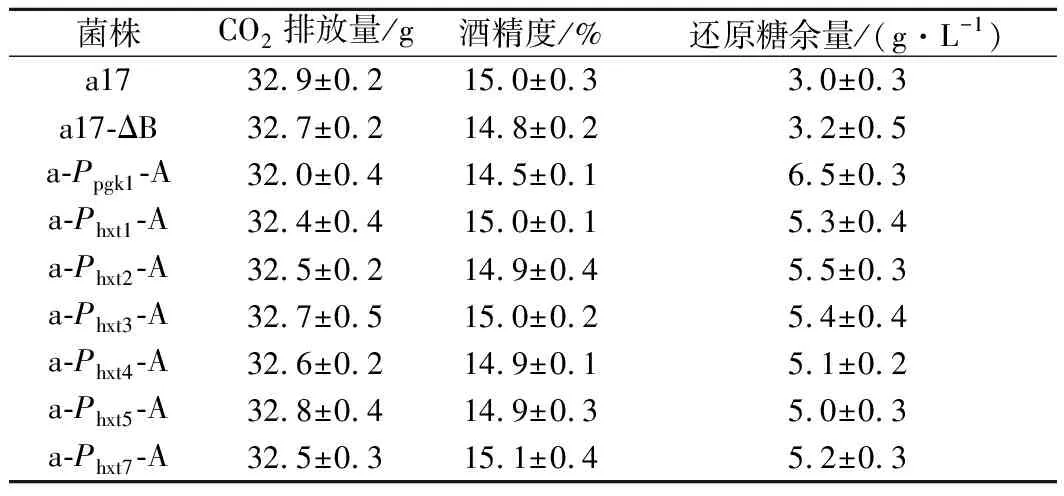
表3 出发菌株和重组菌株基本发酵性能的比较Table 3 Fermentation performances of the original and recombinant strains
2.4 出发菌株和重组菌株的乙酸和高级醇生成量
2.4.1 出发菌株和重组菌株的乙酸生成量
乙醛脱氢酶氧化乙醛产生乙酸,本研究检测了传统黄酒发酵条件下所得发酵液中乙酸的生成量(图6)。重组菌株a-Phxt5-A、a-Phxt2-A、a-Phxt7-A、a-Phxt1-A、a-Phxt4-A、a-Phxt3-A和a-Ppgk1-A的乙酸生成量分别是出发菌株a17的1.24、1.29、1.4、2、2.88、3和4.44倍。其中重组菌株a-Ppgk1-A的乙酸生成量最高,达到1.11 g/L,表明在传统黄酒发酵体系中,组成型强启动子Ppgk1调控ALD6基因表达的强度要高于糖诱导型启动子Phxts,在糖诱导型启动子中,重组菌株a-Phxt3-A乙酸生成量最高,达到0.75 g/L。从乙酸的生成量可大致说明在此传统黄酒发酵体系中糖诱导型启动子调控ALD6基因表达的强度为Phxt3>Phxt4>Phxt1>Phxt7>Phxt2>Phxt5,与2.1.2以YEPD培养基为培养条件时,基因表达水平测定结果基本一致,调控ALD6基因表达水平越高,则乙酸生成量也越高。

图6 出发菌株和重组菌株的乙酸生成量Fig.6 Acetic acid production of the original and recombinant strains
综上,当乙酸含量较高时,对酵母生长性能产生不利影响,通过诱导型启动子调控ALD6基因的表达,可相应调节乙酸产量,进而降低对酵母生长的影响。原因可能是乙酸的上升,酵母细胞不能维持胞质膜电位平衡,导致细胞酸化,影响细胞代谢[17]。
2.4.2 出发菌株和重组菌株的高级醇生成量
按照传统发酵工艺发酵结束后,测定出发菌株和重组菌株馏出液中高级醇的生成量,如图7所示。与出发菌株a17相比,重组菌株的高级醇产量均有所下降。其中a-Ppgk1-A、a-Phxt3-A、a-Phxt4-A、a-Phxt7-A、a-Phxt1-A、a-Phxt2-A、a-Phxt5-A和a17-ΔB总高级醇分别下降52.36%、42.56%、37.84%、30.74%、22.29%、19.26%、16.72%和11.48%。重组菌株a-Ppgk1-A高级醇产量降低最多,苯乙醇、异戊醇、异丁醇、正丙醇分别降低45.67%、56.16%、48.55%、52.41%,总高级醇由592.31下降到280.65 mg/L。重组菌株a-Phxt3-A次之,苯乙醇、异戊醇、异丁醇、正丙醇分别降低37.03%、45.45%、38.69%、41.63%,总高级醇由592.31下降到340.47 mg/L。与诱导型启动子Phxts相比,强启动子Ppgk1过表达ALD6基因的菌株降低高级醇效果更为显著,可能因为黄酒发酵过程中诱导型启动子调控ALD6基因的表达不如组成型启动子稳定,或者其表达强度弱于组成型启动子[18]。
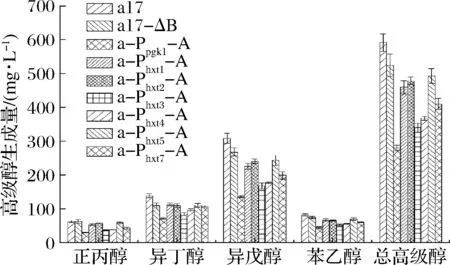
图7 出发菌株和重组菌株的高级醇生成量Fig.7 Higher alcohols production of the original and recombinant strains
在6种HXT系列糖诱导型启动子中Phxt3过表达ALD6基因的菌株降高级醇效果最显著,这是因为黄酒主发酵过程中葡萄糖质量浓度一般在25~75 g/L,Phxt3是中糖诱导的启动子,故此糖度有利于启动子Phxt3调控ALD6的表达[19]。Phxt4与Phxt7过表达ALD6菌株降低高级醇效果次之,这可能因为传统黄酒补水发酵的最初阶段发酵液中的葡萄糖浓度较低,在此阶段诱导了启动子Phxt4和Phxt7调控ALD6基因的表达,但随着原料的糖化发酵液中糖浓度提高,又抑制了其表达[20]。而Phxt2和Phxt5可能是因为其本身强度较弱使得ALD6基因表达相对较低,因此最后降低高级醇效果相对较弱。Phxt1过表达ALD6菌株降低高级醇效果最弱,这是因为启动子Phxt1最适糖质量浓度为90~130 g/L,黄酒发酵过程中无法达到该浓度[21]。
重组菌株高级醇生成量降低的原因可能是高级醇的前体物质醛类可以被乙醛脱氢酶氧化生成有机酸,故醛类还原产生高级醇有所减少[22-23]。结合图6、7,随着重组菌株乙酸的上升,高级醇生成随之降低,所以重组菌株高级醇降低的另一原因可能与其乙酸含量显著上升有关,高浓度乙酸抑制细胞代谢,影响了酵母的生长速率,因此,过表达ALD6可能是通过增加乙酸产量,抑制了酵母的生长性能,进而降低了高级醇含量。
本研究在酿酒酵母中选用6个HXT系列糖诱导型启动子Phxt1、Phxt2、Phxt3、Phxt4、Phxt5和Phxt7过表达乙醛脱氢酶基因ALD6构建6个重组菌株a-Phxt1-A、a-Phxt2-A、a-Phxt3-A、a-Phxt4-A、a-Phxt5-A、a-Phxt7-A,对比了其与实验室前期构建重组菌株a-Ppgk1-A、出发菌a17的生长和发酵性能、乙酸及高级醇生成量,过表达ALD6基因使酵母产乙酸增多,影响酵母的生长性能,但是糖诱导型启动子较Ppgk1可以适当减弱其对酵母产生的负面影响。同时,在传统黄酒发酵体系中重组菌株还原糖余量均高于出发菌株,Ppgk1过表达ALD6基因对菌株产酒精能力影响较显著,而Phxts几乎不影响菌株的发酵性能。与出发菌株a17相比,重组菌株的高级醇产量均有所下降,其中a-Ppgk1-A、a-Phxt3-A、a-Phxt4-A、a-Phxt7-A、a-Phxt1-A、a-Phxt2-A、a-Phxt5-A总高级醇分别下降52.36%、42.56%、37.84%、30.74%、22.29%、19.26%和16.72%。综上所述,诱导型启动子Phxt3过表达ALD6基因的重组菌株a-Phxt3-A降高级醇效果最好且对酵母生长和发酵性能的影响相对较小。本研究采用动态调控策略利用糖诱导型启动子初步解决了ALD6基因过表达对酵母生长和发酵的影响,后续还需要扩大发酵体系,优化发酵工艺进一步验证HXT系列糖诱导型启动子调控ALD6基因表达及其降高级醇的效果。
猜你喜欢 乙酸黄酒酵母 国家药监局关于联苯乙酸凝胶处方药转换为非处方药的公告(2021年第148号)中老年保健(2022年3期)2022-08-24乙醇和乙酸常见考点例忻中学生数理化·高一版(2022年4期)2022-05-09“乙酸”知识导视中学化学(2021年11期)2021-12-09李全锁:打造黄酒品牌 回馈父老乡亲今日农业(2021年6期)2021-06-09黄酒小记祝您健康·文摘版(2021年2期)2021-03-11冬季饮黄酒,花样喝法更营养家庭百事通·健康一点通(2021年1期)2021-02-24安琪酵母:全球第三、亚洲第一、两市唯一名人传记·财富人物(2017年9期)2017-11-02安琪酵母:全球第三、亚洲第一、两市唯一名人传记·财富人物(2017年9期)2017-11-02日本原装进口的健康食品Coco薇(2016年8期)2016-10-09液相色谱法测定糕点中脱氢乙酸不确定度评定食品界(2016年10期)2016-09-10