谢宇欣,姚 欢,邓 悦,石国庆
(遵义医科大学附属医院 消化内科,贵州 遵义 563099)
肝纤维化的发生机制非常复杂,研究发现Gremlin是肝纤维化促进因子,既往认为Gremlin是通过拮抗BMP/smads信号通路,促进肝星状细胞增值,抑制其凋亡,导致肝脏细胞外基质分泌增加,降解减少,从而诱导肝纤维化的发生和发展。近年来的研究表明,Gremlin是一种新型血管内皮细胞生长因子受体2(Vascular endothelial growth factor receptor 2,VEGFR2)激动剂,在内皮细胞中,Gremlin以独立于BMP的方式,与VEGFR2结合诱导其酪氨酸磷酸化及其下游活化,导致细胞增殖、迁移和形成血管生成芽,从而导致VEGFR2依赖性血管生成反应。因此,Gremlin参与肝纤维化发生的另一个机制可能与其激活VEGFR2途径介导的血管生成导致肝窦毛细血管化有关。本文通过四氯化碳(CCL4)诱导小鼠肝纤维化动物模型以及体外培养肝窦内皮细胞(Hepatic sinusoidal endothelial cell,HSEC)试验,研究Gremlin1通过激活VEGFR2途径促血管生成在肝纤维化发生机制中的作用。
1.1 实验动物 所用实验动物为SPF级的C57实验小鼠,体重在20~40 g(陆军军医大学动物中心:SCXK(渝)),实验前适应环境1周。
1.2 实验材料 Gremlin1 多克隆抗体(Abcam公司);
VEGFR2抗体(Cell Signaling 公司);
CD31抗体(Cell Signaling公司);
vWF 抗体(BOSTER公司)。鼠肝窦内皮细胞株购自中国典型培养物保藏中心,由本实验室常规传代保种。
1.3 方法
1.3.1 肝纤维化动物模型的建立 C57小鼠30只,按照随机数字表法,将其分为CCL4肝纤维化模型组(15只)和对照组(15只)。CCL4肝纤维化模型组腹腔注射1∶1 CCL4橄榄油溶液(10 mL/kg),2次/周,连续8周;
对照组仅给予腹腔注射橄榄油溶液(10mL/kg),2次/周,连续8周[5]。
1.3.2 天狼星红染色观察肝纤维化程度 小鼠肝组织石蜡包埋切片,二甲苯Ⅰ脱蜡10 min,二甲苯Ⅱ脱蜡10 min,100%乙醇吸取二甲苯5 min,95%乙醇7 min,80%乙醇8 min,75%乙醇9 min,PBS洗10 min,天狼星红染色1 h,流水冲洗10 min,苏木素染色10 min,流水冲洗3 min,100%乙醇数秒钟,中性树脂封固,倒置显微镜下观察肝脏汇管区胶原纤维沉积量及程度。
1.3.3 免疫组织化学法检测Gremlin1、VEGFR2、CD31及vWF蛋白的表达 小鼠肝组织石蜡包埋切片,免疫组化采用Envision法,具体参照操作说明书进行,用Image J图像分析仪分析。
1.3.4 Western blot检测Gremlin1、VEGFR2、vWF及CD31蛋白的表达 取小鼠肝组织剪碎,然后经匀浆、裂解和离心,提取蛋白质,再经电泳、转膜、封闭,滴加 Gremlin(1∶200)、VEGFR2(1∶1 000)、vWF (1∶1 000)、CD31(1∶1 000)、GAPDH(1∶5 000)一抗4 ℃孵育过夜,滴加二抗(1∶5 000)室温 1 h,ECL 曝光显影,用 Quantity One 灰度测定,GAPDH表达水平作为内参。
1.3.5 体外细胞株试验 培养鼠HSEC,用Gremlin1和SU1498进行干预。试验设对照组、Gremlin1(200 μg/L)组、Gremlin1(200 μg/L)+SU1498(700 μg/L)组,培养24 h,然后收集各组细胞,用Westernblot法检测vWF、CD31的蛋白质表达,用ECL曝光显影,用Quantity One灰度测定,GAPDH为内参。

2.1 肝纤维化模型建立成功 造模结束后经病理证实肝纤维化动物模型建立成功,天狼星红染色可以观察到肝纤维化的程度。经显微镜下观察,对照组小鼠肝小叶结构正常,无炎症表现,仅在汇管区血管壁观察到极少量胶原纤维(见图1A);
模型组小鼠可以观察到肝细胞水肿,而且有广泛肝细胞变性坏死,伴明显的炎症细胞浸润,可见较多胶原沉积,而且胶原纤维自汇管区向外延伸,并分割肝小叶形成假小叶(见图1B)。

A:正常;
B:肝纤维化;天狼星红染色,×20。
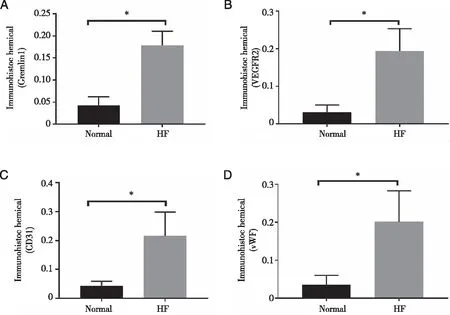
2.2 免疫组化检测Gremlin1、VEGFR2、CD31及vWF蛋白的表达情况 免疫组织化学结果表明,Gremlin1、VEGFR2、CD31及vWF的表达水平明显高于正常对照组(P<0.05,见图2~4)。

图2 Gremlin1、VEGFR2在正常小鼠肝组织和CCL4小鼠肝纤维化组织中的表达(免疫组织化学,×40)

图3 CD31、vWF在正常小鼠肝组织和CCL4小鼠肝纤维化组织中的表达(免疫组织化学,×40)
2.3 Western blot检测Gremlin1、VEGFR2、vWF及CD31蛋白的表达情况 Western blot法结果表明,在CCL4模型小鼠肝纤维化组织中,Gremlin1、VEGFR2、CD31及vWF表达较对照组明显上调(P<0.05,见图5)。
*:P<0.001。

图5 Gremlin1、VEGFR2、CD31及vWF蛋白表达
2.4 Gremlin1、VEGFR2、CD31及vWF蛋白表达的相关性 在CCL4模型小鼠肝纤维化组织中,Gremlin1与VEGFR2、CD31、vWF的表达呈正相关性(P<0.01,见图6)。

P<0.01,n=15。
2.5 Western blot检测Gremlin1及VEGFR2阻断剂SU1498对肝窦内皮细胞株 vWF及CD31蛋白表达的影响 分别用Gremlin1、Gremlin1+SU1498刺激鼠肝窦内皮细胞24 h后,与对照组相比,Gremlin1刺激组的CD31及vWF表达增强。与单用Gremlin1刺激组相比,Gremlin1+SU1498刺激组的CD31及vWF表达下调(P<0.05,见图7)。

图7 Gremlin1及VEGFR2阻断剂SU1498对肝窦内皮细胞株vWF及CD31蛋白表达的影响
肝脏在遭受各种致病因素的作用下,会出现肝细胞的变性、坏死等炎症过程,在慢性炎症过程中,由于细胞外基质的过多沉积,其结果是导致肝脏的纤维化形成,肝纤维化最终会逐渐发展为肝硬化。近年来的研究表明,肝纤维的发生除了细胞外基质沉积与降解失衡有关外,还与病理性的血管生成有关[7]。其中,肝窦毛细血管化被认为是肝纤维化和肝硬化以及门脉高压形成的解剖基础[8-10]。肝窦结构和功能的完整性是保证肝脏生理功能的基础,是肝脏的微循环,一旦肝窦毛细血管化形成,会导致肝血窦与实质细胞的交换功能障碍,是各种慢性肝病,尤其是肝纤维化、肝硬化和门脉高压的始动和加重因素,目前,对肝窦毛细血管化的发生机制以及药物干预仍在研究探索中。
Gremlin属于骨形态形成蛋白(Bone morphogenetic protein,BMP)拮抗剂,有Gremlin l、Gremlin 2和Gremlin 3 3种形式,它的主要生理功能是在人体胚胎发育过程中,可以通过调节BMP的活性,从而影响人体器官形成和各种组织的分化。近年来的研究表明,Gremlin参与了多种纤维化疾病的发生,如肾纤维化、肺纤维化、视网膜病变等,它参与纤维化发生的信号通路认为主要是通过调节TGF-β/Smad[11],以及拮抗BMP信号通路有关[12-13]。在肝脏中,Gremlin 1也被认为是肝纤维化的标志物,因为这种分泌蛋白在活化的肝星状细胞中高水平表达,并参与上皮间质转化(Epithelial-mesenchymal transition,EMT)。然而,越来越多的研究发现,Gremlin除了是BMP信号通路的拮抗剂以外,它还是一个新型的VEGFR2激动剂,它和VEGF一样,都属于胱氨酸结蛋白超家族成员,也就是说,它可以通过激活VEGFR2,进而激活其下游通路,从而促进血管生成,因此,与多种血管生成性疾病有关。譬如,Gremlin可以通过激活VEGFR2,进而激活MCP参与NF-KB途径的激活,从而参与肾脏炎症的调节[14-15]。研究认为Gremlin可能以不依赖BMP的方式,通过血管内皮生长因子受体2途径促进血管生成和炎症发生,这种血管生成和炎症反应能够被VEGFR2选择性抑制剂SU5416所抑制[16]。当然,在肝纤维化的发生和发展过程中,Gremlin可能即通过拮抗BMP信号通路增加细胞外基质沉积,同时也可能通过激活VEGFR2途径促血管生成而参与肝窦毛细血管化发生,二者贯穿肝纤维化、肝硬化及门脉高压的发生发展过程[17]。有学者证实Gremlin诱导了VEGFR2依赖性的磷酸化而调节生长因子介导的血管生成活性[18]。血小板内皮细胞粘附因子(CD31)和Ⅷ因子相关抗原(Von Willebrand factor,vWF)是连续性血管内皮细胞标志物,除了肝病变的肝窦毛细血管化外,正常情况下肝组织几乎不表达CD31和vWF[19]。而在我们的CCL4诱导小鼠肝纤维化动物模型中,除了Gremlin1、VEGFR2表达上调外,CD31及vWF的表达也增强,且它们之间呈正相关性。我们在细胞水平经Western blot 进一步证实,Gremlin1可以诱导肝窦内皮细胞CD31、vWF蛋白表达的增加(P<0.05),而且,VEGFR2阻断剂SU1498可以抑制Gremlin1对CD31、vWF表达的上调作用(P<0.05)。这些结果表明,Gremlin1可能通过激活VEGFR2信号通路参与了肝窦毛细血管化及肝纤维化的发生。
总之,本研究通过建立CCL4小鼠纤维化动物模型以及肝窦内皮细胞株试验,证实Gremlin1、VEGFR2与肝纤维化的发生发展密切相关,其机制与Gremlin1激活VEGFR2信号通路促血管生成,从而诱导肝窦毛细血管化的形成有关。因此,靶向Gremlin1-VEGFR2信号通路有可能成为肝纤维化治疗的新靶点。
猜你喜欢 毛细血管动物模型内皮细胞 有氧运动和精氨酸补充对高血压的干预作用及其与内皮细胞功能的关系体育科技文献通报(2022年4期)2022-10-21土槿皮乙酸对血管内皮细胞迁移和细胞骨架的影响世界科学技术-中医药现代化(2022年3期)2022-08-22糖尿病视网膜病变患者扩张型毛细血管的发生率、眼底影像学特征及其影响因素△眼科新进展(2022年6期)2022-06-2890锶-90钇敷贴器治疗单纯性毛细血管瘤的护理体会中国典型病例大全(2022年7期)2022-04-22溶酶体组织蛋白酶B增加自噬保护缺氧诱导的心脏微血管内皮细胞损伤中国药理学通报(2022年1期)2022-01-14HMGB1基因对高糖诱导的血管内皮细胞损伤的影响现代临床医学(2021年5期)2021-11-02类风湿关节炎动物模型研究进展风湿病与关节炎(2016年12期)2017-01-14膝关节滑膜炎动物模型的研究进展风湿病与关节炎(2016年11期)2016-12-23实验性高脂血症动物模型比较分析中国中药杂志(2016年20期)2016-11-19疏通“毛细血管”激活“神经末梢”中国火炬(2014年8期)2014-07-24