姜辅瑞纵 丹吴治洋张晓琳余进德 何承忠
(1.西南林业大学云南省高校林木遗传改良与繁育重点实验室,云南昆明 650233;
2.西南林业大学西南地区生物多样性保育国家林业和草原重点实验室,云南昆明 650233)
植物生长过程中,细胞壁可发生增厚、松弛、修饰、降解等,这些过程影响着植物生长发育和细胞分化、防御等[1],而细胞壁中纤维素、半纤维素、木质素等组分的变化也对植物生长发育以及应对胁迫等起到非常重要的作用[2]。尿苷二磷酸葡萄糖(UDPG)是细胞壁中纤维素、半纤维素、蔗糖的等物质合成与代谢的前体[3],而通过UDP-糖焦磷酸化酶催化生成UDPG是植物体中UDPG的主要合成途径之一[4]。现有研究结果表明,UDP-糖焦磷酸化酶家族中,在植物UDPG代谢中起主要作用的为UDP-葡萄糖焦磷酸化酶(UGPase)和UDP-糖焦磷酸化酶(USPase)2种酶[5]。UGPase和USPase均能够催化葡萄糖-1-磷酸(Glc-1-P)和UTP生成UDPG[6],但UGPase仅对葡萄糖-1-磷酸具有底物特异性,而USPase可利用其他单糖-1-磷酸作为底物[7]。在许多植物中均存在UGPase和USPase这2种酶,Sowokinos等[8]在马铃薯(Solanumtuberosum)中发现UGPase基因位点存在等位基因的差异,分别命名为ugpA和ugpB,研究发现该基因与马铃薯在低温条件下对甜味的产生有抵抗作用。在水稻(Oryza sativa)中存在2个UGPase基因成员(UGP1和UGP2),质 膜 上 的OsLecRK5磷 酸化UGP1,并促进其在胼胝质合成中的活性[9]。在沙梨(Pyrus pyrifolia)中也存在2个UGPase基因成员,被命名为UGPase PA和PC,可能在花粉特异性糖代谢或多糖中起作用[10]。在大肠杆菌中过表达美洲黑杨(Populusdeltoids)的PdUSPase可提高黄酮类糖苷缀合物的产量[11]。
滇 杨(Populus yunnanensis)是 杨 柳 科(Salicaceae)杨属(Populus)青杨派(SectTacamahaca)树种,又称云南白杨、攀枝树,是我国西南地区的特有树种,可生长于海拔1300~3200 m的地区,是我国稀有的低纬度高海拔杨树,具有适应能力强,易成活,生长迅速等优点[12]。滇杨可通过扦插的方式得到新的植株,且正、倒扦插均可成活,但观测发现倒扦插苗生长速率低于正扦插苗[13]。对滇杨正、倒扦插苗的幼叶和树皮进行转录组测序分析,发现叶片中有39个DEGs关联于USPase基因,且USPase基因在倒扦插苗中表现为下调[14]。在拟南芥中,USPase基因功能缺失突变使花粉缺乏果胶纤维内层,细胞质退化,完全破坏了雄性植株的生育能力[15],而AtUGP1和AtUGP2双突变体中,雄性植株不育但营养生长阶段的大小与野生型并无差异[16]。在灰树花(Grifolafrondosa)中,GfUGP启动子的沉默比保守序列具有更高的下调效率,且菌丝生长减缓[17]。此外,UGPase基因在植物的不同组织中存在表达量差异,水稻Ugp1基因在整个植株中均有表达,但在花药发育过程中尤其在花粉中表达量最高[18];
UGPase-A基因在杂交杨树(P.tremula×P.tremuloides)和美洲黑杨(P.deltoides)的成熟叶、茎和根中具有较高的表达量,而UGPase-B基因则在美洲黑杨的嫩叶和根中表达量较高[19-20]。滇杨正、倒扦插苗的生长势和生长量存在一定差异[13],但有关其PyUGPase和PyUSPase基因的组织特异性表达规律还未见报道。为此,本研究从前期组装的染色体水平滇杨基因组数据中提取PyUGPase-A、PyUGPase-B和PyUSPase基因序列,利用生物信息学软件和在线网站对滇杨PyUGPase-A、PyUGPase-B和PyUSPase基因编码蛋白进行预测和分析,同时以1年生滇杨正、倒扦插苗为材料,测量其主枝长度和主枝粗度,并对3个目标基因在茎尖、嫩叶、成熟叶、茎和根中表达量进行RT-qPCR分析,揭示Py-UGPase和PyUSPase基因在滇杨正、倒扦插苗中的组织特异性表达规律,从而为阐明PyUGPase和PyUSPase基因调控细胞壁合成进而调控滇杨生长的机制提供参考依据。
1.1 试验材料
以同属于杨属青杨派的毛果杨(P.tricho-carpa)UGPase-A、UGPase-B和USPase基因序列为参照,基于课题组前期测序并组装的染色体水平滇杨基因组数据,经过本地序列比对,提取获得滇杨PyUGPase-A、PyUGPase-B和PyUSPase基因序列。
从2019年春季扦插种植于相同环境条件下的滇杨3个无性系正、倒扦插苗中,每无性系正、倒扦插苗分别任选3株,于2020年8月采集茎尖(ST)、嫩叶(TL,顶端往下第2~3片)、成熟叶(ML,顶端往下第6~7片)、茎皮(SP)和根皮(RT),每无性系同类型3株苗木的相同组织样本混合为1份,共计30份样品,由液氮快速冷冻并研磨后放置于-80℃超低温冰箱保存备用。
1.2 PyUGPase-A、PyUGPase-B和PyUSPase基因的生物信息学分析
采用生物信息学软件和网站分别对PyUGPase-A、PyUGPase-B和PyUSPase基 因 编 码 蛋白的氨基酸组成、理化性质、保守结构域、跨膜结构域、亲水性/疏水性、亚细胞定位、信号肽、蛋白结构、同源性以及系统进化树的构建等方面进行预测和分析。具体软件和网站信息见表1。

表1 在线分析工具的名称和网站Table1 Online analysis toolsname and URL
1.3 苗木生长量统计
于2020年10月,使用卷尺和游标卡尺对8月份采样的正、倒扦插苗主枝长度和主枝粗度进行测量,主枝粗度测量部位距离基部2 cm处。正、倒扦插苗各测量9株,同一无性系相同类型3株苗木的数值平均值作为1个生物学重复代表值。
1.4 PyUGPase-A、PyUGPase-B和PyUSPase基因在不同组织中的表达
1.4.1 总RNA提取与cDNA合成
采用OMEGA植物RNA试剂盒(R6827-01)对正、倒扦插苗不同组织样品进行总RNA的提取。使用Thermo NanoDrop 2000微量紫外分光光度计进行RNA浓度和纯度测定。应用北京天根公司的试剂盒Fast King RT Kit(KR116)对不同组织总RNA进行反转录,并合成cDNA第1条链。
1.4.2 目的基因引物设计
以课题组前期筛选的PD-E1[21]作为内参基因,通过Primer 5.0软件[22]和NCBI Primer-BLAST对PyUGPase-A、PyUGPase-B和PyUSPase三个基因进行引物设计,参数设置为扩增长度80~200 bp,引物序列长度17~25 bp,GC含量45%~55%,Forward引物和Reverse引物Tm值的差值小于± 3℃。引物由生工生物工程(上海)股份有限公司合成,并对合成的引物检测其扩增的特异性,引物序列见表2。

表2 引物序列Table 2 Primer sequence
1.4.3 RT-qPCR分析
使用Rotor-Gene Q实时荧光定量PCR分析仪和Vazyme公司的ChamQ SYBR qPCR Master Mix试剂盒进行基因表达的RT-qPCR分析。PCR反应体积为20μL:2×ChamQ SYBR qPCR Master Mix 10 μL,正、反向引物各0.4 μL,cDNA 2 μL,ddH2O 7.2 μL。扩增反应程序为:95℃预变性3 min,95℃变性10 s,56 ℃退火30 s,72℃延伸30 s,40个循环,采集溶解曲线荧光信号。
1.5 数据整理与分析
在Excel 2019中对生长量指标和Ct值进行整理,采用2-ΔCt(样品ΔCt=样品Ct值-内参Ct值)为样品的均一化表达量,以正扦插苗木相关样品中的目标基因平均表达量为对照,将其表达量设定为1,计算倒扦插苗对应目标基因的相对表达量,其计算公式为2-ΔΔCt(ΔΔCt=实验组ΔCt-对照组ΔCt)[23]。应用SPSS 22.0统计分析软件对试验数据进行差异显著性分析。
2.1 PyUGPase-A、PyUGPase-B和PyUSPase基因的生物信息学分析
2.1.1PyUGPase-A、PyUGPase-B和PyUSPase基因的理化性质
利用ExPASy在线工具ProtParam分别对Py-UGPase-A、PyUGPase-B和PyUSPase基因编码的氨基酸组成成分和理化性质进行分析,结果如表3所示。根据ProtParam算法,不稳定性系数数值大于40时,预测的蛋白比较不稳定,反之稳定性较好[24-25]。由表3可知,PyUGPase-A、PyUGPase-B和PyUSPase蛋白不稳定性系数分别为31.67、26.01和32.50,均小于40,表明三者均属于稳定蛋白。脂肪系数是指一个蛋白质中脂肪侧链所占的相对值,脂肪系数值越高代表蛋白质越稳定[26]。Py-UGPase-A、PyUGPase-B和PyUSPase蛋白脂肪系数分别为101.96、103.22和83.45,3个蛋白脂肪系数较高,进一步表明3个蛋白均较稳定。

表3 PyUGPase-A、PyUGPase-B和PyUSPase基因编码蛋白的部分理化性质及亚细胞定位Table 3 Some physicochemical properties and subcellular localization of PyUGPase-A,PyUGPase-B and PyUSPase e coding proteins

续表 3
2.1.2 PyUGPase-A、PyUGPase-B和PyUSPase蛋白亲水性/疏水性
蛋白质的亲/疏水性通常依据GRAVY值来判定,GRAVY值为负,则认为该蛋白质为亲水性蛋白,GRAVY值为正,则为疏水性蛋白[27]。利用ExPASy在线工具ProtScale,分别对PyUGPase-A、PyUGPase-B和PyUSPase蛋白进行亲/疏水性预测(图1)。由图1可见,PyUGPase-A蛋白的GRAVY值为-0.151,多肽链112位具有最高的分值(2.578),疏水性最强,而多肽链70位的分值最低,为-2.500,表明亲水性最强(图1a);
PyUGPase-B蛋白的GRAVY值为-0.151,其多肽链112位具有最高的分值2.578,疏水性最强,多肽链71位具有最低的分值-2.856,亲水性最强(图1b);
PyUSPase蛋白的GRAVY值为-0.326,其多肽链144位具有最高的分值2.400,疏水性最强,多肽链409位具有最低的分值-2.289,亲水性最强(图1c)。由图1还可知,3个蛋白的整个多肽链均没有明显的疏水区域,因此,3个蛋白均是亲水性蛋白。这与蛋白质理化性质相一致。

图1 PyUGPase-A、PyUGPase-B和PyUSPase蛋白亲水性预测Fig.1 Hydrophilic prediction of PyUGPase-A,PyUGPase-B and PyUSPase
2.1.3 亚细胞定位
蛋白质的功能与该蛋白在细胞中的定位密不可分,利用Plant-mPLoc在线软件分别对PyUGPase-A、PyUGPase-B和PyUSPase蛋白进行亚细胞定位预测,结果显示,3个蛋白均定位于细胞质内(表3)。
2.1.4 PyUGPase-A、PyUGPase-B和PyUSPase蛋白跨膜结构域
跨膜结构域是膜内在蛋白与细胞膜脂质相结合的主要区域,一般由20个左右的疏水性氨基酸组成,形成α螺旋结构并固定于细胞膜上起“锚定”作用[28]。利用TMHMM在线工具分别对PyUGPase-A、PyUGPase-B和PyUSPase蛋白的跨膜结构域进行预测。如图2所示,信号线平直没有变化,可知PyUGPase-A、PyUGPase-B和PyUSPase蛋白均不是膜蛋白,均不存在跨膜结构域,该预测结果与蛋白亚细胞定位在细胞质内的结果相一致。

图2 PyUGPase-A、PyUGPase-B和PyUSPase蛋白跨膜结构域分析Fig.2 Transmembrane domain analysis of PyUGPase-A,PyUGPase-B and PyUSPase
2.1.5 PyUGPase-A、PyUGPase-B和PyUSPase蛋白信号肽结构
信号肽是分泌蛋白N端的一段20~30个氨基酸残基组成的肽段,它用于蛋白质的跨膜转移[28]。利用ExPASy的SignalP 4.1在线软件,分别 对PyUGPase-A、PyUGPase-B和PyUSPase蛋白的信号肽结构进行预测。结果显示(表4和图3),PyUGPase-A、PyUGPase-B和PyUSPase蛋 白 的氨基酸残基具有最高的原始剪切位点,分别在第42、25和23位上,分值分别为0.115、0.122和0.115;
氨基酸残基具有最高的信号肽的位点分别在第41、1和40位上,分值分别为0.107、0.130和0.148;
氨基酸残基的信号肽区域分别在第1~41位、第1~16位和第1~69位置上,得分为0.098、0.107和0.097;
氨基酸残基具有最高综合剪切位点分别在第42、17和70位上,得分为0.107、0.113和0.108。从表4可见,3个蛋白氨基酸残基的原始剪切位点和信号肽的分值均较小,由此可知PyUGPase-A、PyUGPase-B和PyUSPase蛋 白 不存在信号肽,它是一种非分泌蛋白。

表4 PyUGPase-A、PyUGPase-B和PyUSPase蛋白信号肽预测结果Table 4 Prediction result of PyUGPase-A,PyUGPase-B and PyUSPase protein signal peptide

图3 PyUGPase-A、PyUGPase-B和PyUSPase蛋白信号肽Fig.3 Prediction of PyUGPase-A,PyUGPase-Band PyUSPase protein signal peptide
2.1.6 PyUGPase-A、PyUGPase-B和PyUSPase蛋白结构域
使用NCBI的CDD(Conserved Domain Database)数据库,分别对PyUGPase-A、PyUGPase-B和PyUSPase蛋白序列进行保守结构域分析。结果如图4所示,PyUGPase-A和-B蛋白均具有Substrate binding site、PLN02474和UDPGP、UGPase和QRI1等结合位点和保守域,属于Glyco_tranf_GTA_type超家族蛋白;
而PyUSPase蛋白具有Substrate binding site、PLN02830和UDP-葡萄糖/半乳糖焦磷酸化酶UGGPase等结合位点和保守域,属于Glyco_tranf_GTA_type超家族蛋白。

图4 PyUGPase-A、PyUGPase-B和PyUSPase蛋白的保守结构域Fig.4 Analysisof conserved domainsof PyUGPase-A,PyUGPase-Band PyUSPase
2.1.7 PyUGPase-A、PyUGPase-B和PyUSPase蛋白的二级结构
利用ExPASy-SOPMA在线软件分别对PyUGPase-A、PyUGPase-B和PyUSPase蛋白二级结构进行预测,结果见表5和图5。由表5可知,PyUGPase-A、PyUGPase-B和PyUSPase蛋白的无规则卷曲比例均较高,分别为38.81%、39.45%和38.78%;
其次为α螺旋结构比例,分别为33.05%、32.62%和35.74%;
延伸链和β折叠所占比例均较少。由表5和图5可知,α螺旋结构和无规则卷曲结构散布于其整个蛋白质中,是构成PyUGPase-A、PyUGPase-B和PyUSPase蛋白质二级结构的主要骨架。
图5 PyUGPase-A、PyUGPase-B和PyUSPase蛋白二级结构Fig.5 Protein secondary structure of PyUGPase-A,PyUGPase-Band PyUSPase

表5 PyUGPase-A、PyUGPase-B和PyUSPase蛋白的二级结构Table 5 Protein secondary structure resultsof PyUGPase-A,PyUGPase-Band PyUSPase%
2.1.8 PyUGPase-A、PyUGPase-B和PyUSPase蛋白的三级结构
通过Expasy工具中的在线软件SWISSSMODEL对PyUGPase-A、PyUGPase-B和PyUSPase蛋白的三级结构进行预测。由图6可知,PyUGPase-A、PyUGPase-B和PyUSPase蛋白的空间构象主要由α螺旋结构和无规则卷曲结构所组成,且延伸链数目也较多,而β折叠较少。

图6 PyUGPase-A、PyUGPase-B和PyUSPase蛋白三级结构Fig.6 Protein tertiary structure of PyUGPase-A,PyUGPase-B and PyUSPase
2.1.9 PyUGPase-A、PyUGPase-B和PyUSPase蛋白同源性分析及系统进化树的构建
使用ClustalX2.1软件,对PyUGPase-A和PyUGPase-B氨基酸序列与拟南芥(Arabidopsis thaliana)UGPase-A和UGPase-B(NP_186975.1、NP_197233.1)、杂交杨树(P. tremula×P.tremuloides)UGPase-A和UGPase-B(AAP86317.1、ABB88893.1)、毛果杨(P. trichocarpa)UGPase-A和UGPase-B(XP_006384119.1、XP_006372413.1)、美洲黑杨(P.deltoides)UGPase(AEF13021.1)、银白杨(P.alba)UGPase(XP_034898917.1)、胡杨(P.euphratica)UGPase(XP_011038414.1)、番木瓜(Carica papaya)UGPase(XP_021888036.1)、克 莱 门 柚(Citrusclementina)UGPase(XP_006430411.1)、橡胶树(Heveabrasiliensis)UGPase(XP_021643510.1)、杂交核桃(Juglansmicrocarpa×J.regia)UGPase(XP_041007687.1)、核桃(J.regia)UGPase(XP_018811449.1)、欧洲 甜 樱 桃(Prunusavium)UGPase(XP_021823827.1)、雷 公 藤(Tripterygiumwilfordii)UGPase(XP_038702092.1)、河岸葡萄(Vitisriparia)UGPase(XP_034682270.1)、枣(Ziziphus jujuba)UGPase(XP_015880132.1)等氨基酸序列进行同源性分析。结果如图7a显示,PyUGPase与杨属中其他树种的UGPase同源性高达97.35%,而与其他植物的同源性也达到89.28%,表明UGPase蛋白具有较高的保守性。

图7 滇杨与其它物种UGPase-A、UGPase-B和USPase氨基酸序列的同源性分析Fig.7 P. yunnanensis and other plant UGPase-A, UGPase-B and USPaseamino acid homology analysis
对PyUSPase氨基酸序列与拟南芥USPase(NP_568775.1)、银白杨USPase(XP_034930993.1)、胡 杨USPase(XP_011027439.1)、毛果 杨USPase(XP_024451421.1)、克莱门柚USPase(XP_006434300.1)、麻 风 树(Jatrophacurcas)USPase(XP_012078333.1)、莲(Nelumbo nucifera)USPase(XP_010270310.1)、梅(Prunus mume)USPase(XP_008219569.1)、蓖 麻(Ricinuscommunis)USPase(XP_002520299.1)、河岸葡萄USPase(XP_034675602.1)、枣USPase(XP_015885782.1)等氨基酸序列进行同源性分析(图7b)。由图7b可见,PyUSPase与杨属的其他树种同源性高度一致(99.24%),而与其他植物的同源性也有87.24%,表明USPase蛋白的保守性较高。
进一步地,通过MEGA7.0软件比对分析,构建PyUGPase-A、PyUGPase-B和PyUSPase氨 基酸序列进化树。如图8所示,滇杨与毛果杨亲缘关系最近,而与同属的其他杨树或者其他植物亲缘关系相距较远,根据氨基酸序列分析的物种亲缘关系与传统进化亲缘关系相同。

图8 滇杨与其它物种UGPase-A、UGPase-B和USPase氨基酸系统进化树Fig.8 Phylogenetic tree based on P. yunnanensis and other plant UGPase-A,UGPase-B and USPaseamino acid
2.2 生长量统计分析
2020年10月对正、倒扦插苗的主枝长度和主枝粗度统计结果表明(图9),倒扦插苗主枝长度33.94 cm,正扦插苗主枝长度为68.78 cm,倒扦插苗主枝长度明显低于正扦插苗,但两者差异不显著。倒扦插苗主枝粗度为3.00 cm,正扦插苗主枝粗度为3.39 cm,倒扦插苗主枝粗度略低于正扦插苗主枝粗度且差异不显著。综上所述,倒扦插苗的主枝长度和粗度均低于正扦插苗,但插穗方向对主枝高生长的影响更明显。

图9 1年生滇杨正、倒扦插苗主枝长度和粗度Fig.9 Main branch length and diameter of upright and inverted cuttingsof one-year-old P. yunnanensis
2.3 PyUGPase-A、PyUGPase-B和PyUSPase基因在不同组织中的表达
2.3.1 RNA提取与检测
使用OMEGA试剂盒提取正、倒扦插苗5个组织的总RNA,通过Nanodrop检测RNA的核酸浓度和纯度,结果表明,A260/280的比值在1.8~2.1之间,且峰图均为单峰,说明RNA的纯度较高。采用1.0%琼脂糖凝胶电泳检测,电泳条带为清晰的两条带且没有明显的弥散或降解现象(图10),说明RNA完整性良好,没有降解,总RNA的质量可满足后续实验的要求。
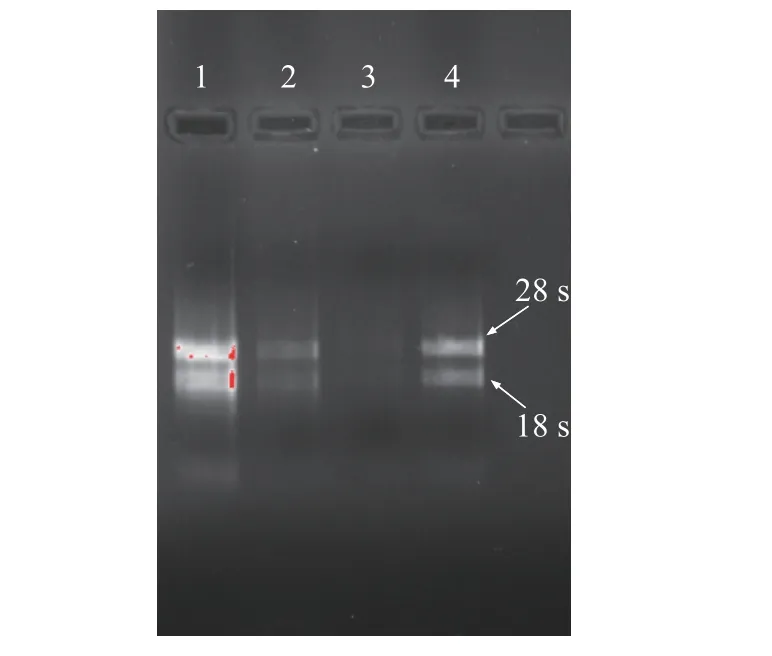
图10 部分RNA电泳图Fig.10 Electrophoresis of partial RNA
2.3.2 引物特异性验证
将RT-qPCR反应的产物通过2.0%琼脂糖凝胶电泳检测,结果显示内参基因和目的基因的电泳条带均为单一条带且无其他杂带。通过RT-qPCR的溶解曲线分析,发现内参基因和目的基因均产生单一的溶解峰,表明设计的引物特异性较好,RT-qPCR反应的专一性较高(图11)。

图11 内参基因和目的基因溶解曲线Fig.11 Melting curvesof reference gene and target genes
2.3.3 基因表达量分析
PyUGPase-A基因在正扦插苗的茎尖、成熟叶、茎及根中的表达量均显著高于嫩叶,PyUGPase-B基因在成熟叶和根中的表达量显著高于茎尖、嫩叶和茎,并且嫩叶中基因表达量仍表现为最低(图12a)。在倒扦插苗中,PyUGPase-A基因在成熟叶中表达量显著高于嫩叶和根,PyUGPase-B基因在成熟叶中表达量显著高于茎尖和嫩叶(图12b)。PyUSPase基因在正、倒扦插苗根中的表达量均为最高,在倒扦插苗中,PyUSPase在根中的表达量显著高于茎尖、嫩叶和成熟叶,而在正插苗中的根中表达量仅显著高于嫩叶(图12a、b)。

图12 基因表达量Fig.12 Geneexpression
由图12c、d可知,除扦插苗的嫩叶和倒扦插苗的根外,在正、倒扦插苗的其余组织中Py-USPase基因的表达量显著低于PyUGPase-A和PyUGPase-B基因。在正扦插苗的成熟叶和根中,PyUGPase-B基因的表达量高于PyUGPase-A基因且存在显著差异(图12c),而在倒扦插苗的嫩叶、成熟叶和根中,PyUGPase-B基因的表达量均显著高于PyUGPase-A基因(图12d)。
综上所述,PyUGPase-A和PyUGPase-B基因在正、倒扦插苗的成熟叶、茎及根的表达量相对较高,PyUSPase基因在5个组织中表达量较低且表达量均低于PyUGPase-A和PyUGPase-B基因。
2.3.4 相对表达量分析
以正扦插苗不同组织样本中的平均表达量为对照,将其表达量设定为1,计算目标基因在倒扦插苗对应组织中的相对表达量。图13所示,PyUGPase-A和PyUGPase-B基因,仅在倒扦插苗的嫩叶中上调,在其余4个组织中均为下调;
PyUSPase基因在5个组织中均为下调。

图13 3个基因的相对表达量Fig.13 Relativeexpression levelsof 3 genes
利用生物信息学软件,分别对PyUGPase-A、PyUGPase-B和PyUSPase基因编码蛋白进行分析,PyUGPase-A、PyUGPase-B和PyUSPase与杨属其他树种氨基酸序列的同源性达到97%以上,与其他植物也达到85%以上的同源性,这与紫穗槐(Amorpha fruticosa)与其他植物之间的UGPase氨基酸同源性比对结果较为一致,都有较高的同源性[29]。本研究分析结果与黄芪(Astragalus membranaceus)和棉花(Gossypiumhirsutum)中UGPase基因进化的分析结果相一致,均具有较高的保守性,且均定位于细胞质内的一种亲水性稳定蛋白[30-31]。
UGPase和USPase参与植物细胞壁的合成,由它们催化产生的UGPD是合成纤维素、半纤维和胼质体的底物[32]。在拟南芥中,USPase基因的功能缺失突变使花粉缺乏果胶纤维内层,细胞质退化,完全破坏了雄性植株的生育能力[10]。在细胞快速生长和分裂过程中,还需要USPase和特定的糖激酶回收从细胞壁中释放出来的单糖,所以USPase在细胞壁合成途径中也起着重要作用[33]。将棉花的GhUGP基因导入到拟南芥中进行过表达,植株生长速度明显加快,同时使叶片中的可溶性糖和纤维素含量提高[34];
在番茄中过量表达UGP基因,使植株的高度增加,提高了番茄的生物量[35]。在杂交杨树(P.alba×P. grandidentata)中过量表达细菌的UGPase基因,发现纤维素、可溶性糖含量增加,但植株生长速率减缓,茎高降低、叶面积减小等[36]。
本研究对正、倒扦插苗生长量统计结果表明,倒扦插苗的主枝长度和粗度均低于正扦插苗,表明倒扦插苗相对于正扦插苗生长迟缓,与前期研究结果相一致[37]。采用RT-qPCR技术对滇杨正、倒扦插苗不同组织中PyUGPase-A、Py-UGPase-B和PyUSPase基因表达特性的分析结果表明,在两种类型扦插苗的不同组织中,3个目标基因均有表达且具有组织表达的特异性,Py-UGPase-A和PyUGPase-B基因在成熟叶、茎、根中表达量较高,而PyUSPase基因在根中表达量高于其他组织。对杂交杨树和美洲黑杨UGPase-A基因表达谱研究显示,在成熟叶、茎和根中表达量较高[19-20],与PyUGPase-A表达规律相一致。然而,铁皮石斛(Dendrobiumofficinale)的UGPase-A基因仅在茎中表达量最高,可能与茎含有丰富的多糖有关[38]。美洲黑杨的UGPase-B基因在嫩叶和根中具有较高的表达量[20],而滇杨PyUGPase-B在成熟叶、茎和根中表达量较高,表明UGPase-B基因表达规律存在一定的物种特异性。USPase基因的组织表达规律研究比较有限,更多关注于USPase酶特性及其作用底物[5,11]。
在胡杨和灰杨(P. pruinose)中,UGPase-A和UGPase-B基因在盐胁迫的条件下表达规律较为一致,在茎和叶中上调,在根中下调[39]。野生型拟南芥中,在缺磷和蔗糖胁迫下UGPase基因均呈现上调表达[15]。相对于正扦插苗,滇杨倒扦插苗中的PyUGPase-A和PyUGPase-B基因在嫩叶中上调表达,而PyUSPase基因在所有组织中都呈现下调表达。前期RNA-seq分析结果表明,PyUSPase基因在滇杨倒扦插苗叶片和树皮中均呈现下调表达[14,40]。据此推测,插穗倒插后对其发育形成的植株具有一定胁迫作用,但其胁迫机制有待于进一步研究。
猜你喜欢 信号肽粗度主枝 新疆塔城地区苹果树整形修剪中的问题及改造措施北方果树(2022年2期)2022-11-10新疆塔城地区苹果树整形修剪中的问题及改造措施北方果树(2022年3期)2022-11-10信号肽筛选优化提高耐热α-环糊精酶在枯草芽胞杆菌中的表达福建农业学报(2022年3期)2022-05-24新梢粗度与葡萄生产的关系果农之友(2022年1期)2022-02-13基于TRU 系统对南山植物园川山茶根系空间分布规律的研究湖北农业科学(2022年1期)2022-02-11无花果常见整形修剪技术落叶果树(2021年1期)2021-01-29纺锤形桃树如何整形农家致富顾问·上半月(2020年1期)2020-08-10葡萄定植当年冬季修剪技术果农之友(2017年10期)2018-02-08全基因组预测褐环乳牛肝菌的分泌蛋白江苏农业科学(2017年23期)2018-01-29谈信号肽及蛋白质分选转运今日健康(2016年7期)2017-04-12