田欢欢 冯杨波 赵晋波 罗盅麟 石磊 郝瑛辉 李小飞
食管癌(Esophageal cancer,ESCA)是一种常见的上消化道肿瘤。2018年WHO国际癌症研究机构发布的全球癌症统计数据显示,食管癌在全球范围内所有肿瘤中发病率位居第7位,死亡率位居第6位[1]。食管癌的发病率和死亡率在全世界范围内差异很大,欧美等发达国家的发病率很低,病理类型主要以腺癌为主;
亚洲发展中国家的发病率很高,病理类型主要以鳞癌为主[2]。我国的食管癌患者数位居全球第1位,并以鳞状细胞癌为主,占比可达90%以上,全国每年因食管癌死亡人数可达19.3万人[2,3]。食管癌发病率在我国的分布也是极具特点,在太行山南段的山西、河南、河北交界地区发病率最高,并以林州为甚[4]。流行病学显示,造成这种情况的原因可能与此地区喜欢吃咸菜、进食过硬过快以及食物和饮用水中缺乏多种微量元素有关[5]。食管癌的病因复杂多样,目前已经证实,酗酒和吸烟是食管癌重要的致病原因[6],另外亚硝胺和一些霉菌及其毒素也是导致食管癌的危险因素,其他因素还包括食物中缺乏多种微量元素和多种维生素、进食过快过硬等不良饮食习惯和食管癌的遗传易感性[7]。
虽然目前食管癌采取多学科综合治疗,但5年生存率仅为15%~25%[8],预后并不理想。主要因为大多数食管癌患者早期症状不明显,确诊时已是中晚期,丧失手术机会[2,9]。对于不可手术食管癌患者最主要治疗为全身治疗,包括化学治疗、靶向治疗、免疫治疗等。化疗是应用最广泛、最成熟的全身治疗方法,属于一线治疗;
靶向治疗目前也取得一定进展,但应用在临床的药物极少,目前只有曲妥珠单抗和雷莫芦单抗获得批准用于晚期食管癌患者[10,11]。近几年随着免疫检查点的不断研究,免疫治疗在食管癌治疗中取得重大成果,为晚期食管癌患者带来了新希望[12],已成为晚期食管癌患者的二线治疗。本研究运用生物信息学的知识分析了解食管癌相关的基因表达,探索该基因与肿瘤微环境的关系,为食管癌患者的免疫治疗提供一些帮助。
免疫系统对于肿瘤的发生和发展起着至关重要的作用,肿瘤细胞的生长和清除同样受到免疫系统的调节[13]。在正常机体中,免疫系统可以识别和清除肿瘤微环境中发生癌变的细胞,但在某些情况下,癌变的细胞可能会逃过免疫系统的识别,发生免疫逃逸,使肿瘤细胞生长和转移[14]。免疫治疗是增强自身免疫应答反应,使免疫系统重新识别癌变细胞,从而消除肿瘤的一种治疗方法[15]。免疫治疗中采用免疫检查点抑制剂是近几年最热门的治疗方式。T细胞是细胞免疫的基础,T细胞免疫应答受刺激信号与抑制信号共同调节。目前程序性细胞死亡蛋白1(PD-1)和细胞毒性T淋巴细胞相关抗原4(CTLA-4)是研究最热门的抑制信号[16]。
HAVCR2的全称为T细胞免疫球蛋白黏蛋白分子3,被认为是Th1细胞表面的抑制性分子[17],HAVCR2与其他TIM家族成员有一个共同的结构,其特征是细胞质结构域中有5个酪氨酸残基。关于其细胞内信号机制,已知Tyr256/263与HLA-B关联转录因子3(BAT3)和酪氨酸激酶FYN相互作用。HAVCR2是一种表达于CD4 T细胞、CD8 T细胞、NK细胞、DC细胞和单核细胞表面的受体[18]。研究表明,HAVCR2 可介导T细胞失能和耗竭,促进肿瘤免疫逃逸、侵袭和转移,从而影响患者预后和转归[19,20],HAVCR2的表达在恶性肿瘤的发生中对免疫功能具有抑制作用。目前HAVCR2基因在食管癌中的研究较少,发病机制尚不清楚。本研究通过下载TCGA数据库中食管癌miRNA表达数据及临床特征数据,分析HAVCR2在食管癌中的发病机制及HAVCR2与肿瘤微环境的关系。
1.1 材料TCGA官网(https://cancergenome.nih.gov/)[21]下载食管癌测序数据,得到160例食管癌测序数据和11例正常食管组织的数据及相关临床信息。将下载的基因表达数据及临床资料数据文件解压成文本文件,利用R软件程序将数据整理为可处理的表达矩阵数据。在Ensemble官网(http://asia.ensemble.org/index)中下载人类基因注释文件,在R语言程序中将基因Ensemble ID转化为Gene ID,以进一步分析。
1.2 统计学方法通过非参数检验分析HAVCR2基因在食管癌组织和正常食管组织的表达差异。Oncomine数据集中寻找HAVCR2基因在食管癌组织中的表达证据。根据TCGA-ESCA数据库中总生存期数据绘制HAVCR2高、低表达组的Kaplan-Meier生存曲线,并进行Log-rank检验。通过单因素Cox回归分析筛选出与总生存期(Overall survival,OS)相关的差异基因,并绘制包含 Stage、T、N、M、HAVCR2的表格。利用“estimate[22]”包估计每个样本在肿瘤微环境中的免疫成分和基质成分含量。随后通过ssGSEA解释HAVCR2的表达与免疫细胞的关系。利用“pheatmap”包绘制HAVCR2高表达时免疫细胞功能状态的热图。利用CIBERSORT[23]估计肿瘤样本的肿瘤浸润免疫细胞(Tumor-infiltrating immune cell,TIC)丰度,选择P<0.05的肿瘤样本。HAVCR2高、低表达组之间免疫细胞差异和免疫检查点基因表达差异分析均采用Wilcoxon检验。利用基因集富集分析(Gene set enrichment analysis,GSEA)阐 述HAVCR2高、低表达组之间差异表达的基因所富集的生物学通路。从MSigDB数据库下载KEGG、BIOCARTA、REACTOME、GO作为GSEA分析的参考基因集,NOMP<0.05的富集通路被认为有意义。P<0.05为差异具有统计学意义。所有统计学分析均利用R语言完成。
2.1 HAVCR2基因在正常组织与食管癌组织中的表达Oncomine数据集(https://www.oncomine.org/re source/login.html)提示,目前暂无相关证据支持HAVCR2在食管癌中的研究现状,见图1A。通过非参数检验分析HAVCR2在食管癌组织和正常食管黏膜组织的表达差异,结果显示:食管癌组织较正常食管组织高表达HAVCR2,差异有统计学意义(P<0.05),见图1B。上述结果显示HAVCR2在食管癌中表现为高表达,由此推测HAVCR2在肿瘤的发生、发展过程中起重要作用,可能与食管癌的恶变有关。

图1 HAVCR2在Oncomine数据集中现状以及食管癌组织和正常食管组织中的表达
2.2 HAVCR2基因表达与食管癌患者总生存期的关系为深入了解HAVCR2表达与患者生存状况的关系,探寻可能的预后指标,我们利用食管癌TCGA数据库进行生存分析。在TCGA中下载的160例食管癌测序数据中,79例测序数据有预后信息,这些癌组织中基因表达水平高于其中位数者为高表达,反之为低表达。根据TCGA-ESCA数据库中总生存期数据绘制HAVCR2高、低表达组的Kaplan-Meier生存曲线,并进行Log-rank检验,见图2。结果表明,HAVCR2基因表达与食管癌患者的总生存期无关,差异无统计学意义(P=0.29)。虽然结果显示HAVCR2对食管癌患者的总生存期影响不是很显著,但是这并不能否认HAVCR2的表达在食管癌中所发挥的作用。

图2 TCGA数据库HAVCR2基因表达与食管癌患者生存率的关系
2.3 食管癌患者临床特征与OS的关系下载的食管癌测序数据中,同时含临床数据和总生存期的测序数据有71例。使用单因素Cox回归分析这71例测序数据来探讨食管癌患者中HAVCR2表达和OS之间的关系,以及食管癌患者的其他临床特征,见表1。单变量相关分析显示,病理分期中淋巴结转移(HR=2.035,P<0.05)与OS显著相关;
肿瘤浸润深度(HR=1.031,P>0.05)、远处转移(HR=3.007,P>0.05)、HAVCR2表达(HR=1.105,P>0.05)等因素与OS无关。淋巴结转移是食管癌最主要的转移方式,其引流区域主要在颈部、胸部和腹部。出现淋巴结转移的患者一般提示死亡率高和预后差,因此对淋巴结转移的检测有重要意义。食管癌淋巴结转移受肿瘤的分化程度、肿瘤长度及浸润深度等多种因素共同影响,对N分期的深入了解,有助于手术方式的选择。淋巴结与免疫系统密不可分,这也为HAVCR2的表达与免疫相关提供了证据。
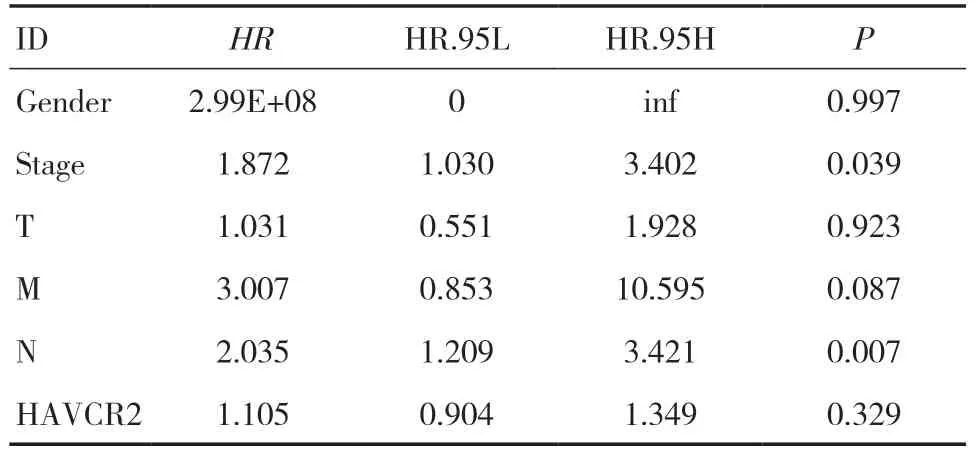
表1 单因素Cox回归分析食管癌患者临床特征与生存的关系
2.4 食管癌HAVCR2表达与肿瘤微环境的关系为了分析HAVCR2的表达与免疫微环境的相关性,我们使用“estimate”包评价每个食管癌样本在肿瘤微环境中的免疫成分(免疫评分)和基质成分(基质评分),并比较HAVCR2高低表达与两个评分组之间的统计学差异。为阐明食管癌样本中免疫成分比例和基质成分比例与HAVCR2高、低表达组的关系,我们利用Wilcoxon检验进行了差异分析。结果表明,高表达HAVCR2食管癌中免疫成分和基质成分也高,差异具有统计学意义(P<0.001),见图3A。随后通过ssGSEA解释HAVCR2的表达与免疫细胞的关系,利用“pheatmap”包绘制免疫细胞功能状态热图。结果显示,与HAVCR2低表达组相比,高表达组的estimate总体评分、免疫评分和基质评分较高,但肿瘤纯度较低,见图3B。HAVCR2高表达时,肿瘤微环境中免疫细胞种类及数量增多,免疫功能可能处于被激活状态,进一步证实了HAVCR2与免疫的相关性。。
为进一步揭示HAVCR2表达与肿瘤浸润免疫细胞的关系,我们利用CIBERSORT算法分析了食管癌组织中肿瘤浸润免疫细胞各种亚群的比例,并且在食管癌样本中构建了22种免疫细胞的表达谱,见图3C。同时评估了22种免疫细胞之间可能存在的相关性。热图显示,不同肿瘤浸润免疫细胞亚群的比率也不同。此22种免疫细胞与CD8 T细胞相比,CD4活动记忆T细胞、滤泡辅助性T细胞呈正相关,而与巨噬细胞M0呈负相关;
此22种免疫细胞与静止NK细胞相比,活动NK细胞、静息肥大细胞呈负相关,见图3D。随后,我们评估了HAVCR2高、低表达组的免疫细胞表达是否存在差异。结果表明,在高HAVCR2组和低HAVCR2组之间观察到幼稚B细胞、效应记忆T-CD4、效应NK细胞、巨噬细胞M1/M2存在显著差异。与低表达组相比,高表达组效应记忆T-CD4、效应NK细胞、巨噬细胞M1/M2数量增加(P<0.05),而幼稚B细胞数量减少(P<0.05),见图3E。分析高、低表达组常见免疫检查点基因的表达特征,结果表明大部分免疫检查点基因在HAVCR2高表达组中也高表达,见图3F。

图3 食管癌HAVCR2表达与肿瘤微环境的关系
为了阐述HAVCR2高、低表达组之间差异表达基因(DEGs)所富集的生物学过程,我们利用基因集富集分析(Gene set enrichment analysis,GSEA)探索与HAVCR2基因表达可能相关的信号通路。其中KEGG 信号通路分析是以基因组、化学和系统功能信息为基础,预测蛋白在细胞活动中的作用,并对信号通路中的关键基因进行富集。GO富集分析包括生物学过程(Biological process,BP)、分子功能(Molecular function,MF)、细胞组分(Cell components,CC)3个独立的本体论,其通过建立一套具有动态形态的控制集解释基因及蛋白在细胞内所产生的作用,进而分析出DEGs在BP、MF、CC 3个方面的富集情况。本研究只分析了BP部分,并将结果绘制为气泡图,见图4。结果显示:KEGG信号通路富集分析主要富集于2条信号通路:自然杀伤细胞介导的细胞毒性通路(Natural killer cell mediated cytotoxicity pathway)、T细胞受体信号通路(T cell receptor signaling pathway)。BIOCARTA信号通路富集分析主要富集在T细胞受体信号通路(T cell receptor signaling pathway)。REACTOME信 号通路富集分析主要富集在T细胞受体信号通路(T cell receptor signaling pathway)、干扰素-γ信号通路(Interferon gamma signaling pathway)。GO分析结果显示,食管癌组织与正常组织显著性DEGs的BP主要富集在T细胞介导免疫通路(T cell mediated immunity pathway)、T细胞增殖的正调控通路(Positive regulation of T cell proliferation pathway)、干扰素γ产生通路(Interferon gamma production pathway)、T细胞受体信号通路(T cell receptor signaline pathway)等方面。这4种富集通路共同富集了T细胞受体信号通路。这可能提示,HAVCR2表达越高的食管癌组织中T细胞受体信号通路被激活,免疫功能增强,患者的预后可能更好。但是,食管癌患者的预后是多种因素共同作用的结果,单看T细胞受体信号通路被激活这一项的说服力还不强,需要更深层次的研究。

图4 富集分析
食管癌在我国的发病率和死亡率都很高,患者的生活质量不高,为患者及家属带来了沉重的经济负担。因此研究食管癌的预后和免疫的相关性很有必要。
本研究中,首先我们在Oncomine数据集中寻找HAVCR2基因在食管癌组织中的表达证据。其次通过非参数检验分析HAVCR2在食管癌组织和正常食管组织的表达差异。随后,根据 TCGA 数据库中总生存期数据绘制了HAVCR2高、低表达组的 Kaplan-Meier生存曲线,并进行Log-rank检验。结果表明HAVCR2基因表达与食管癌患者的总生存期无关,差异无统计学意义,不能够作为食管癌的预后因子。随后,我们进行单因素Cox回归分析结果显示,病理分期中淋巴结转移与OS显著相关;
肿瘤浸润深度、远处转移、HAVCR2表达等因素与OS无关。淋巴结与免疫系统密不可分,所以我们猜测HAVCR2可能与免疫相关。随后,分析了HAVCR2与肿瘤微环境的关系。肿瘤微环境是指肿瘤发生、发展与肿瘤细胞所处的内外环境,它不仅包括肿瘤所在组织的结构、功能和代谢,而且包括与肿瘤细胞自身(核和胞质)的内在环境[24]。为了分析HAVCR2的表达与免疫的相关性,我们使用“estimate”包评价每个食管癌样本在肿瘤微环境中的免疫成分和基质成分。为阐明食管癌样本中免疫成分比例和基质成分比例与HAVCR2高低表达的关系,我们利用 Wilcoxon 检验进行了差异分析。结果表明,高表达HAVCR2食管癌中免疫成分和基质成分也高,差异具有统计学意义。随后通过ssGSEA解释HAVCR2的表达与免疫细胞的关系,利用“pheatmap”包绘制HAVCR2高表达时免疫细胞功能状态的热图,结果显示,与HAVCR2低表达组相比,高表达组的estimate总体评分、免疫评分和基质评分较高,但肿瘤纯度较低。HAVCR2高表达时,肿瘤微环境中免疫细胞种类及数量增多,免疫功能处于增强状态。为进一步揭示HAVCR2表达与肿瘤浸润免疫细胞的关系,我们利用CIBERSORT 算法分析了食管癌组织中肿瘤浸润免疫细胞各亚群的比例,且在食管癌样本中构建了22种免疫细胞的表达谱,并评估了HAVCR2高、低表达组的免疫细胞表达是否存在差异。结果表明,在高HAVCR2组和低HAVCR2组之间观察到幼稚B细胞、效应记忆T-CD4、效应NK细胞、巨噬细胞M1/M2存在显著差异。随后,探讨了高、低表达组常见免疫检查点基因的表达特征。结果表明大部分免疫检查点基因在HAVCR2高表达组中也高表达。最后阐述高、低组之间差异表达基因所富集的生物学过程,我们利用基因集富集分析探索与HAVCR2基因表达可能相关的信号通路,4种富集通路共同富集了T细胞受体信号通路。这就说明,HAVCR2表达越高的食管癌组织中T细胞受体信号通路被激活,免疫功能可能增强。
目前研究表明,HAVCR2在自身免疫、感染和癌症等疾病中都发挥作用[18]。在乳腺癌中,HAVCR2在CD4+和CD8+T细胞上的表达主要与乳腺癌较差的预后、淋巴结转移和肿瘤分级有关[25]。在鼻咽癌中,HAVCR2可通过SMAD7-SMAD2-SNAIL1信号通路与鼻咽癌的转移有关[26]。还有研究表明HAVCR2与PD-1具有协同作用,共同阻断HAVCR2和PD-1有助于恢复抗肿瘤免疫和增加T细胞活性[27]。但是目前HAVCR2在食管癌中的研究还不充分,具体的发病机制尚不清楚。近年来,随着免疫治疗的不断发展以及TCGA等公共数据库对食管癌中预后标志物及致病机制分析的应用,为食管癌患者预后的预测及致病分子机制和治疗的研究提供了新的思路。
总之,HAVCR2在食管癌中高表达,并且可以激活免疫功能。本研究揭示了HAVCR2与食管癌临床特征有一定的关联性,为进一步研究食管癌的致病机制和临床治疗方法提供了帮助。但本研究有局限性:首先,样本量不大,研究结论说服力不强;
其次,本研究数据来源于公共数据库,缺乏一定的基础实验;
再次,蛋白质是生命活动的主要承担者,目前对蛋白质的表达还缺乏相应的研究,这些不足将在后续工作中逐步完善。