吴志强,肖玉娇,谷丽瑶,李 旭,张佩雯,王梨力,肖金银,罗 敏
(湖南中医药大学第二附属医院,湖南 长沙 410005)
溃疡性结肠炎(Ulcerative colitis, UC)主要特点为肠道黏膜非特异性炎症[1-3],UC目前发病机制不明,主要与免疫功能异常、肠道环境失调、遗传、感染、心理、饮食等因素有关[4]。研究发现[5],内质网应激(Endoplasmic reticulum stress,ERS)与肠黏膜屏障受损有关,肠黏膜屏障受损是UC发生的重要原因。研究表明,UC发病与PERK通路关系密切,PERK通路被激活后,促炎因子的分泌增加,炎性细胞聚集,发生炎症反应[6-7]。
另外,PERK 通路是诱导细胞凋亡的重要途径[8],通路激活后C/EBP 同源蛋白(C/EBP homolo-gous protein,CHOP)增加,促进细胞凋亡[9-10]。肠道上皮组织主要由杯状细胞(Goblet cells,GC)构成[11-12]。相关实验研究显示,当发生ERS 时,PERK通路被激活,CHOP的表达增加,加速细胞凋亡,导致相应的杯状细胞形态改变,数量减少,肠屏障受损,导致肠道自发性炎症[13]。前期实验发现芍药汤能抑制UC大鼠结肠PERK信号通路的激活,起到治疗UC的作用。本研究在前期研究的基础上,进一步探讨芍药汤对UC中内质网应激PERK信号通路介导细胞凋亡及杯状细胞破坏的调控作用。
1.1 实验动物 来自湖南斯莱克景达实验动物有限公司84只SPF级SD大鼠,体重180~220 g,雄性,质量合格证号:43072721102432363,饲养于湖南中医药大学动物实验室。本实验经湖南中医药大学第一附属医院动物伦理委员会批准(LLBH-20210910001)。
1.2 实验药物 芍药汤组方:芍药30 g,当归、黄连、黄芩各15 g,槟榔、木香、炙甘草各6 g,大黄9 g,肉桂5 g。中药配方颗粒由湖南中医药大学第二附属医院中药颗粒药房提供。芍药汤中剂量按成人用量的10倍计算,即9.2 g/kg(生药量,下同),药物用蒸馏水配成920 g/L,疗程14 d。柳氮磺吡啶片,0.25 g/片,批号22180510。片剂研粉后过100目筛,使用时按照0.3 g/kg蒸馏水冲兑灌胃,疗程14 d。
1.3 主要试剂 PAS染色套装(G1008)、二甲苯(100092683)、2,4,6-三硝基苯磺酸、水合氯醛、4%多聚甲醛(BS)、RNA提取液(G3013)、无水乙醇(10009218)、BSA(G5001)、苏木素染色(G1004)。
1.4 主要仪器 脱色摇床(谷歌生物,TSY-B);
脱水机(意大利DIAPATH,Donatello);
包埋机(武汉俊杰,JB-P5);
冻台(武汉俊杰,JB-L5);
组织摊片机(浙江科迪,KD-P);
显微镜(日本尼康,NIKON ECLIPSE E100);
研磨仪(低温型 Servicebio,KZ-Ⅲ-FP);
荧光定量PCR仪(Bio-rad,CFX);
超净工作台(苏净安泰,SW-CJ-1FD);
掌上离心机(谷歌生物,D1008E);
病理切片机(上海徕卡,RM2016)。
1.5 实验动物分组和UC大鼠模型的制备[14]将SD大鼠适应性喂养7 d后进行编号,随机选取14只大鼠作为空白组。提前禁食24 h,将SD大鼠用10%水合氯醛按照0.3 ml/kg进行腹腔注射麻醉,麻醉完成后,空白组大鼠从肛门用灌胃针头推入0.9%氯化钠溶液4 ml/kg;
其余SD大鼠用三硝基苯磺酸制作UC大鼠模型[15],造模后正常饲养。造模4 d后,随机抽取1只大鼠处死并解剖,距肛缘6~10 cm结肠处肉眼可见溃疡面,病理检查发现炎性改变及典型溃疡面时,即造模成功。造模期间,死亡7只大鼠(包括处死1只),解剖发现可能为炎症刺激导致结肠粘连梗阻穿孔死亡。造模完成后,将余下大鼠随机分为模型组12只、柳氮磺吡啶组13只、芍药汤低剂量组12只、芍药汤中剂量组13只、芍药汤高剂量组13只。
1.6 给药方法 芍药汤高剂量组:按照含生药量18.4 g/(kg·d)灌胃;
芍药汤中剂量组:按照含生药量 9.2 g/(kg·d)灌胃;
芍药汤低剂量组:按照含生药量4.6 g/(kg·d)灌胃;
柳氮磺吡啶组:按照 0.3 g/(kg·d)灌胃;
模型组和空白组:予等体积的0.9%氯化钠溶液灌胃。均1次/d,连续14 d。
1.7 取 材 末次给药后,禁食24 h,脱颈椎法处死所有大鼠后解剖,取距肛门8 cm处结肠段,沿肠系膜缘剪开肠腔,观察大鼠结肠组织并进行评分,取病变最明显处组织样品均分为两份,一份浸入40 g/L的多聚甲醛固定液中,常规石蜡包埋、切片,用于免疫组化及PAS 染色;
一份投入液氮中冷冻待 RT-PCR 检测。
1.8 观察指标
1.8.1 大鼠疾病活动指数(DAI):在末次灌药后,进行DAI评分。DAI评分=(体重下降分数+大便性状分数+便血分数)/3。标准如下,0 分:大便正常,无体重减轻;
1 分:大便正常,大便隐血(-),体重下降 1%~5%;
2 分:大便较软,大便隐血(+),体重下降 5%~10%;
3 分:大便较软,大便隐血(+),体重下降 10%~15%;
4 分:稀便,肉眼血便,体重下降>15%[15]。
1.8.2 大鼠的结肠黏膜损伤指数(CMDI):CMDI 评分标准为,0分:无溃疡及充血;
1分:无溃疡,轻度黏膜充血;
2分:无溃疡,黏膜充血;
3分:小溃疡,直径约0~1 cm;
4分:溃疡直径约 1~2 cm,与周围组织无粘连;
5分:溃疡直径约 1~2 cm,与周围组织粘连[16]。
1.8.3 大鼠结肠组织p-PERK的蛋白表达:免疫组化法检测大鼠结肠组织p-PERK的蛋白表达水平。石蜡切片,脱蜡,进行抗原修复,然后放入3%过氧化氢溶液中孵育,继续在脱色摇床上晃动洗涤,进行血清封闭,加一抗、二抗,置于PBS(pH7.4)在脱色摇床上晃动洗涤。滴加DAB显色液,Harris苏木素复染,脱水封片,显微镜镜检,图像采集。
1.8.4 大鼠结肠黏膜组织中CHOP水平:采用RT-PCR法检测结肠黏膜组织中CHOP水平。总RNA抽提方法为,取匀浆管,加入RNA提取液,取100 mg组织,加入到匀浆管中。研磨,离心,加入250 μl三氯甲烷离心,然后加入异丙醇离心,提取RNA。吸除液体,加入75%乙醇洗涤沉淀离心。将离心管置于超净台上吹干,加入15 μl无RNA酶的水溶解孵育,检测RNA浓度及纯度。按照逆转录程序设定进行逆转录。采用 2-k 值表示该基因的相对表达水平,A=CT(目的基因,待测样本)-CT(内标基因,待测样本),B=CT(目的基因,对照样本)-CT(内标基因,对照样本),k=A-B,表达倍数=2-k。
1.8.5 大鼠结肠黏膜组织中杯状细胞数量:采用PAS染色法检测大鼠结肠组织GC数量。依次将切片放入二甲苯及无水乙醇中,自来水洗,切片入PAS染色液B中染色,自来水洗,蒸馏水洗。然后PAS染色液A中染色,流水冲洗,PAS染色液C染,盐酸水溶液分化,用自来水洗及氨水返蓝。最后中性树胶封片,显微镜观察。
1.9 统计学方法 采用SPSS 23.0统计学软件,图片用Image J及Graphpad Prism 8.0分析。对符合正态性检验和方差齐性检验的,以均数±标准差表示,采用单因素方差分析,不符合正态性检验和方差齐性检验的,以M(P25,P75)表示,采用非参数检验(Kruskal-Wallis);
P<0.05 为差异具有统计学意义。
2.1 各组大鼠DAI、CMDI评分比较 见表1。与模型组比较,柳氮磺吡啶组和芍药汤高、中、低剂量组DAI、CMDI评分均降低(P<0.05);
柳氮磺吡啶组与芍药汤高、中、低剂量组DAI、CMDI评分比较差异无统计学意义(P>0.05)。

表1 各组大鼠DAI、CMDI评分比较(分)
2.2 各组大鼠结肠组织p-PERK、CHOP蛋白表达比较 见表2。与空白组比较,模型组、柳氮磺吡啶组和芍药汤高、中、低剂量组p-PERK、CHOP蛋白表达均上升(P<0.05);
与模型组比较,柳氮磺吡啶组和芍药汤高、中、低剂量组p-PERK、CHOP蛋白表达均下降(P<0.05);
与芍药汤低剂量组比较,柳氮磺吡啶组和芍药汤高、中剂量组p-PERK、CHOP蛋白表达均下降(P<0.05);
柳氮磺吡啶组和芍药汤高、中剂量组p-PERK、CHOP蛋白表达比较差异无统计学意义(P>0.05)。大鼠结肠组织p-PERK阳性表达见图1。

表2 各组大鼠结肠组织p-PERK、CHOP蛋白表达比较

图1 各组大鼠结肠组织p-PERK阳性表达(免疫组化染色,×200)
2.3 各组大鼠结肠组织杯状细胞数量比较 见表3(图2)。与空白组比较,模型组、柳氮磺吡啶组和芍药汤高、中、低剂量组杯状细胞数量均下降(P<0.05);
与模型组比较,柳氮磺吡啶组和芍药汤高、中、低剂量组杯状细胞数量均明显增加(P<0.05);
与芍药汤低剂量组比较,柳氮磺吡啶组和芍药汤高、中剂量组杯状细胞数量均增加(P<0.05);
柳氮磺吡啶组和芍药汤高、中剂量组杯状细胞数量比较无统计学差异(P>0.05)。
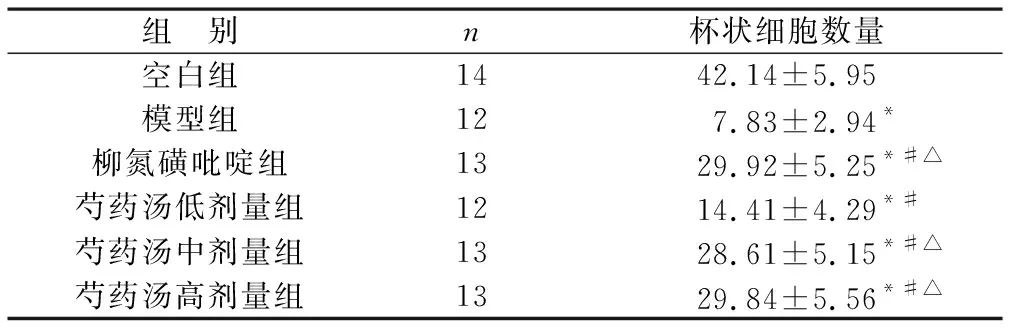
表3 各组大鼠结肠组织杯状细胞数量比较(个)

图2 各组大鼠结肠组织杯状细胞(PAS染色,×200)
前期研究发现,UC大鼠PERK信号通路被激活,大鼠结肠组织中p-PERK蛋白和p-PERK mRNA,p-eIF2a蛋白和p-eIF2a mRNA均增高[17],引起核因子-κB(NF-κB)炎性通路激活,刺激促炎因子的分泌,引发UC。同时研究发现,PERK通路是诱导细胞凋亡的重要途径[18]。肠道上皮组织是人体最活跃的自我更新组织,其中 GC内质网结构发达,是肠黏液屏障的重要组成部分。当UC发生时,内质网发生应激,PERK信号通路激活,增加CHOP的表达,诱导细胞凋亡,使GC数量减少,结构被破坏,肠黏膜屏障损伤。西医治疗UC的药物主要有激素、水杨酸类、免疫抑制剂、生物制剂、抗菌药物等,还有其他新兴治疗如微生态制剂、粪菌移植等。临床实践中,长期的药物治疗不仅使耐药性大大增加,而且不良反应较多,病情易复发,价格昂贵,难以作为患者的长期选择[19]。
UC在中医无明确病名,根据症状可将其归于“久痢”“肠澼”范畴。UC多因外感时邪、饮食不节、情志内伤、素体肝肾不足所致,病位在肠,涉及脾、肝、肾、肺诸脏[20]。芍药汤出自《素问病机气宜保命集》,可清热燥湿、调气和血,方中以黄连、黄芩为君,清热泻火祛湿。重用芍药和营养血,行血则便脓自愈,配以当归养血止血。槟榔、木香调气则后重自除。大黄苦寒沉降,通因通用,使湿热随大便而下。肉桂辛热温通,助归、芍行血和营,为佐助。炙甘草调和诸药,缓急止痛。诸药合用,共奏清热燥湿、调和气血之效,使便脓自愈。
在本次研究中,柳氮磺吡啶组和芍药汤高、中、低剂量组大鼠DAI、CMDI评分较模型组降低,说明柳氮磺吡啶及芍药汤均能减轻UC大鼠的症状。与模型组比较,柳氮磺吡啶组和芍药汤高、中、低剂量组p-PERK、CHOP蛋白表达均降低,芍药汤低剂量组p-PERK、CHOP蛋白表达降低程度相较于柳氮磺吡啶组、芍药汤中剂量组及芍药汤高剂量组小,说明柳氮磺吡啶及芍药汤不同剂量组均能减少p-PERK、CHOP蛋白表达,但芍药汤低剂量组抑制作用较低,这可能是芍药汤药物浓度的影响。与模型组比较,柳氮磺吡啶组和芍药汤高、中、低剂量组杯状细胞数量均上升,芍药汤低剂量组杯状细胞数量相较于柳氮磺吡啶组、芍药汤中剂量组及芍药汤高剂量组小。柳氮磺吡啶及芍药汤不同剂量组均能使杯状细胞数量增加,但芍药汤低剂量组作用较差,从而猜测芍药汤可能是通过控制PERK信号通路被激活,减少CHOP表达,抑制杯状细胞凋亡,从而改善UC大鼠的症状和体征,这可能是芍药汤治疗UC的作用机制。
猜你喜欢 吡啶芍药低剂量 芍药鲜切花 美景变“钱”景今日农业(2022年13期)2022-09-15肺部疾病应用螺旋CT低剂量扫描技术检查的分析中国典型病例大全(2022年9期)2022-04-19来那度胺联合环磷酰胺、低剂量地塞米松治疗多发性骨髓瘤的临床疗效探讨健康体检与管理(2022年2期)2022-04-15有机硼敲开吡啶药物合成“新大门”科学导报(2022年21期)2022-04-10陆抑非《芍药》上海文化(文化研究)(2021年6期)2022-01-07Systematic review of robust experimental models of rheumatoid arthritis for basic researchDigital Chinese Medicine(2021年4期)2021-02-14多株吡啶高效降解菌的降解性能与生物膜形成特性的研究北京大学学报(自然科学版)(2019年6期)2019-11-27自适应加权全变分的低剂量CT统计迭代算法计算机应用(2016年10期)2017-05-122—氯吡啶的合成及应用成长·读写月刊(2017年3期)2017-04-08咪唑吡啶类化合物的合成方法进展科技视界(2016年26期)2016-12-17