王 瑞, 张 涛, 韩志任, 金 岩, 张大侠, 李北兴, 刘 峰*,
(1. 山东农业大学 植物保护学院,山东 泰安 271018;
2. 济南绿霸农药有限公司,济南 250000;
3. 山东省农药检定所,济南 250100)
我国北方设施蔬菜根结线虫病主要由南方根结线虫Meloidogyne incognita侵染根部引起,造成根肿大畸形,严重影响蔬菜产量和品质[1],是威胁蔬菜产业发展最重要的土传连作障碍病害之一。化学防治是目前控制根结线虫病最广泛的方式,其中阿维菌素制剂登记数量最多,剂型以颗粒剂为主。前期调研发现,阿维菌素等化学药剂防治根结线虫病的田间效果不稳定,经多年和多地敏感性监测[2-3]发现并非因线虫的抗性增加所致,而与药剂性质[4]、剂型[5]和施药质量[6]密切相关。其中,裸露型阿维菌素制剂在常规土壤中施药时,易被土壤吸附并固定在上层土壤中,无法为作物根部提供有效保护。
为提高阿维菌素在土壤中的移动性,Jing 等[4]将阿维菌素的C5′ 和 C4″位的羟基进行了氨基甲酸酯化修饰,改善了其在土壤中的移动性,提高了对根结线虫病的防治效果。Li 等[7]将阿维菌素进行微囊化包覆后,也适当改善了其土壤移动性并提高了有效成分的稳定性,不过仍存在释放速率过慢和限制防治效果的问题。Cao 等[8]以病毒衣壳为载体制备了阿维菌素纳米颗粒,其在土壤中的移动性增加,表明利用纳米技术改善阿维菌素在土壤中的移动性具有可行性,尽管目前还未形成商品,但给阿维菌素制剂的开发方向以启示。
目前,其他用途的阿维菌素纳米化制备还有模板法[9]、反溶剂法[10]等,大多使用二氧化硅[11]、天然高分子[12]等材料,距规模化生产还有较大距离。本课题组前期以环氧树脂为原料,采用界面聚合工艺制备了阿维菌素纳米囊悬浮剂,发现其在土壤中的移动性提高,并且增加了对根结线虫病的田间防治效果[13]。不过该方法需高温加热固化,制备耗时相对较长。着眼于中国当前节能减排和碳中和发展战略,仍需寻找能耗更低、工艺更简化的制备方法。Zhang 等[14]开发了利用静电自组装制备高效氯氟氰菊酯纳米制剂的方法,由木质素磺酸钠与十二烷基二甲基苄基氯化铵在油水界面上通过静电吸引形成固体囊壳,三氯化铁可与木质素磺酸钠上的羟基发生络合反应,在囊壳表面起到交联的作用。该方法可在常温常压下进行,工艺简单,工业化生产潜力大。为验证该技术制备阿维菌素的可行性及对土壤应用效果的影响,本研究利用阴离子材料木质素磺酸钠与阳离子材料十二烷基二甲基苄基氯化铵,通过静电自组装法制备了3%阿维菌素纳米囊悬浮剂,评价了制剂稳定性及其对黄瓜根结线虫病的田间防治效果,以期为纳米农药制剂的研发及提高作物土传病害的防治效率提供依据。
1.1 材料与仪器
1.1.1 试验材料 阿维菌素B1a 原药 (95%,河北兴柏药业集团有限公司);
木质素磺酸钠 (98%,SL,美国 MeadWestvaco 公司);
环己酮 (分析纯,天津科密欧化学试剂有限公司);
十二烷基二甲基苄基氯化铵 (99%,DDBAC,山东泰和水处理科技股份有限公司);
三氯化铁 (分析纯,天津科密欧化学试剂有限公司);
十二烷基苯磺酸钙(农乳500#)、苯乙烯基苯酚聚氧乙烯醚 (南京太化化工有限公司);
试验用水为去离子水。
1.1.2 试验仪器 Nicolet iS50 傅里叶红外光谱仪(美国赛默飞世尔科技有限公司);
Discovery-TGA550热重分析仪 (美国TA 仪器公司);
Phenom ProX 扫描电子显微镜 (荷兰飞纳世界公司);
90Plus PALS纳米激光粒度分析仪 (美国布鲁克海文仪器公司);
安捷伦1200 高效液相色谱仪 (安捷伦科技有限公司);
JJ-1 型数显测速电动搅拌器 (常州国华电器有限公司);
T18 剪切分散机 (德国 IKA 公司)。
1.1.3 生物试材 南方根结线虫M. incognita,于山东省泰安市岱岳区大汶口镇东大吴村 (117.13°E,35.97°N) 发病日光温室收集带根结的黄瓜根,用清水洗净,将根剪成1 cm 左右小块,放入0.5%的次氯酸钠溶液中浸泡5 min,过孔径500 目 (孔径25 μm) 筛后收集线虫卵囊,转移到自制的孵化筛中,于温度为 (25±1) ℃、黑暗条件下培养,收集2 龄幼虫 (J2) 悬浮液于4 ℃冰箱中保存,备用。
1.1.4 供试土壤 供试土壤采集地点同上,取土深度为0~20 cm,过60 目筛(孔径250 μm)后室内阴干备用。
1.2 试验方法
1.2.1 3%阿维菌素纳米囊悬浮剂及其他制剂的制备 3%阿维菌素纳米囊悬浮剂 (AVNCs) 的制备参考Zhang 等[14]方法并改进。称取阿维菌素原药3.23 g,溶于14 g 环己酮中形成油相;
用去离子水67 mL 溶解2.8 g 木质素磺酸钠,加入4 g 苯乙烯基苯酚聚氧乙烯醚形成水相。将油相缓慢注入水相,以10 000 r/min 高速剪切,获得稳定的水包油 (O/W) 乳液。将乳液转移至三颈烧瓶中,于常温 (25 ℃) 下以400 r/min 的转速搅拌15 min,再逐滴加入质量分数为10% 的DDBAC 溶液6 g,保持搅拌转速一致,15 min 后加入质量分数为5% 的三氯化铁溶液0.8 g,搅拌15 min 后加入0.15 g 黄原胶和2 g 乙二醇,再搅拌20 min,得到3%阿维菌素纳米囊悬浮剂。
将该纳米囊悬浮剂加入甲醇中超声20 min,高速离心后取上清液,加入去离子水复悬。重复此操作3 次,将沉淀物烘干后得到囊壳材料。
3%阿维菌素乳油 (AVEC) 的配方:3.23 g 阿维菌素原药 (95%),4 g 农乳500#,6 g 苯乙烯基苯酚聚氧乙烯醚,14 g 环己酮,二甲苯补足至100 g。
1.2.2 纳米囊悬浮剂的表征 采用文献方法[15-16]评价纳米囊悬浮剂热贮与冷贮稳定性。分别于 (54 ±2) ℃下贮存14 d 和 (0 ± 2) ℃下贮存7 d 后,检测制剂pH 值和粒径,并使用高效液相色谱(HPLC)仪测定纳米囊悬浮剂中阿维菌素含量的变化。
1.3 纳米囊悬浮剂性能表征
1.3.1 形貌观察与粒径分布 将纳米囊悬浮剂稀释至一定浓度,取适量稀释液均匀涂在硅片上,室温下晾干,用扫描电子显微镜 (SEM) 观察形貌;
另取适量稀释液用纳米激光粒度仪测定粒径分布。
1.3.2 热稳定性与红外光谱分析 将纳米囊悬浮剂于12 000 r/min 下离心,弃去上清液后加入去离子水复悬,再次离心后获得沉淀。重复此操作3 次。将沉淀物在室温下晾干,使用热重分析仪分析阿维菌素纳米囊、阿维菌素原药以及阿维菌素纳米囊囊壳材料的热稳定性,测试条件为20 ℃/min升温至500 ℃。
使用傅里叶红外光谱仪分别测定阿维菌素原药、阿维菌素纳米囊、木质素磺酸钠 (SL)、十二烷基二甲基苄基氯化铵 (DDBAC)和纳米囊囊壳材料的红外吸收光谱。
1.3.3 包封率与释放性能测定 参照MT189[17]测定包封率并进行了改进。称取约0.5 g 纳米囊悬浮剂于100 mL 玻璃瓶中,加入50 mL 正己烷与10 mL 去离子水,以(70 ± 10) r/min 的转速置于滚管器上滚动2 min。取0.5 mL 上层正己烷层,过0.22 μm 滤膜。按公式 (1) 计算包封率 (Er),按公式 (2) 计算阿维菌素游离率 (R)。
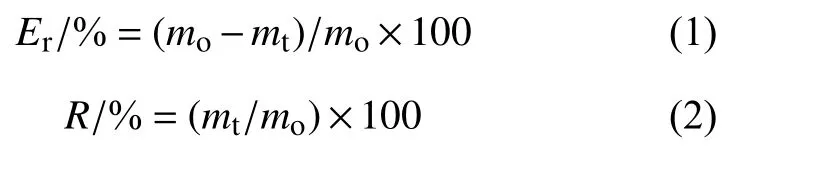
式中:mo为纳米囊悬浮剂中阿维菌素的总量,mg;
mt为正己烷中阿维菌素的总量,mg。
按MT 190 方法[18]测定阿维菌素纳米囊的释放性能。用去离子水将纳米囊悬浮液稀释至200 mg/L,取10 mL 稀释液添加到100 mL 玻璃瓶中,先后加入50 mL 正己烷与40 mL 去离子水后静置,分别于1、5、30、60、100、120 和200 min 取1 mL上层正己烷溶液,过0.22 μm 有机滤膜,用HPLC检测阿维菌素的含量。每次取样后补充等体积的正己烷,以保持释放体系中正己烷的总量不变。按公式 (3) 计算累积释放率 (ε)。
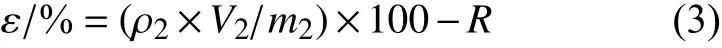
式中:ρ2为正己烷中阿维菌素的质量浓度,mg/L;
V2是正己烷体积,L;
m2是纳米囊悬浮剂稀释液中阿维菌素的总质量,mg。
色谱条件为C18不锈钢柱 (内径:250 mm ×4.6 mm),流动相为V(乙腈) :V(水)=85 : 15,流速为1 mL/min,检测波长243 nm,进样量20 μL。
1.4 土壤移动性测定
1.4.1 土柱淋溶试验 参照《化学农药环境安全评价试验准则》[19]评价阿维菌素纳米囊悬浮剂在土壤中的纵向迁移性能。称取300~400 g 供试土壤,转移至5 cm × 5 cm × 15 cm 的矩形容器中,制成10 cm 高土柱。在土柱上覆盖0.5 cm 石英砂。将纳米囊悬浮剂与阿维菌素乳油稀释为10 000 mg/L的稀释液,取1 mL 稀释液滴加在石英砂层中,使用200 mL 0.01 mol/L 的 CaCl2溶液以25 mL/h 的流速洗脱土柱,淋溶完毕后静置6 h,随后将土柱均匀分为10 段,采用HPLC 法测定每层土柱中阿维菌素的含量。每个试验重复进行3 次。
1.4.2 土壤迁移试验 采用土壤薄层层析法[4]评价纳米囊悬浮剂在土壤中的横向迁移性能。称取20 g 供试土壤置于150 mL 烧杯中,加入20 mL 去离子水制备成泥浆。将泥浆均匀地铺在10 cm ×20 cm 的玻璃板上,室温条件下自然干燥。分别将纳米囊悬浮剂与阿维菌素乳油稀释至10 000 mg/L,取1 mL 稀释液添加至距土板底端1.5 cm 处。待液体干燥后,将长方形滤纸一端粘在距土板底端1 cm 处,另一端浸到水中。当水在土板上扩展至距离点药处15 cm 时,取出土板于室温下晾干,将板上的土壤均匀分成5 份。使用HPLC 测定每层土壤中阿维菌素的含量。
1.5 室内毒力测定
采用直接接触法[13]测定阿维菌素纳米囊悬浮剂对南方根结线虫2 龄幼虫(J2)的毒力。用去离子水将制剂配制成不同质量浓度梯度 (1.6、0.8、0.4、0.2、0.1 mg/L)。取不同浓度的稀释药液0.5 mL 于24 孔板中,再向每孔中加入0.5 mL J2悬浮液 (约150 条),于25 ℃、黑暗条件下培养,于24 h 时检查J2的死亡数量和存活数量,计算死亡率。用细针刺激线虫后,线虫仍呈僵直不动时视为死亡。以3%阿维菌素乳油为药剂对照,去离子水为空白对照,每个浓度重复测定3 次。
1.6 田间防治效果试验
2021 年8 月15 日于山东省泰安市岱岳区大汶口镇东大吴村黄瓜日光温室进行,该地常年发生根结线虫病。试验温室中前茬黄瓜的根结线虫病发生严重且均匀,病指普遍在6 级以上。试验地正常施肥,未施用任何杀线剂。移栽黄瓜苗为单垄双行种植,每行30 株。供试药剂3%阿维菌素纳米囊悬浮剂和3%阿维菌素乳油的用量 (有效成分) 均为20 mg/株,以清水为空白对照,采用漫灌法与混土施药法两种方式施药,每处理重复3 次,完全随机区组设计。
漫灌施药法,按试验设计准确称取各处理制剂,加水稀释成250 倍母液,随灌溉水均匀施于种植行,灌溉用水量为600 m3/hm2。
混土施药法,按试验设计准确称取各药剂,稀释后均匀喷施于土表,喷雾用水量为675 L/hm2,土表喷施完毕后,选择带有20 cm 长刀片的旋耕机进行混土,再起垄栽种黄瓜并在两垄之间进行灌溉,用水量为600 m3/hm2。
分别于施药后60 和100 d 调查黄瓜根结形成情况,并根据公式 (4) 计算根结指数 (G,%),根据公式 (5) 计算防治效果 (F,%)。根结分级标准及计算公式参考莫明和等[20]方法并改进。
0 级,无根结;
1 级,根结较小且少,不易发现;
2 级,侧根存在小根结,主根无根结;
3 级,侧根存在一些大根结,主根无根结;
4 级,侧根有较多的根结,主根无根结;
5 级,侧根约1/2 为根结,主根小部分出现根结;
6 级,主根部分产生较明显的根结;
7 级,大部分主根产生根结;
8 级,主根全部产生根结,很少的侧根没有产生根结;
9 级,所有的根都受到侵染,植物濒临死亡;
10 级,所有的根都受到侵染,植物死亡。
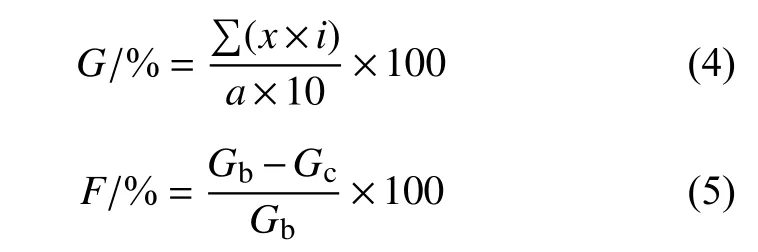
式中:x为病级数,i为相应级数值,a为总株数,Gb为空白对照区根结指数,Gc为处理区根结指数。
1.7 数据分析
使用DPS 数据处理系统对试验中数据进行单因素方差分析,使用Tukey 法比较组间差异性,使用 Origin 2018 绘制图表。
2.1 纳米囊悬浮剂的稳定性分析
由表1 可知,3% 阿维菌素纳米囊悬浮剂热贮、冷贮后的各项检测指标相近,表明制剂稳定性好。
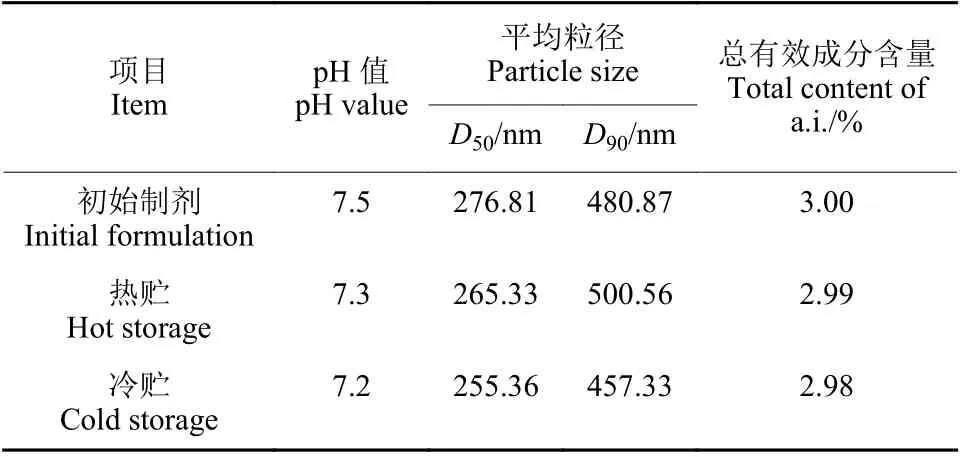
表1 3%阿维菌素纳米囊悬浮剂冷热贮稳定性Table 1 Stability of abamectin 3% nanocapsules suspension after cold and hot storages
2.2 纳米囊悬浮剂的表征
2.2.1 纳米囊形貌与粒径分布 如图1A 所示,所制备的纳米囊为光滑的球体,表面致密无孔洞。粒径符合正态分布,平均粒径D50为276.81 nm(图2B)。扫描电镜中观察到的粒径与纳米激光粒度仪测定的数据吻合。
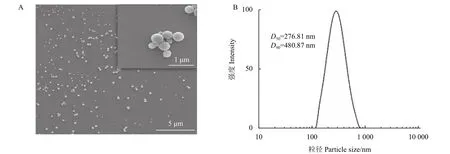
图1 阿维菌素纳米囊的扫描电镜图(A) 与粒径分布图(B)Fig. 1 SEM (A) and particle size distribution (B) of abamectin nanocapsules
2.2.2 纳米囊热重分析 图2 为阿维菌素原药、纳米囊与囊壳材料的热重分析 (TGA) 谱图 (图2A)与差式扫描量热法 (DSC) 谱图 (图2B)。纳米囊囊壳材料 (图2A-a) 自100 ℃开始出现重量损失,该阶段是由于水分挥发引起的,温度到达228 ℃时,囊壳材料开始迅速分解。阿维菌素原药 (图2A-b)的熔融峰为243 ℃,只有一个重量损失阶段,表明囊壳材料的热稳定性在243 ℃之前低于阿维菌素原药;
而在243 ℃之后,囊壳材料的热稳定性优于阿维菌素原药。因此,在阿维菌素纳米囊的两个重量损失阶段中 (图2B-a),第1 阶段为溶剂的挥发和部分囊壳材料的分解,第2 阶段为阿维菌素原药熔融阶段。在DSC 谱图中,纳米囊中阿维菌素的熔融温度 (273 ℃) 要高于阿维菌素原药的熔融温度 (243 ℃),这是由于囊壳材料将原药包覆后提高了其热稳定性。

图2 TGA 谱图(A) 和DSC 谱图(B)Fig. 2 The spectrograms of TGA (A) and DSC (B)
2.2.3 红外光谱分析 结果见图3。在木质素磺酸钠 (SL) 红外光谱图中,1 132 cm-1为磺酸根的伸缩振动,在DDBAC 的红外谱图中,2 920 与2 851 cm-1分别为甲基与亚甲基C-H 的伸缩振动,1 474 cm-1为C-N 的伸缩振动。这些吸收峰同样出现在囊壳材料中,表明木质素磺酸钠与DDBAC 发生了静电吸引[15]。1 735 与1 050 cm-1为阿维菌素的特征吸收峰,分别为C=O 与C-O-C 的伸缩振动。两个吸收峰均出现在阿维菌素纳米囊的红外谱图中,表明阿维菌素被成功包覆。
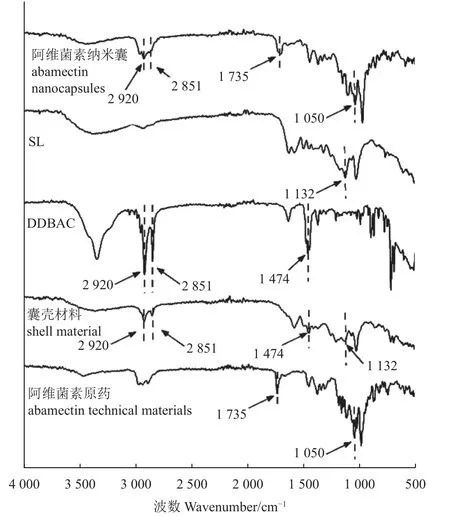
图3 纳米囊红外光谱图Fig. 3 FTIR spectrogram of nanocapsules
2.2.4 纳米囊悬浮剂包封率及释放性能 阿维菌素纳米囊悬浮剂的包封率为92.49% ± 0.96%。由累积释放曲线 (图4)可以看出:乳油中的阿维菌素在60 min 时的累积释放率达94.53%,60 min 后释放基本达到平衡;
而纳米囊悬浮剂中的阿维菌素在60 min 时的累积释放率为57.59%,200 min时达84.33%。可见,载体包覆延缓了阿维菌素的释放。

图4 不同制剂中阿维菌素的累积释放曲线Fig. 4 Accumulative release curves of abamectin from the different formulations
2.3 阿维菌素纳米囊悬浮剂在土壤中的移动性
如图5 所示,阿维菌素纳米囊悬浮剂与阿维菌素乳油在土壤中的移动性能存在较大差异。土柱淋溶试验 (图5A) 中,乳油中的阿维菌素主要集中在前半段0~4 cm 深的土柱层中,而纳米囊悬浮剂 (图5B) 中的阿维菌素可随水移动至7~8 cm 深的土柱层中,且在土柱中的分布较为均匀。可见,在纵向上其纳米囊悬浮剂的土壤移动性优于乳油。在阿维菌素乳油的土壤薄层层析试验 (图5C) 中,约95.33%的阿维菌素分布在0~3 cm 的土段中,仅有2.43%的阿维菌素分布在3~6 cm 的土段中;
而在阿维菌素纳米囊悬浮剂的土壤薄层层析试验中移动的距离更远 (图5D),分别约有64.22%、18.12%、14.21%及2.1%的阿维菌素分别分布在0~3 cm、3~6 cm、6~9 cm 与9~12 cm 的土段中,因此,不论是在横向还是纵向上,阿维菌素纳米囊悬浮剂在土壤中随水移动的能力均优于阿维菌素乳油。
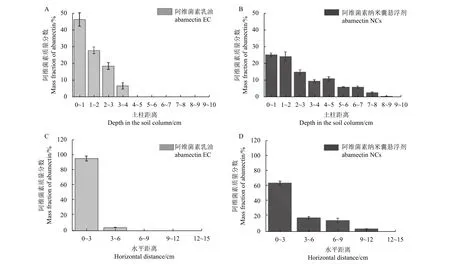
图5 不同阿维菌素制剂的土壤淋溶分布 (A,B) 与土壤薄层分布 (C,D)Fig. 5 Distribution of different abamectin formulations in soil columns (A, B) and soil layers (C, D)
2.4 阿维菌素纳米囊悬浮剂对南方根结线虫J2 的毒力
24 h 毒力测定结果见图6。阿维菌素乳油及纳米囊悬浮剂的LC50值分别为0.427 和0.257 mg/L,表明纳米囊悬浮剂的毒力高于乳油。
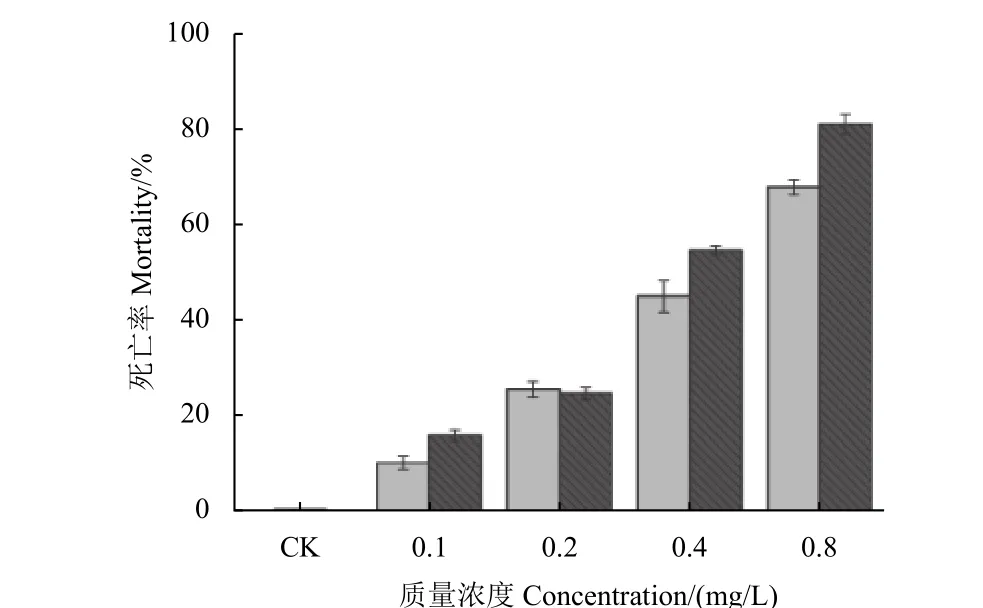
图6 不同阿维菌素制剂对南方根结线虫2 龄幼虫24 h 致死率Fig. 6 Mortality (24 h) of M. incognita J2 treated with different abamectin formulations
2.5 田间防治效果
两种施药方式下的田间防治试验结果如图7和图8 所示。施药后60 d,空白对照组发病严重,根结指数均达到85 以上。在漫灌施药方式下,乳油处理组的黄瓜根在侧根、主根均出现根结,而纳米囊悬浮剂处理组仅在侧根出现很小根结。在施药后100 d 时,乳油处理组的根结膨大非常严重,且出现明显的根结区域分层现象;
而纳米囊悬浮剂处理组的根系仅在侧根末端出现少量小根结。

图7 不同阿维菌素制剂处理的黄瓜根系发病情况Fig. 7 The symptoms in cucumber roots caused by M.incognita treated with different abamectin formulations
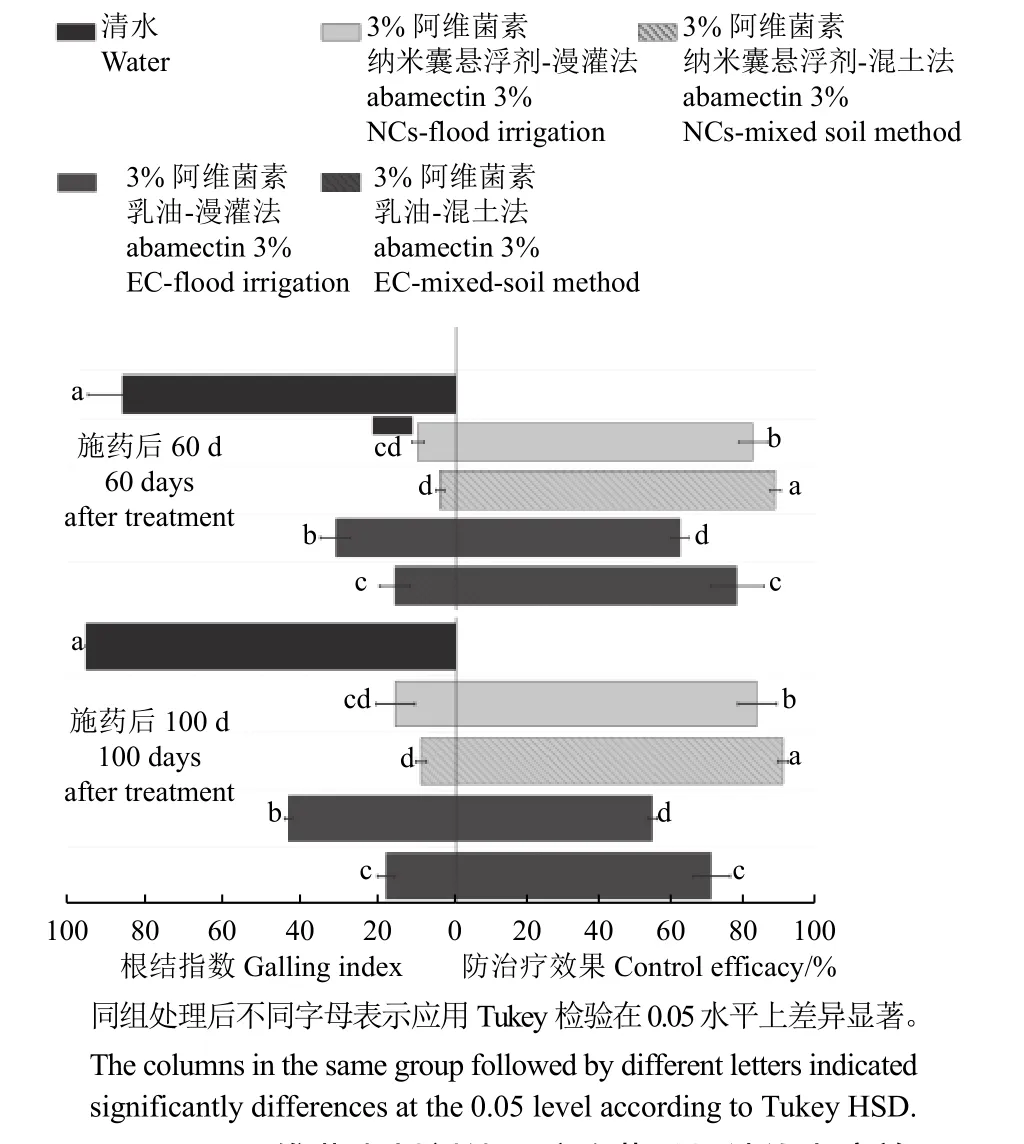
图8 不同阿维菌素制剂处理防治黄瓜根结线虫病效果Fig. 8 Control efficacy of different abamectin formulations on cucumber root-knot nematode
在混土施药方式下,药后60 d 时,乳油处理组的黄瓜根仅在底部区域出现一些小根结,药后100 d 时,在黄瓜根系末端出现大量根结;
而纳米囊悬浮剂处理组的黄瓜根在药后60 d 及100 d,整个根部几乎无根结,防治效果均达90%以上。
小尺寸与大比表面效应、界面亲和效应以及缓控释效应[21]通常是药物纳米囊的显著特征。纳米农药制剂相较于常规制剂对靶标生物具有更高的活性[22],原因在于纳米颗粒粒径小并具有较大的比表面积,可提高药剂的分散、润湿等特性,并增加药剂在作物或有害生物上黏附率和沉积率。此外,小粒径的纳米农药颗粒更容易通过口器或体壁进入有害生物体内[23],从而提高作用效果。本研究中,利用静电自组装法制备的3%阿维菌素纳米囊悬浮剂对南方根结线虫2 龄幼虫的毒力更高,显然与纳米颗粒尺寸变小有密切关系。
在土壤中施用农药防治土传病害或地下害虫时,农药在土壤中的分布、扩散情况决定着农药的防治效果,而农药在土壤中的分布和移动与农药有效成分的理化性质、土壤的理化性质、农药剂型和施药方式等因素有关[24],由于阿维菌素水溶性较低,且易被土壤中的腐殖质和矿物质吸附[25],因此阿维菌素在土壤中随水移动的能力很弱。粒径较大的阿维菌素微囊可降低土壤对其有效成分的吸附,但在土壤中随水纵向移动时,易被土壤中的微小孔隙阻挡,因此也易被固定在土壤的上层[13];
而粒径较小的阿维菌素纳米囊由于其尺寸效应,更易随水穿过土壤间隙,从而表现出较好的土壤移动性。本研究在混土与漫灌两种施药方式下,使用同等用量的阿维菌素纳米囊悬浮剂防治黄瓜根结线虫病的田间防效均显著优于乳油,原因在于载药纳米囊在土壤中随水移动扩散的能力显著高于后者,并且土柱淋溶和土壤薄层层析结果与药剂处理后的黄瓜根系根结区域分布结果也均相互印证。在漫灌施药条件下,阿维菌素乳油中的有效成分随水移动性相对较弱,易被固定在表层土壤,因而无法更有效地保护黄瓜深层次根系;
而阿维菌素纳米囊可随水移动能力强,保根效果更显著。尽管混土操作可将阿维菌素乳油制剂分散在20 cm 左右的土层中,但相比于纳米囊悬浮剂有效保护范围仍有限。此外,乳油中的阿维菌素由于直接袒露易被土壤微生物分解[26],而纳米囊中的有效成分被包覆,不仅提高了移动性,而且延缓了有效成分降解。因此,将阿维菌素等用于土壤处理的药剂纳米化可以改善应用效果,预期该类制剂在蔬菜根结线虫病等土传病害防治中将会发挥重要作用,值得进一步探索规模化生产条件,进行安全性评估和更大范围的应用效果验证。
谨以此文庆贺中国农业大学农药学学科成立70 周年。
Dedicated to the 70th Anniversary of Pesticide Science in China Agricultural University.
作者简介:

王瑞,男,博士研究生。2020 年7 月于青岛农业大学药学专业获理学学士学位。2022 年9 月在山东农业大学农药高效利用与环境安全课题组攻读博士学位,主要从事静电自组装制备农药纳米囊技术的研究。

刘峰,男,教授,博士生导师。2001 年7 月于中国农业大学农药学专业获理学博士学位。围绕农药高效利用与环境安全,主要从事农药毒理、加工与施用技术研究,在微囊化农药成囊机理、剂型及施药因素与药效关联性等方面具有特色。主持国家自然科学基金面上项目3 项,获得国家及省部级科技进步奖2 项。现任山东农业大学植物保护学院农药学系主任、《农药学学报》编委。
猜你喜欢 原药阿维菌素悬浮剂 含壳聚糖氨基酸肥料与悬浮剂混合使用下悬浮率的研究陕西农业科学(2022年6期)2022-08-100.5%藜芦碱可溶液剂与20%乙螨唑悬浮剂配合应用 防治柑橘红蜘蛛药效试验科学家(2022年5期)2022-05-133%甲氨基阿维菌素微乳剂注干剂配方研究安徽农学通报(2022年6期)2022-04-07国内部分农药原药价格消息云南农业科技(2022年1期)2022-01-27助剂“犇牛金刚钻”+5%甲氨基阿维菌素苯甲酸盐防治草地贪夜蛾药效试验云南农业科技(2021年6期)2021-12-301.8%阿维菌素微乳剂对菜青虫的田间防效研究现代农业科技(2020年11期)2020-06-2140%氰氟虫腙·甲氧虫酰肼悬浮剂防治稻纵卷叶螟田问药效试验农民致富之友(2017年14期)2018-01-272017年第四批农药原药企业延续核准名单今日农药(2017年7期)2017-08-092014年第三批农药原药企业延续核准名单今日农药(2014年12期)2015-03-30近三年农药登记情况分析山东农药信息(2013年1期)2013-03-29