毛玉帅, 段亚冰,2, 周明国*,,2
(1. 南京农业大学 植物保护学院 农药系,南京 210095;
2. 南京农业大学 农药抗性与治理技术研究中心,南京 210095)
1965 年加拿大尤尼罗亚尔 (Uniroyal) 公司申请了氧硫杂芑顺式丁烯酰替苯胺类杀菌剂萎锈灵(carboxin,2,3-二氢-5-(N-甲酰苯胺)-6-甲基-1,4-氧硫杂芑) 的专利 (US1965451048),并于1966 年商品化,用于种子和土壤处理,防治作物黑穗病。萎锈灵对担子菌的专化性、内吸输导性和治疗作用,引起了人们对其作用机制和克服其易被氧化及光解问题的研究。1970 年美国蒙大拿州立大学的Mathre 发现萎锈灵的作用靶标是呼吸链中的琥珀酸脱氢酶 (复合物II),后来进一步研究发现,萎锈灵作用于琥珀酸脱氢酶B 亚基[1]。经过20 多年的研究探索,至20 世纪80 年代中后期,日本住友化学株式会社、组合化学工业株式会社、日产化学工业株式会社分别开发出呋吡菌胺(furametpyr)、灭锈胺 (mepronil) 和噻呋酰胺(thifluzamide),并于90 年代商品化用于防治水稻纹枯病。此后,各大农药企业进一步基于靶标结构生物学纷纷研发出结构多样、广谱、高效、低毒、持效性长的琥珀酸脱氢酶抑制剂 (succinate dehydrogenase inhibitors, SDHIs),目前已经成为继麦角甾醇生物合成抑制剂类 (ergosterol biosynthesis inhibitors, EBIs) 和Qo 位点呼吸抑制剂类 (quinone outside inhibitors, QoIs) 之后,杀菌剂市场占有率第3 大的新型选择性杀菌剂。但是,随着SDHIs 杀菌剂的大量使用,多种植物病原真菌已经对该类药剂产生了抗性,且抗性菌株在病原群体中的比例和抗性发生范围不断升高,如果不能及时采取抗药性治理措施,必将影响这类杀菌剂的使用寿命。2010 年,Avenot 综述了SDHIs 杀菌剂的作用机制和抗性进化机制[2],2013 年,Sierotzki 综述了SDHIs 杀菌剂的抗性研究进展[3]。本文阐述SDHIs 杀菌剂的发展史及其作用机制,重点综述植物病原真菌对该类药剂的抗性发生发展、抗性机制及抗性治理策略。
SDHIs 是作用于细胞线粒体呼吸链复合物II 的新型杀菌剂,因其化学结构中均含有酰替苯胺活性基团,又称酰替苯胺类杀菌剂,根据酰胺键连接的官能团不同又可细分为吡唑酰胺类、吡啶酰胺类、苯基酰胺类等。SDHIs 杀菌剂属线粒体呼吸链抑制剂,因真菌孢子萌发对能量及依赖能量代谢产生的小分子碳水化合物需求旺盛,以致SDHIs 杀菌剂对孢子萌发的抑制活性常常显著高于对菌丝生长的抑制活性[4-5]。新型SDHIs 杀菌剂突破了早期开发的SDHIs 杀菌剂如萎锈灵等有关生物学和理化性质的局限性,不仅对担子菌表现很高的抗菌活性,而且对多种子囊菌同样表现高活性,且克服了易被氧化光解的缺点,可以喷施防治多种作物病害[6-7]。自巴斯夫于2003 年上市抗菌谱广、活性高、环境风险低、内吸性和传导性好的啶酰菌胺 (boscalid) 以后,各大农药公司纷纷投入大量精力和财力开展了更加安全、高效、广谱的新一代SDHIs 杀菌剂研发,并将其陆续商品化。如吡唑萘菌胺 (isopyrazam,2010 年,先正达)、联苯吡菌胺 (bixafen,2011 年,拜耳)、氟唑菌苯胺 (penflufen,2012 年,拜耳)、异丙噻菌胺(isofetamid,2015 年,日本石原)、氟唑菌酰羟胺(pydiflumetofen,2018 年,先正达)、联苯吡嗪菌胺 (pyraziflumid,2018 年,日本农药) 等陆续推向杀菌剂市场 (表1)。
自然界也存在天然的与SDHIs 杀菌剂结构类似的活性物质,如promysalin 是一种Pseudomonad aeruginosa的次生代谢物,具有抗菌活性,最初从植物根际中分离出来,亲和蛋白图谱 (affinitybased protein profiling) 鉴定表明,琥珀酸脱氢酶为该天然产物的生物学靶点[8]。目前,已经有25 个SDHIs 类杀菌剂品种进入杀菌剂市场,此类产品已成为杀菌剂市场销售额增长最为迅速的一类药剂,在重要植物病害的化学防控中发挥巨大作用。
已有研究表明,SDHIs 杀菌剂的结构包括酸片段、胺片段和酰胺键连接部分[9-10]。结合国际杀菌剂抗性行动委员会 (Fungicide Resistance Action Committee, FRAC) 2021 年公布的SDHIs 杀菌剂的化学结构细分归纳于表1[11]。
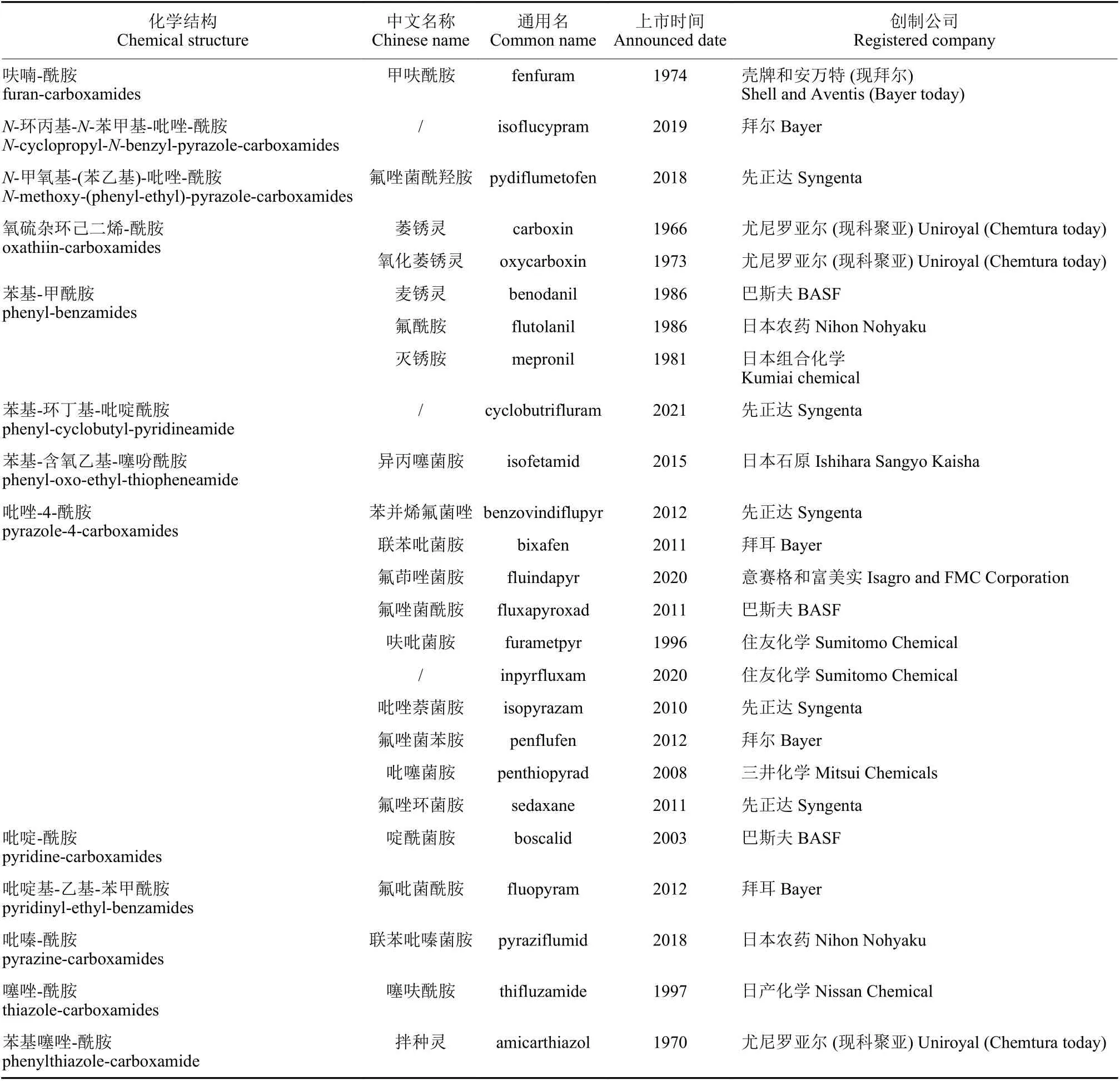
表1 琥珀酸脱氢酶抑制剂类杀菌剂的化学结构分类Table 1 Classification of the chemical structure of succinate dehydrogenase inhibitors fungicides
在SDHIs 的结构中,活性基团为酰胺键 (氟唑菌酰羟胺为羟基酰胺键,氟唑菌酰羟胺在同类药剂中活性极其优异,可能与酰胺键的改造有关),其余两个基团为改造基团[12]。有研究表明,酰胺键与胺片段的距离对药剂的活性有显著影响[13]。此外,苯甲酰胺类杀菌剂的氟吡菌胺 (fluopicolide)和我国自主研发的氟醚菌酰胺 (fluopimomide) 曾被认为是SDHIs 杀菌剂,根据最新的研究结果,FRAC 将氟吡菌胺和氟醚菌酰胺的作用机制归为作用于细胞骨架和马达蛋白的delocalisation of spectrin-like proteins 亚类 (作用机制编码为B5,抗性编码为 #43)[11]。
SDHIs 杀菌剂以其广谱性在杀菌剂市场上占据了重要地位。在我国,SDHIs 杀菌剂在各类粮食作物和经济作物病害防治上均有登记[14]。部分药剂的单剂登记现状见表2。
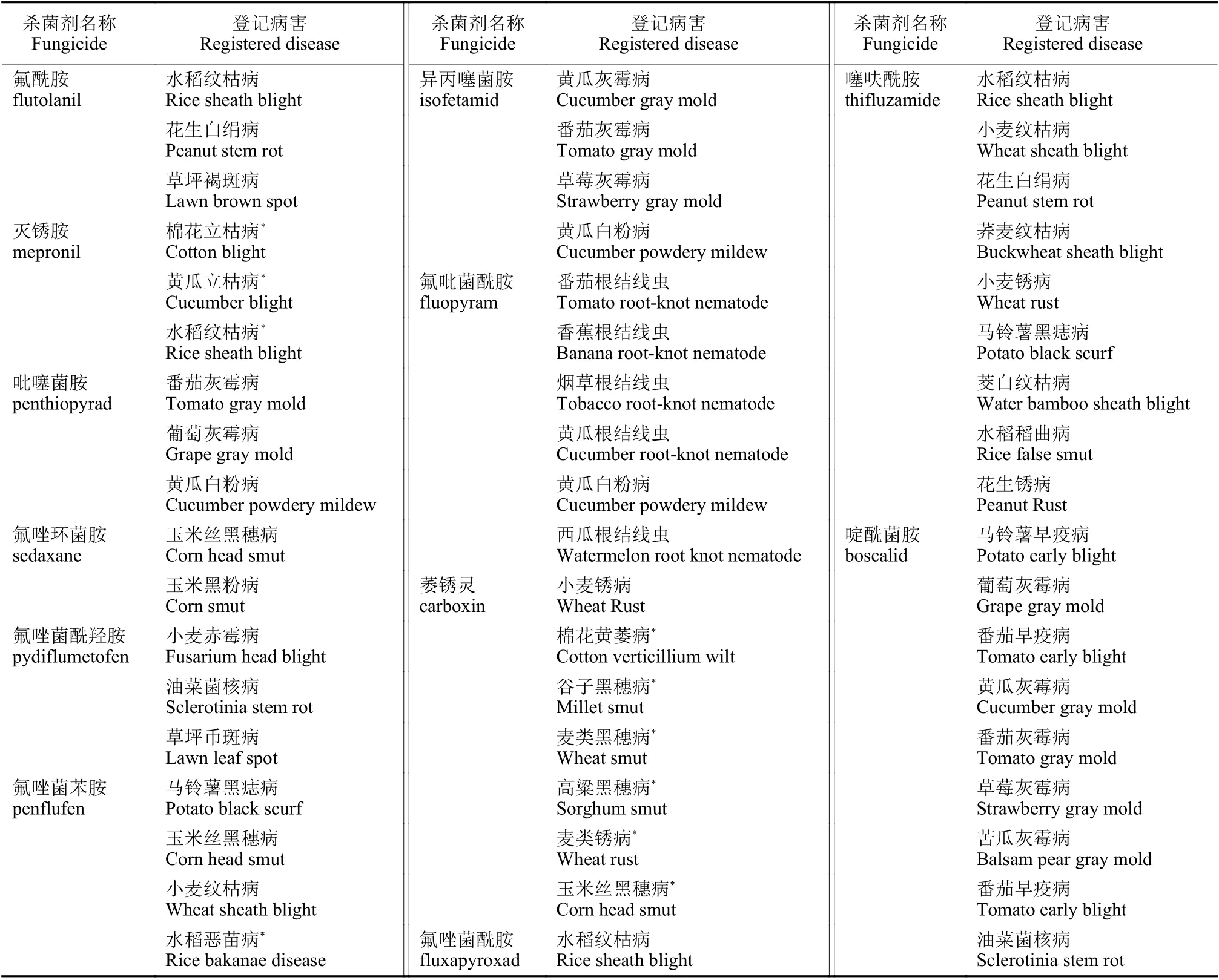
表2 SDHIs 杀菌剂在中国的病害登记情况Table 2 Disease registration of SDHIs fungicides in China
SDHIs 杀菌剂主要登记用于担子菌、子囊菌和半知菌引起的植物病害的化学防治。由于SDHIs 杀菌剂作用位点单一,抗性风险高,在产品登记上与其他产品复配成为了较好选择。从目前上市的品种看,SDHIs 杀菌剂与主流的Qo 位点呼吸抑制剂类和麦角甾醇生物合成抑制剂类杀菌剂组合大大开拓了应用范围和防治谱[14-15]。
SDHIs 杀菌剂的固有抗性风险被FRAC 归类为中至高等。最早的SDHIs 杀菌剂抗性报道至少可追溯至1975 年,Gunatilleke 等在实验室条件下通过诱导试验获得了萎锈灵抗性的构巢曲霉Aspergillus nidulans菌株[16]。21 世纪以来,杀菌剂的抗性问题逐渐引起人们的重视,与此同时SDHIs杀菌剂的应用范围也愈发广泛,使用年限越来越长,该类药剂的田间抗性问题也逐渐加重[17]。目前,SDHIs 杀菌剂的抗性问题已经发生在多种病原菌上,涉及多个国家。在美国已检测到开心果腐烂病菌Alternariaalternata抗啶酰菌胺菌株,且对萎锈灵表现出正交互抗性[18];
番茄早疫病菌Alternaria solani抗SDHIs 菌株[19]、马铃薯早疫病菌A. solani抗啶酰菌胺和吡噻菌胺菌株等[20]。在巴西小麦麦瘟病菌Pyricularia oryzae中,已检测到氟唑菌酰胺的抗性菌株[21],菊花白锈病菌Puccinia horiana种群中也已经检测到SDHIs 杀菌剂抗性[22]。在欧洲,已发现多种病原菌对SDHIs杀菌剂产生抗性,如小麦壳针孢菌Zymoseptoria tritici、苹果黑星病菌Venturia inaequalis、马铃薯早疫病菌A. solani、百合叶枯病菌Botrytis elliptica和油菜菌核病菌Sclerotinia sclerotiorum等[23]。在中国,小麦赤霉病菌Fusarium graminearum[24]、番茄灰霉病菌Botrytis cinerea[25]、桃腐烂病菌A.alternata[26]、黄瓜靶斑病菌Corynespora cassiicola[27]等病原菌中均已出现SDHIs 杀菌剂抗性种群。随着SDHIs 杀菌剂使用年限和范围的增加,抗药性问题呈现加重趋势,延缓和治理SDHIs 杀菌剂的抗性已经成为一个迫切需要解决的重要科学问题。
4.1 靶标基因点突变
植物病原真菌药靶基因的遗传分化决定了杀菌剂的选择性,不同植物病原真菌药靶基因编码的氨基酸数量也存在一定差异。敏感的植物病原菌药靶基因发生特异性突变可导致对杀菌剂产生不同水平的抗性。Mair 等建议,将所有的同类型杀菌剂抗性点突变进行规范化,统一命名,为杀菌剂靶标蛋白突变提出了一个统一的氨基酸标记系统,即不论实际位置如何,同源氨基酸位点都被赋予相同的数字,便于人们理解抗药性位点[28]。线粒体复合物II 通常由SDHA、SDHB、SDHC 和SDHD4 个亚基组成,在已有的报道中,还未见SDHA亚基上出现抗药性突变,已知主要的抗药性突变位点集中在SDHB、SDHC、SDHD3 个亚基上。
随着SDHIs 杀菌剂使用年限的增长,有关其抗性报道也逐步增多。根据近年来的相关抗性机制研究报道和FRAC 统计结果,将植物病原菌的抗药性突变基因型归纳于表3。
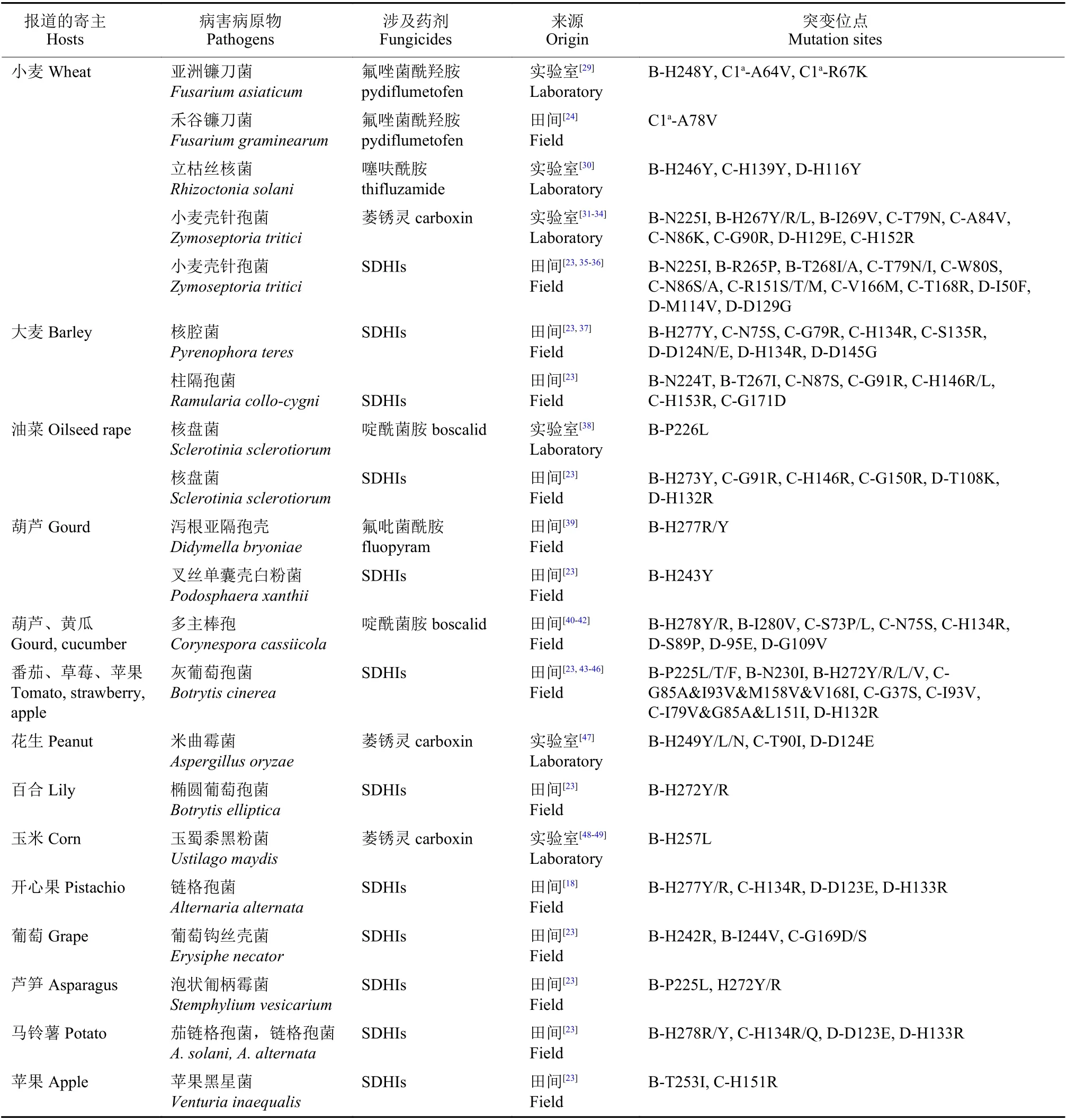
表3 植物病原菌与SDHIs 杀菌剂抗性相关的点突变基因型Table 3 Genotypes of plant pathogenic bacteria related to SDHIs fungicide resistance
近年来,FRAC 联合巴斯夫、拜耳、科迪华、先正达、富美实、安道麦、住友集团等企业在美国、巴西、欧洲等地区进行了多种病原的抗性监测工作,并逐年在FRAC 官网上发布结果[23]。在SDHB、SDHC和SDHD亚基上的抗药性突变形式有很多,甚至同一物种中存在各种不同形式的抗药性点突变基因型[17,29,37,50-55]。在以上突变中SDHB亚基的突变在257、267 或272 位由组氨酸突变为酪氨酸/异亮氨酸/精氨酸,225 位脯氨酸突变为异亮氨酸,在多物种中相对比较保守。但并非所有的田间突变都能引起药敏性的变化,例如,小麦壳针孢菌田间抗药性群体的突变BC266G、C-N33T、C-N34T 和C-L184W 已被验证与SDHIs 杀菌剂药敏性无关[23]。本研究团队最新研究发现,核盘菌SDHB-A11V 突变并非是SDHIs杀菌剂抗性突变位点,而SDHB-P226L 突变能引起SDHIs 杀菌剂的中等水平抗性[38]。
在抗药性进化过程中,某些突变会伴随一些生物适合度的下降,如生长速率、致病力等[56-57]。此外,由于一些真菌的多核现象,杂合突变体的抗药性一直无法准确鉴定。我们在开展核盘菌 (多核丝状真菌) 对SDHIs 杀菌剂抗性的相关研究中,通过人工点突变技术构建了SDHB-P226L 的点突变载体,并通过遗传转化技术,同源置换野生菌株中的SDHB基因,获得的转化子多为杂合子,生物适合度低,进一步对杂合子进行药剂驯化,获得了点突变纯合子菌株,抗药性水平与生物适合度均显著提高[38]。刘西莉研究团队在立枯丝核菌 (多核丝状真菌) 的抗药性研究中,对杂合体抗药性突变菌株进行药剂驯化,完成了杂合子纯合化的遗传变异,演化了真菌的抗药性进化过程[30]。Bart 研究团队建立了一套系统的剂量依赖型杀菌剂抗性诱导技术,用于评估SDHIs 杀菌剂的抗性风险[33]。
4.2 SDHIs 杀菌剂的非靶标抗性
Yamashita 等率先在小麦壳针孢菌上报道了SDHIs 杀菌剂的非靶标抗性[58]。在欧洲采集的田间小麦壳针孢病原群体中发现了可以稳定遗传的抗药性菌株,但在其SDHA、SDHB、SDHC和SDHD亚基上并未检测到抗药性突变位点。在交互抗性测定中发现,此种抗性仅仅存在于包括氟吡菌酰胺和异丙噻菌胺在内的部分长杂环酰胺类SDHIs 杀菌剂,而对联苯吡菌胺和氟唑菌酰胺等其他酰胺类SDHI 杀菌剂无正交互抗性[58]。非靶标抗药性菌株和相同作用靶标的杀菌剂之间无交互抗性的发现,引起了人们对SDHIs 杀菌剂抗性与药剂靶标的深入思考和探究。
通常情况下,靶标基因的突变和过表达是其对杀菌剂产生抗性的主要原因,但目前尚未有因琥珀酸脱氢酶相关亚基基因过表达而引起抗药性的相关研究。然而,Mae 等发现在小麦壳针孢菌中,MFS1(major facilitator superfamily) 启动子区的转座子插入引起了其对SDHIs 杀菌剂的抗性[59];
Sang 等在对氟吡菌酰胺不敏感的大豆猝倒病菌Fusarium virguliforme菌株中,发现了MFS转运体基因过量表达,同时,在酵母系统中,通过异源表达验证了这种耐药性[60]。这种耐药性产生的原因为外源性物质解毒相关基因过表达,引起细胞对药剂的外排作用增强,从而降低了杀菌剂的毒力。
4.3 长杂环酰胺类(stretch heterocycle amide,SHA)SDHIs 与普通SDHIs 杀菌剂的抗性差异
本研究团队发现,从黄瓜上分离的多主棒孢C. cassiicola发生了SDHB-H278R 点突变,导致其对啶酰菌胺产生抗性,但对SDHIs 杀菌剂氟吡菌酰胺 (属于长杂环酰胺亚类) 不存在交互抗性。张晓珂等发现,在灰霉病菌中,氟吡菌酰胺与啶酰菌胺之间无交互抗性[61]。Ishii 等发现,在多主棒孢和瓜类白粉病菌Podosphaera xanthii中,对啶酰菌胺 (非杂环酰胺亚类) 和吡噻菌胺 (非长杂环酰胺亚类) 的抗性菌株对氟吡菌酰胺并未表现出交互抗性[62]。这些研究结果表明,病原菌对长杂环酰胺亚类SDHIs 与普通SDHIs 的抗性机制存在差异。
Steinhauer 等以“产生非靶标抗药性的小麦壳针孢菌”为研究材料,探究了同类SDHIs 杀菌剂无交互抗性的原因[63]。通过正向遗传学技术分析得到,小麦壳针孢菌Z. tritici部分种群中存在多个SDHC同源基因;
并结合反向遗传学技术,揭示了小麦壳针孢菌非靶标抗药性产生的原因是由于SDHC3基因的存在,且抗性水平和SDHC3的表达水平及选择性剪切效率的差异有关;
同时,SDHC3启动子区的转座子插入也介导了SHASDHI 杀菌剂的抗性。有趣的是,SDHC3的存在仅对SHA-SDHI 杀菌剂表现抗性,对其他非SHASDHI 杀菌剂并未表现出抗性,点突变策略和分子对接也进一步证实了SDHC3 为SHA-SDHI 杀菌剂的药剂靶标[63]。这一发现从分子角度揭示了“药-靶”互作机理,丰富了当前的SDHIs 杀菌剂的抗性机制研究。
4.4 SDHC 亚基遗传分化对SDHIs 杀菌剂敏感性的调控研究
有趣的是,在不同的植物病原真菌中,琥珀酸脱氢酶的C 亚基可遗传分化为多个亚型,且调控着病原菌对SDHIs 杀菌剂的敏感性。邵文勇等发现在灰霉病菌B. cinerea中,存在5 种不同的SDHC分化亚型,不同亚型的灰霉病菌对SDHIs杀菌剂的敏感性存在一定差异[64]。灰霉病菌SDHC不同亚型的遗传分化,可能是在SDHIs 杀菌剂的选择压下导致的。然而在核盘菌S. sclerotiorum中,SDHC亚型的遗传分化似乎与其对SDHIs 杀菌剂敏感性并无联系,本研究团队在核盘菌中发现SDHC亚基存在两种亚型,两者存在11 个氨基酸的差异,在田间病原群体的比例约为7 : 3,但核盘菌SDHC亚基遗传分化的两种亚型对SDHI杀菌剂的药敏性并无显著差异[38,65]。
Steinhauer 等发现,小麦壳针孢菌Z. tritici SDHC遗传分化为3 个亚基 (SDHC1、SDHC2、SDHC3),并证实SDHC3是SHA-SDHI 杀菌剂的药剂靶标[63]。李美霞发现,在小麦赤霉病菌中存在两个不同SDHC亚基 (SDHC1和SDHC2),共同调控着该菌株对SDHIs 杀菌剂的敏感性[66]。当SDHC1敲除时,小麦赤霉病菌对SDHIs 杀菌剂的敏感性显著增加,表现出超敏感;
而当SDHC2敲除时,则其敏感性显著降低,表现出抗药性。此种调控机制,正如苯并咪唑类杀菌剂药靶基因β-tubulin在小麦赤霉病菌中的遗传分化,β1-tubulin负调控其对微管蛋白抑制剂的抗性,而β2-tubulin正调控其对微管蛋白抑制剂的抗性[67]。这种药靶基因遗传分化对SDHIs 杀菌剂的敏感性表现出双向调控的现象,暗示了SDHC1,SDHC2可能竞争性地参与或调控着琥珀酸脱氢酶复合体的结构形成,但其调控方式仍需通过蛋白质互作与结构生物学技术进一步验证。
随着具有单一作用位点的现代选择性杀菌剂的飞速发展,抗药性问题已成为必然。因此,开展抗药性检测/监测研究,不仅能实现植物病原菌的抗药性流行预警,而且可指导植物病害防控的精准选药和科学施药,保障我国的农药减量与农业生产安全。抗药性检测/监测技术是随着现代选择性杀菌剂的问世不断发展起来的,可以分为以下3 个阶段:
第1 阶段是传统的生物测定法,通过药剂对菌丝生长或孢子萌发抑制的差异来判定菌株是否具有抗药性,通过大量的抗性监测数据和药敏性测定结果优化出区分剂量,用该方法筛选抗性菌株可减少工作量,如:桃腐烂病菌A. alternata等对SDHIs 杀菌剂的抗性检测[68]。该方法需要经过菌株的分离、纯化和培养,需在含药平板上进行抗药性检测,由于工作量大、周期长、效率低、检测成本高,以致检测的菌株数量有限,往往在检测到抗性菌株时,病原菌群体中抗药性菌株的比例已经达到1%以上,在短期内即可造成抗药性病害流行,导致突发性危害的发生[69]。
第2 阶段主要是基于药靶基因突变后与野生菌株的核酸序列差异而开发的分子检测方法。这一阶段的检测技术往往以聚合酶链式反应(PCR)为基础,最为有效、直接、准确的方式是通过扩增靶基因序列并测序,分析突变位点。基于序列差异,利用限制性内切酶对扩增后的多态性核酸序列进行裂解,进而进行电泳分析。这种方法相对于测序的成本大大降低,被广泛用来进行抗药性突变检测。其中,限制性片段长度多态性 (RFLP,restriction fragment length polymorphism) 方法被用于检测开心果晚疫病菌A.alternata、多寄主灰霉病菌B. cinerea对SDHIs杀菌剂抗性的点突变[57,70]。裂解扩增多态性序列(CAPS,cleaved amplified polymorphic sequence)被用于Clarireedia属SDHIs 杀菌剂抗性的检测[71]。等位基因PCR (AS-PCR,allele specific PCR) 被用于A. alternata对SDHIs 的抗性检测[43]。一种基于PCR 的高分辨率溶解曲线法 (HRM,high-resolution melting) 用来检测灰霉病菌B. cinerea SDHBH272R/Y 序列变化[72]。这一阶段的抗药性分子检测技术,能够在几小时内鉴定或诊断菌株的抗药性,高通量定量PCR 技术能够在病原群体中检出万分之一至十万分之一的抗药性基因频率,实现抗药性早期预警,解决了抗药性病害突发和防控措手不及的问题[73]。但是,该阶段的检测技术需要昂贵的仪器和高级技术人员才能完成,仍然限制技术的推广应用。
第3 阶段是基于环介导恒温扩增技术 (loopmediated isothermal amplification, LAMP)而发展的新的快速分子检测方法。本研究团队创造性地研究了基因扩增引物的碱基错配技术,率先发明了可诊断药靶基因单碱基突变的LAMP 抗药性高通量快速检测技术[74],借助LAMP技术,在检测水平上实现了质的飞跃。2014 年,本研究团队率先将LAMP 技术结合到植物病原菌抗药性检测方面,并开发了一系列配套技术,大大革新了病原菌抗药性的的检测技术[75-78]。此后,针对SDHIs杀菌剂抗性位点的LAMP 检测技术也被开发[79-81]。LAMP 检测技术无需昂贵的仪器设备和繁琐的试验操作过程,检测灵敏度与检测效率得到进一步提高。相应的检测技术已开发为快速检测试剂盒,解决了检测的时空限制问题,检测条件极度简化,田间地头即可快速检测。一台水浴锅或恒温箱反应1 h,即可通过肉眼观察样品颜色差异来判断结果,简便快捷,非常适合田间快速诊断,但该方法仍然存在着只能对抗药性进行定性分析的缺陷。目前,本研究团队正在研发新一代LAMP 抗药性定量快速分子检测技术,若该技术研发成功,有望将抗药性检测效率再提高100 倍以上,检测成本降低至1%,未来的定量快速分子检测技术十分令人期待。
FRAC 将SDHIs 杀菌剂的固有抗性风险列为中至高等抗性风险。长期单一使用SDHIs 杀菌剂,植物病原真菌对其极易产生抗性。尽管病原菌的SDHIs 杀菌剂靶标基因存在低、中、高水平抗药性基因型,但同一种SDHIs杀菌剂的连续使用和加量使用,会杀死或抑制敏感和低抗水平的病原菌,加速形成中、高水平抗药性群体,使SDHIs 杀菌剂失效。因此,延缓或阻止抗药性群体发展是抗药性治理的重要目标。
由于药靶基因在不同的病原菌中存在分化,并存在不同的保守型,因此,在杀菌剂进入田间防治前,应建立敏感性基线和开展抗性风险评估,为科学用药和抗性监测提供科学依据。目前已有报道中,SDHIs 杀菌剂抗性菌株的抗性水平主要为中、低水平抗性,相较敏感群体,EC50值倍数在5~30 之间,此种抗性水平在药剂选择下有利于抗性群体的发展。
病原菌对杀菌剂发生抗性变异后的适合度是影响抗性群体发展的重要因素。桃腐烂病菌A.alternata SDHD-D123E 点突变的抗性菌株,产孢量下降,在氧化应激压力下生长速率降低[26],说明在没有药剂选择压下,抗药性病菌在群体中的比例会下降。然而,马铃薯叶枯病菌A. alternata和A. solani携带SDHB-H277Y/R 和SDHD-D123E点突变菌株,无明显适合度变化[51],草莓灰霉病菌B. cinerea携带SDHB-H272R/Y/L、SDHB-P225F和SDHB-N230I 点突变的菌株,也无明显适合度变化[82]。大多数研究表明,SDHIs 杀菌剂抗性病原菌的适合度与野生敏感群体相比,并无明显下降,说明在药剂选择下,抗药性病原群体会发展较快。在杀菌剂进入田间应用以后,实时动态监测/检测田间病原菌的抗药性发生动态,对于抗药性早期预警、储备抗药性治理技术、评价抗药性治理策略及技术的有效性等具有重要意义。
抗药性病害流行不仅取决于抗药性菌株在群体中的比例,更取决于抗药性病原菌的绝对数量。当病原菌群体在自然界的数量巨大时,即使抗药性病菌未成为优势种群,在药剂防治时剩下的抗药性病菌也足以引起病害流行。因此,能够降低药剂选择压,如利用抗病品种、生物防治等病害综合防治策略均有利于延缓抗药性群体发展。Samaras 等发现,生防菌Bacillus amyloliquefaciens在与氟吡菌酰胺的交替使用中对灰霉病菌表现出较高的抑制作用,并降低了SDHIs 类杀菌剂的抗性频率[83]。病害发生严重度直接关系到病原群体的发展,凡是有利于降低病害压力的农艺措施,如田园卫生及通风透光等栽培措施均是抗药性治理策略与技术的重要组成部分。
SDHIs 杀菌剂种类多,结构差异大,尽管FRAC 给予了这些杀菌剂相同的抗性分类编码(#7),属于同一交互抗性组,但是目前已经发现一些病原菌对长杂环酰胺类SDHIs 杀菌剂和普通SDHIs 杀菌剂并无交互抗性。因此作者认为,在明确所防治的病原群体对SDHIs 杀菌剂之间存在交互抗性条件下,或可考虑混用或轮用不同亚类的SDHIs 杀菌剂或以不同类型SDHI 杀菌剂来缓解SDHIs 杀菌剂抗性[58,63]。
在推荐SDHIs 杀菌剂与其他作用机制的药剂(QoIs 杀菌剂和EBIs 杀菌剂) 以复配的方式使用时,不仅应该遵循增效原则和无药害原则,而且必须考虑是否有利于抗药性治理[84]。不同作用方式的杀菌剂如果存在相同的抗药性机制也不应该混合使用,如相同的增加药剂外排抗性机制、相同化学基团的降解与解毒机制等。值得注意的是,那些抗性机制和作用方式不同的两种高抗性风险杀菌剂也应谨慎混合使用,防止在短时间内病原菌对两种杀菌剂均产生抗性,枯竭有效的杀菌剂资源,如使用SDHIs杀菌剂与QoIs 杀菌剂混剂防治蔬菜灰霉病,很快会使灰霉菌对这两种类型的杀菌剂产生高水平抗性群体[46]。
研发作用机制新颖、没有交互抗性的新型杀菌剂是治理抗药性的根本措施。针对药靶变异的生物学信息设计和创制反抗性杀菌剂,对于治理重要杀菌剂分子靶标抗性具有重要价值。然而,利用现代生物学技术挖掘和发现杀菌剂新的分子靶标、发现调控药-靶互作的关键蛋白、解析和发现靶标蛋白新的药敏性结构域等,是靶向新型杀菌剂和靶向增效剂创制的理论基础。
当前,SDHIs 杀菌剂在全球杀菌剂市场中仍处于上升期,SDHIs 杀菌剂仍有广阔的市场需求,因此开展SDHIs 杀菌剂的抗性研究,对于延缓其抗药性发展速度,开发新型高活性的SDHIs杀菌剂仍具有重要意义。同时当前的SDHIs 杀菌剂与植物病原菌药剂靶标之间的研究结果也加深了人们对药靶互作的理解,丰富了SDHIs 杀菌剂的作用机制研究,为SDHIs 杀菌剂的反抗性药剂或者难以产生抗性的新药剂研发提供了数据基础[85]。自然界天然的与SDHIs 杀菌剂结构类似的活性物质,与当前的酰胺类杀菌剂具有不同化学结构,这也启发了科学家开展新型SDHIs 杀菌剂的研发[8],同时也从侧面印证了SDHIs 杀菌剂的环境安全性。此外,通过修饰和改造现有杀菌剂,研发高选择性、高活性、高安全性、低风险的SDHIs 杀菌剂仍在进行,各种抗药性检测技术的发展也为SDHIs 杀菌剂的抗药性监测提供了技术保障。可以预见,SDHIs 杀菌剂仍将在未来的农药市场中发挥中流砥柱的作用。
谨以此文庆贺中国农业大学农药学学科成立70 周年。
Dedicated to the 70th Anniversary of Pesticide Science in China Agricultural University.
作者简介:

毛玉帅,男,2018 年毕业于河南农业大学烟草学院,获农学学士学位。2020 年毕业于南京农业大学植物保护学院,获农学硕士学位,同年,于南京农业大学植物保护学院农药系师从周明国教授继续攻读博士学位,主要从事杀菌剂生物学及植物病原菌抗药性研究。

周明国,男,南京农业大学教授。1982 年毕业于南京农学院(现南京农业大学) 并留校工作,1999 年获中国农业大学博士学位。主要从事杀菌剂生物学和农作物病害防控理论与技术研究。现任国际植物病理学会病害控制委员会组委、中国农药发展与应用协会杀菌剂专业委员会主任委员及《农药学学报》编委。1990 年和1993 年分别入选欧盟为中国培养100 名博士后和25 名跟踪培养人才计划,1 9 9 8 年享受国务院特殊津贴。先后主持完成欧盟、UNIDO、ICGEB 政府性及先正达、巴斯夫农药企业的重大国际合作项目和国家973 课题、863 和948 项目、行业专项、国家自然科学基金重点及面上项目及省部级科技项目近30 项。获国家科技进步二等奖3 项(第1 完成人2 项,第3 完成人1 项),光华工程科技奖、江苏省专利发明人奖、中国农药工业协会农药创新奖突出贡献奖等。发表研究论文400 余篇,获国家发明专利45 件,国际专利7 件。
猜你喜欢 抗药性酰胺靶标 纳米载体可缓解农药对靶标作物的负作用今日农业(2022年4期)2022-11-16手性磷酰胺类化合物不对称催化合成α-芳基丙醇类化合物分子催化(2022年1期)2022-11-02N-(1’-苯乙基)-吩嗪-1-酰胺对H1299细胞生长的抑制作用及其机制初探医学概论(2022年4期)2022-04-24草酰胺缓释氮肥的特性分析及建议磷肥与复肥(2021年5期)2021-06-19“百灵”一号超音速大机动靶标军民两用技术与产品(2021年10期)2021-03-16避免植物病虫害产生抗药性的常见方法新农民(2020年5期)2020-12-10不同提取净化对水产品四种酰胺类农药残留的分离影响当代水产(2020年3期)2020-06-15蔬菜蚜虫抗药性现状及治理策略①热带农业工程(2019年1期)2019-12-21药物靶标作用关系预测结果评价及查询验证计算机研究与发展(2019年9期)2019-09-16靶标评改,让习作评改有序更有效师道·教研(2019年7期)2019-08-13