徐俊华 侯毅 朱勇 檀家俊 陆铤 陈正鑫
直肠腺瘤是直肠癌的癌前病变,早期发现及治疗,有利于阻断其进一步发展,预后较好。对于较小的直肠腺瘤、息肉可在肠镜下直接行活检钳钳除、内镜下黏膜切除术(EMR)或内镜下黏膜剥离术(ESD)切除,但是对于较大的腺瘤,尤其是直径>2 cm、扁平、无蒂腺瘤,肠镜下治疗出血、穿孔风险较高,一般经腹行根治性切除[1]。腹腔镜手术可以有效减少创伤,促进术后恢复,但腹腔镜下探查病变肠管较为困难。术前或术中对肿瘤进行定位,能有效明确肿瘤位置,确定切除范围,避免漏诊和过度治疗。本文回顾性分析了南京中医药大学附属南京中医院2016年1月至2020年6月行腹腔镜直肠腺瘤切除56例患者的临床资料,分别采取术中肠镜定位和纳米碳黏膜下注射定位,并比较两组定位方法的优劣,总结两种定位方法在腹腔镜直肠腺瘤切除术中的作用及优势。
一、一般资料
纳入南京中医药大学附属南京中医院2016年1月至2020年6月行腹腔镜直肠腺瘤切除的56例患者临床资料,其中男性32例,女性24例,年龄(44.25±12.33)岁。术前均行全结肠镜检查,50例病理活检为腺瘤,6例因肠镜下息肉切除术后病理示腺瘤性息肉局灶癌变,追加行腹腔镜下根治术。肿瘤位于上段直肠或直肠乙状结肠交界处。两组患者性别、年龄、肿瘤位置比较差异无统计学意义(P>0.05)。
二、研究方法
手术常规建立气腹,腹腔镜探查,所有肿瘤无外侵,局部无明显粘连,无法确定病变肠管。按照随机数字表法分为术中肠镜组和术前纳米碳组,两组均行腹腔镜手术。术中肠镜组:术中行肠镜检查,进镜至腺瘤或病灶下缘。根据肠镜光源,腹腔镜下在腺瘤部位予钛夹标记,并确定拟切除肠管范围,退出肠镜,并抽尽肠腔内积气。纳米碳组:在手术日前1日,行结肠镜检查,在肿瘤肛侧距肿瘤边缘约1 cm黏膜下注射纳米碳,分别在3、6、9、12点分四处注射,每处注射0.25 mL。术中根据纳米碳标记,确定切缘。手术完成,标本取出后,立即剖开带瘤肠管,测量标记钛夹位置、腺瘤大小、距两切缘距离。比较两组病例手术时间、术中出血、肿瘤位置及手术清扫淋巴结数。
三、随访
采用电话和门诊随访相结合的方式,随访时间为4~24个月。两组术后3~6个月首次复查肠镜,评估吻合口愈合情况及其他部位息肉情况。
四、统计学方法
用SPSS 23.0软件处理数据。计量资料经过正态性检验和方差齐性检验,数据用均数±标准差(±s)表示,采用t检验和one-way ANOVA检验。计数资料采用卡方检验。P<0.05为差异有统计学意义。
56例患者均顺利切除病变肠管,两端切缘距肿瘤2 cm~20 cm,术后病理提示切缘及吻合口切缘阴性。两组肿瘤均准确定位,切除肠管均带瘤,无漏诊或误诊。肿瘤分期采用国际抗癌联盟(UICC)和美国肿瘤联合会(AJCC)联合制定的TNM分期法。纳米碳组30例,术后病理17例为Ⅰ期(Tis-1N0M0)肿瘤,13例为Ⅱ期(T2N0M0)肿瘤,下切缘距肿瘤(2.1±0.5)cm,清扫淋巴结(23.42±4.80)枚。术中肠镜组26例,术后病理12例Ⅰ期(Tis-1N0M0)肿瘤,14例为Ⅱ期(T2N0M0)肿瘤,下切缘距肿瘤(2.5±0.4)cm,清扫淋巴结(16.33±5.87)枚。两组清扫淋巴结数行t检验,差异有统计学意义(t=1.41,P=0.003)。淋巴结未见转移。56例患者均得到随访。发现吻合口愈合良好,无增生。其他部位结肠再发息肉者40例,均顺利行肠镜下息肉切除。各组肿瘤标本分布情况见表1。两组患者临床资料见表2。

表1 两组肿瘤标本分布情况(cm)
表2 两组患者临床资料比较(±s)
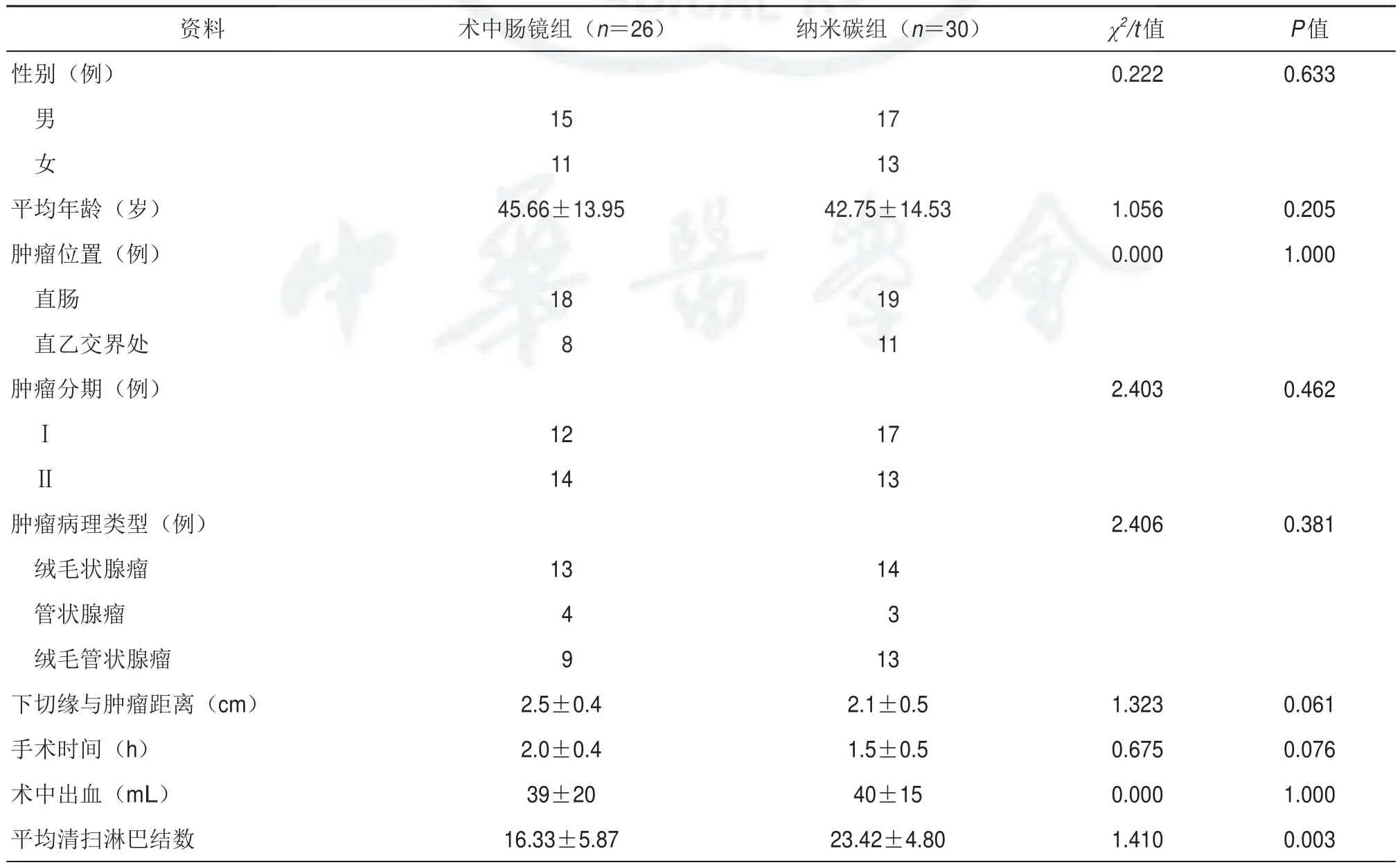
表2 两组患者临床资料比较(±s)
资料性别(例)术中肠镜组(n=26) 纳米碳组(n=30) χ2/t值0.222 P值0.633男 女平均年龄(岁)肿瘤位置(例)直肠直乙交界处肿瘤分期(例)15 11 45.66±13.95 18 8 17 13 42.75±14.53 19 11 1.056 0.000 2.403 0.205 1.000 0.462Ⅰ Ⅱ12 14 17 13肿瘤病理类型(例)绒毛状腺瘤管状腺瘤绒毛管状腺瘤下切缘与肿瘤距离(cm)手术时间(h)术中出血(mL)平均清扫淋巴结数2.4060.381 13 4 9 2.5±0.4 2.0±0.4 39±20 16.33±5.87 14 3 13 2.1±0.5 1.5±0.5 40±15 23.42±4.80 1.323 0.675 0.000 1.410 0.061 0.076 1.000 0.003
直肠腺瘤与直肠癌相比,一般质地柔软、病变范围偏小、无明显肠壁侵犯,肠管浆膜层无明显改变。术中寻找病灶肠管较为困难,尤其是在腹腔镜手术中。腹腔镜治疗结直肠良性病变具有明显优势,已逐渐被大家所公认[2],但腹腔镜手术缺乏开腹手术的触觉感受,对较小病灶不能精准定位,仅根据术前肠镜检查结果,粗略估计病变范围,有一定的误诊和漏诊率。研究表明术前肠镜定位与实际的肿瘤位置有较大差距。术前肠镜的不准确率可达到16.7%,甚至需要因此改变手术方式[3-4]。所以术前明确诊断和精准定位,是腹腔镜结直肠肿瘤手术前提[5]。术中肠镜可在直视下定位腺瘤等病灶,经腹腔镜标记,可以明确确定切除带瘤肠管的范围,提高手术治疗的精确性和安全性[6]。术前纳米碳定位,可根据肠道局部黑染,明确肿瘤位置,准确定位,确定手术范围[7],避免术中肠镜对肠管充气,减少对手术进程的干扰。
直肠肿瘤的发生与发展遵循腺瘤-癌的发展过程,对于早期癌或局灶癌变,肉眼不能分辨,术前病理活检有一定局限性。本组患者中,术前活检为良性病变,术后病理发现14例为腺瘤癌变,占25%。故建议对可疑癌变或内镜切除困难的腺瘤行根治性手术治疗。根治性手术要求切除一定长度的带瘤肠管,故明确肿瘤位置从而确定切除范围尤其重要。
结肠壁有一定的透光度,在术中肠镜检查中,在腹腔内可清晰见到肠管内的内镜光源,可明确定位腺瘤部位。本组患者中,应用术中肠镜定位后,在肠管外标记钛夹约位于肿瘤下方(2.5±0.4)cm,误差较小,是一种可行的方法。同时又可在腹腔内予无损伤肠钳夹住已定位的腺瘤远端肠管,再次肠镜验证远端肠管无瘤。经定位后行腺瘤根治性手术,一般不易漏诊和过度治疗,准确率较高。孙华朋等[8]比较了术中肠镜定位、术前钛夹定位和术前美兰染色定位三种方法,发现术中肠镜定位效果最优,并且认为该方法还可以对吻合口进行评估。施德兵等[9]也认为这三种方法各有千秋,术中肠镜定位法最好。Borda等[10]认为,术中肠镜定位结直肠肿瘤的准确率可以达到91.1%。但是术中肠镜后,肠管积气明显,手术空间受限,可致腹腔镜手术失败[11],故术中肠镜后应尽量将肠管内气体抽尽,不致影响腹腔镜手术进程。另外,由于行术中肠镜,增加了手术及麻醉时间,对患者的恢复有一定的负面影响,也应引起重视。
纳米碳是一种纳米材料,黏膜下注射后,能够将局部肠管黑染,并能够保留较长时间,比其他染色剂更具有优势。同时,纳米碳还可以示踪淋巴结,将肠系膜淋巴结染成黑色,有助于提高术后系膜淋巴结的检出率[12-13]。本组患者中,纳米碳组术后淋巴结检出率明显高于术中肠镜组,和既往文献结果一致[14]。术前纳米碳定位准确、有效,又可以示踪系膜淋巴结,可以避免术中肠镜的不良因素,有一定的优势。但是,纳米碳注射技术要求较高,注入肌层或浆膜下,可能导致局部肠管黑染一片,反而给手术带来困难。故使用纳米碳术前定位应进行适当技术培训。
总之,在腹腔镜直肠腺瘤手术中选择术中肠镜定位和术前纳米碳定位,准确、简单、实用,有很好的临床应用价值。术前纳米碳定位,还可以示踪系膜淋巴结,具有明显优势,值得推广应用。
猜你喜欢 肠镜肠管腺瘤 大肠癌高危人群肠镜依从性的护理干预模式与效果分析中国典型病例大全(2022年11期)2022-05-13和爽联合莫沙必利在肠镜前肠道准备中的应用效果中国药学药品知识仓库(2022年7期)2022-05-10无痛肠镜下高频电凝切除结合黏膜下注射治疗结肠息肉的临床效果分析中国典型病例大全(2022年13期)2022-05-10床旁超声引导下改良胃内注气法留置鼻空肠管在ICU脑外伤机械通气患者中的应用中国现代医生(2022年6期)2022-04-23超声检查在甲状腺腺瘤诊断中的应用价值探析中国典型病例大全(2022年9期)2022-04-19超声引导下床旁鼻空肠管置入术在危重患者肠内营养中的应用研究中国典型病例大全(2022年9期)2022-04-19胎儿胎粪性肠梗阻合并肠套叠肠闭锁及肠扭转坏死致多处穿孔1例中国实验诊断学(2022年3期)2022-03-25足部小汗腺汗管纤维腺瘤1例并文献复习皮肤病与性病(2021年3期)2021-07-30甲状腺腺瘤的类型有哪些?健康之家(2020年12期)2020-12-28误吞了枣核咋办?协和医生都慌了!学生导报·东方少年(2018年14期)2018-05-14