武艳霜,王岩金,杨馥吉,严永敏,2
(1. 江苏大学医学院, 江苏 镇江 212013;
2. 江苏大学附属镇江三院肝病科, 江苏 镇江 212005)
非酒精性脂肪肝病(nonalcoholic fatty liver diseases,NAFLD)是一类影响全球约1/4成年人口的慢性肝病,造成了严重的健康负担[1]。肝细胞的脂肪变性是NAFLD的重要组织学特征[2-3]。外泌体是细胞间通讯的重要介质,其中包含各种生物分子,如核酸、脂质和蛋白质。外泌体可以将这些生物分子传递到细胞中,参与分化发育、能量代谢、免疫调节等各种生物学过程。越来越多的证据表明,外泌体参与NAFLD的发展[4-7]。如Cheng等[8]研究发现人脐带间充质干细胞外泌体miR-627-5p 通过抑制脂肪质量与肥胖相关基因(fat mass and obesity-associated gene,FTO)表达改善NAFLD。骨髓间充质干细胞及其外泌体对miR-96-5p 的上调可以缓解NAFLD[9]。但是肝细胞来源的外泌体(exosomes derived from hepatocytes,LO2-Ex)在NAFLD中的作用尚不清楚。本研究旨在探讨LO2-Ex对高脂肪饮食诱导的NAFLD小鼠肝脏脂质沉积的抑制效果。从动物水平考察LO2-Ex对脂质的抑制作用,为NAFLD的治疗提供新思路。
1.1 主要试剂与仪器
高脂饲料(常州鼠一鼠二生物科技有限公司),人肝细胞系LO2细胞(中国科学院上海细胞生物学研究所),RPMI 1640 培养基(美国Gibco公司),胎牛血清(澳大利亚Bovogen公司),青霉素-链霉素双抗(美国Invitrogen公司),超滤离心管、HE染色试剂盒(上海碧云天生物技术有限公司),台式高速离心机(德国Eppendorf公司),超速离心机(美国Beckman Coulter公司),BCA 蛋白定量试剂盒(北京康为世纪生物科技有限公司),兔抗人β-肌动蛋白一抗、兔抗人CD9一抗、兔抗人Calnexin一抗、兔抗人TSG101一抗(英国Abcam公司),羊抗兔二抗(北京康为世纪生物科技有限公司),化学发光凝胶成像仪(日本Cytiva公司),Nanosight 纳米颗粒跟踪分析仪(英国Malvern公司),FEI Tecnai 12透射电子显微镜(荷兰 Philips公司),油红O染色液(美国Sigma公司),天狼星红染色试剂盒(上海翊圣生物科技有限公司),普通光学显微镜(日本Nikon公司),数字切片扫描仪(匈牙利 Dhistech公司)。
1.2 实验动物
雄性SPF级C57BL/6小鼠20只,4~6周,体质量(19±1)g,购买于扬州大学动物实验中心,许可证号: SYXK(苏)2017-0044。小鼠5只/笼,于23 ℃±2 ℃、相对湿度55%±5%、IVC系统中饲养。
1.3 人肝细胞系LO2细胞培养及LO2-Ex的分离
LO2细胞在RPMI 1640培养基中培养,该培养基包含10%的胎牛血清和100 U青霉素/链霉素。当细胞融合率达70%~80%时,改用相应含10%无外泌体胎牛血清的RPMI 1640培养基继续培养24 h。立即收集上清液采用超速离心法提取外泌体。首先将上清液置于4 ℃,10 000 ×g离心30 min以去除大细胞碎片。然后,将去除了大细胞碎片的上清液分装到100 kDa的超滤管内,以1 500×g,4 ℃离心30 min,重复此步骤,直至上清液变浓稠。接着,将浓缩液转移到超离管内,以100 000×g,4 ℃离心3 h收集外泌体(重复2次),弃去多余PBS,将外泌体溶解于无菌PBS。分装后于-80 ℃冰箱中保存备用。
1.4 Nanosight纳米颗粒分析系统和透射电镜检测LO2-Ex粒径与形态
用PBS将1 μL外泌体原液稀释至2 000倍,无菌滤器过滤后用Nanosight 纳米颗粒分析系统分析外泌体粒径和浓度。准备500 μL外泌体原液,轻轻混匀后取适量滴加在铜网上,室温静置5 min,弃去多余液体后倒扣在磷钨酸液滴上,负染5 min,烘干后在透射电镜下观察拍照。
1.5 LO2-Ex蛋白提取和蛋白质印迹检测外泌体标志物
将外泌体溶解液和细胞裂解液1 ∶1充分混匀。用涡漩振荡器将混合液振荡裂解3 min,冰上静置3 min,重复5次。用BCA法测定外泌体蛋白浓度。充分变性蛋白质,-20 ℃保存备用。配置10% SDS-PAGE凝胶分离外泌体中等量的蛋白质,然后转移到PVDF上。膜在4 ℃下与一抗孵育过夜,回收一抗。膜在1×TBST中洗3次,每次5 min。然后在室温下与二抗孵育1 h,膜在1×TBST中洗3次,每次5 min。将蛋白质水平标准化为β-肌动蛋白水平,主要抗体为CD9(1 ∶500)、Calnexin(1 ∶2 000)、TSG101(1 ∶500),二抗为HRP结合的羊抗兔(1 ∶2 000)。新鲜配制曝光液后进行曝光分析。
1.6 小鼠NAFLD模型建立及LO2-Ex注射
使用雄性C57BL/6小鼠,体重(19±1) g,建立NAFLD模型,HE染色观察肝组织空泡变性用于判断造模是否成功。所有动物在(23±2) ℃和55%±5%的相对环境湿度下持续12 h /12 h的光/暗循环。适应1周后,将实验小鼠随机分为4组:正常杂粮(10% kcal)喂养的小鼠为正常对照组、高脂肪饮食(45% kcal)喂养的小鼠为NAFLD模型组、肝细胞外泌体1 mg(高脂肪饮食+LO2-Ex-1 mg)组和肝细胞外泌体2 mg(高脂肪饮食+LO2-Ex-2 mg)组,喂养10周。从第11周开始,将LO2-Ex溶解在PBS中,外泌体组分别尾静脉注射LO2-Ex 250、500 μg/只/周,连续注射4周。对照组和模型组分别注射等量的PBS。在整个实验过程中,每周测量一次体重。10周后各组小鼠随机抽取1只,HE染色观察小鼠NAFLD的造模情况,造模成功后,其余小鼠继续用于实验。末次注射后空腹12 h,肝门静脉冲血后获取小鼠新鲜肝脏,计算肝脏指数(肝脏质量/净体重)。肝组织做冰冻切片和石蜡切片用于油红O染色和天狼星红染色。
1.7 HE染色观察肝组织空泡变性
肝组织石蜡切片于65 ℃烘箱中烘烤6~8 h,常规脱蜡至水,PBS洗3次,每次5 min。苏木素染色3~8 min,流水稍冲洗,1%的盐酸乙醇分化数秒,流水冲洗,0.6%氨水返蓝,流水冲洗。切片加入伊红染液染色1~3 min。再以70%乙醇、80%乙醇、90%乙醇、95%乙醇、100%乙醇梯度脱水,二甲苯透明后,中性树胶封片,显微镜镜检,数字切片扫描仪扫描分析。
1.8 油红O染色检测肝组织脂肪滴沉积
肝组织冰冻切片恢复至室温,双蒸水充分浸润组织切片以除去包埋剂。后用60%异丙醇浸洗切片2 min,加入油红O工作液避光孵育15 min;
苏木素染色30 s,流水冲洗返蓝,甘油明胶封片,使用普通光学显微镜观察油滴图像。
1.9 天狼星红染色检测肝组织胶原沉积
肝组织石蜡切片于65 ℃烘箱中烘烤6~8 h,常规脱蜡至水,PBS洗3次,每次5 min。滴加天狼星红染液室温孵育1 h,流水冲洗,苏木素染色30 s,流水冲洗10 min。再以70%乙醇、80%乙醇、90%乙醇、95%乙醇、100%乙醇梯度脱水,二甲苯透明后,封片,晾干,用数字切片扫描仪进行扫描分析。
1.10 统计学分析

2.1 LO2-Ex的鉴定
用Nanosight纳米颗粒分析系统观察到LO2-Ex的粒径约为120 nm(图1A)。透射电子显微镜分析证实LO2-Ex具有特征性的脂质双层结构(图1B),蛋白质印迹证实LO2-Ex外泌体标志物CD9和TSG101表达,而未检测到Calnexin表达(图1C)。

A:Nanosight纳米颗粒分析观察LO2-Ex粒径分布;
B:透射电镜观察LO2-Ex形态(×25 000);
C:蛋白质印迹检测LO2-Ex表面标志物
2.2 LO2-Ex改善NAFLD小鼠肝组织结构和提高小鼠肝脏指数
NAFLD的重要组织学特征是发生脂肪变性[2-3]。HE染色观察到,与正常对照组相比,模型组小鼠的肝组织空泡变性显著,空泡遍布整个视野,而正常对照组小鼠肝组织未发生空泡变性。与模型组相比,LO2-Ex治疗后的小鼠肝组织空泡变性显著减少,而且随着外泌体浓度增加,抑制NAFLD小鼠肝组织空泡变性的效果越显著(图2A)。与正常对照组相比,模型组小鼠肝脏苍白、粗糙且暗沉。而LO2-Ex治疗后的小鼠肝脏比模型组红润、细腻、有光泽,并且随着外泌体浓度增加,这种改善作用越明显(图2B)。同时,与正常对照组相比,模型组小鼠的体重明显增加(P<0.05)。与模型组相比,LO2-Ex-1 mg组的小鼠体重显著减轻(P<0.05),见图2C。与正常对照组相比,模型组小鼠的肝脏指数明显下降(P<0.05);
与模型组相比,LO2-Ex-2 mg组治疗后NAFLD小鼠肝脏指数显著增加(P<0.05),见图2D。以上结果均表明,NAFLD小鼠造模成功,LO2-Ex改善NAFLD小鼠肝组织结构和提高小鼠肝脏指数。

A:HE染色检测小鼠肝组织空泡变性(×400);
B:肝脏大体观;
C:小鼠体重变化;
D:小鼠肝脏指数;
a:P<0.05,与正常对照组相比;
b:P<0.05,与模型组相比
2.3 LO2-Ex抑制NAFLD小鼠脂质和胶原沉积
脂滴是复杂且具有代谢活性的细胞器,由单层磷脂和蛋白质包围的中性脂质核心组成,脂滴积累是NAFLD的特征[10]。通过油红O染色观察到,与正常对照组相比,模型组小鼠的肝组织有大量脂肪滴沉积,脂肪滴粗大、深染、遍布整个视野。与模型组相比,LO2-Ex减轻了NAFLD小鼠肝组织的脂滴沉积,随着LO2-Ex浓度增加,肝组织的脂滴减少,且变得细小、散在分布在组织切片中(图3A)。NAFLD常伴随着胶原蛋白和细胞外基质沉积,促进肝纤维化和肝硬化[11]。天狼星红染色观察到,与正常对照组相比,模型组小鼠在肝组织脉管区附近发生了大量的胶原沉积,胶原呈现深染。而LO2-Ex治疗组与模型组相比, NAFLD小鼠肝组织的胶原沉积减轻,脉管区附近胶原散在且染色变浅(图3B)。
NAFLD是非酒精性脂肪性肝炎、肝纤维化和肝硬化等慢性肝病的病理基础[12-13],目前尚缺乏用于诊断、预后和监测NAFLD进展的生物标志物和FDA批准的NAFLD治疗药物[14]。
外泌体携载来自组织细胞的蛋白质、核酸等[15],通过旁分泌或自分泌的方式完成细胞间通讯。由于其生物相容性和稳定性的特点,外泌体可以成为输送药物、微小核糖核酸、蛋白质和其他分子的理想载体[6,16]。一项研究表明,肝细胞分泌的外泌体介导肝星状细胞的激活,从而加剧肝纤维化[17]。另外有研究人员证实,LO2-Ex能够调节和治疗糖尿病[18]。上海交通大学的一项研究表明,脂毒性LO2-Ex能够激活巨噬细胞引起NAFLD[19]。但是,肝细胞分泌的外泌体在NAFLD发生发展中的作用研究较少。因此猜想,肝细胞作为肝脏组织唯一的实质细胞,其外泌体是否会对NAFLD有一定的作用。
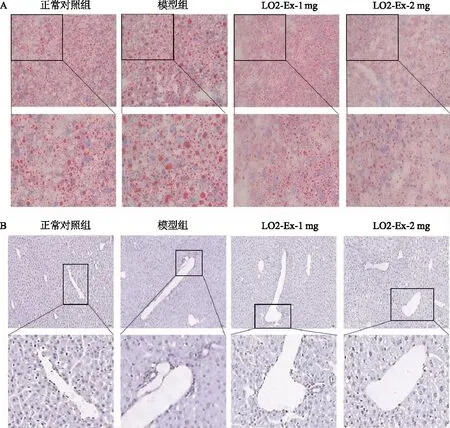
A:油红O染色检测小鼠肝组织脂滴沉积(×400);
B:天狼星红染色检测小鼠肝组织胶原沉积(×400)
本课题组在先前的研究中建立了外泌体提取方法,并对间充质干细胞来源的外泌体在急性肝损伤中的作用进行了研究[20]。肝细胞外泌体介导的治疗有望成为创新、无细胞、非侵入性、低免疫原性和无毒的肝脏治疗替代策略,并提供有关肝细胞修复功能的重要机制信息[21]。本研究通过Nanosight纳米颗粒分析系统、透射电子显微镜和蛋白质印迹多个方面对提取的外泌体进行了验证,证明了LO2-Ex直径约为120 nm、有特征性的脂质双层结构、表达外泌体标志物CD9和TSG101,不表达Calnexin。这与先前的研究结果基本一致[22]。
Cheng等[8]研究表明,人脐带间充质干细胞衍生的外泌体miR-627-5p通过抑制FTO表达改善葡萄糖和脂质代谢并减轻肝损伤,从而改善NAFLD。另外一项研究表明蓝莓衍生的外泌体样纳米颗粒通过抑制脂肪酸合酶和乙酰辅酶A羧化酶1的表达来减弱脂滴的积累从而改善NAFLD[23]。本研究设置了两个浓度的肝细胞外泌体治疗组,以期找到最佳的治疗浓度。其中尾静脉注射肝细胞外泌体2 mg后能够提高小鼠肝脏指数。此外,肝细胞外泌体治疗结束后达到了减轻NAFLD小鼠体重、抑制肝组织脂质和胶原沉积进而达到缓解NAFLD的目的。NAFLD与许多细胞因子尤其是IL-6升高有关,高脂肪饮食喂养的小鼠IL-6水平也升高[24]。那么,LO2-Ex是否携带了某些因子能够抑制NAFLD小鼠IL-6水平进而缓解NAFLD,有待进一步研究。来自华中科技大学同济医学院石春薇课题组的研究人员发现,缺氧诱导因子HIF-1介导的活性肝星状细胞分泌外泌体,传递糖酵解相关蛋白GLUT1和PKM2,影响肝脏非实质细胞的活性和代谢状态[17]。那么,肝细胞外泌体是否能够传递脂质代谢相关蛋白进而促进肝脏脂质代谢目前还不清楚。
本研究结果表明LO2-Ex抑制NAFLD小鼠脂质沉积,然而外泌体中发挥作用的活性分子及其作用机制尚不清楚。后续研究将从体内和体外两方面进一步探讨LO2-Ex抑制NAFLD的作用和机制,为临床治疗NAFLD提供新的治疗策略。
猜你喜欢 外泌体肝细胞脂质 外泌体在前列腺癌诊疗中的研究进展现代泌尿生殖肿瘤杂志(2022年2期)2022-11-22干细胞来源的外泌体对骨形成作用的研究进展中国医疗美容(2022年3期)2022-11-22外泌体的提取、贮存及其临床应用进展中国生物制品学杂志(2022年3期)2022-11-15长链非编码RNA C17orf91在肝细胞癌中低表达的临床意义浙江医学(2022年18期)2022-11-05两种巨噬细胞外泌体制备方法的对比研究新疆医科大学学报(2022年8期)2022-09-16术前血清miR-335表达与肝细胞癌患者经导管动脉化疗栓塞术后预后的关系中华实用诊断与治疗杂志(2022年1期)2022-08-31钆塞酸二钠增强MRI肝胆期瘤周低信号与肝细胞癌术后早期复发的相关性分析中国药学药品知识仓库(2022年9期)2022-05-2316排螺旋CT在肝细胞癌诊断中的应用分析中国典型病例大全(2022年13期)2022-05-10芒果皮泡水喝可降血脂家庭科学·新健康(2020年6期)2020-07-06医药脂质纳米材料技术科学导报(2019年45期)2019-09-23