胡锦洋 王璇 蒋士生

〔摘要〕 目的 研究芪連结肠宁对溃疡性结肠炎(ulcerative colitis, UC)模型大鼠结肠组织中NF-κB相关通路蛋白及血清炎症因子的影响。方法 选取36只大鼠采用3%葡聚糖硫酸钠喂养建立UC模型,并随机分为模型组、水杨酸柳氮磺胺吡啶(salicylazosulfapyridine, SASP)组、芪连结肠宁组,每组12只。另取12只大鼠为空白组。造模后,SASP组予SASP药液0.27 g/kg,芪连结肠宁组予芪连结肠宁药液3.5 g/kg,空白组和模型组予生理盐水,每天灌胃给药1次,连续28 d。观察治疗前后大鼠体质量、大便性状、便血情况,并计算疾病活动指数(disease activity index, DAI)。治疗后,HE染色法观察各组大鼠结肠组织病理变化情况;ELISA法检测各组大鼠血清中白细胞介素-1β(interleukin-1β, IL-1β)、白细胞介素-2(interleukin-2, IL-2)、白细胞介素-6(interleukin-6, IL-6)、白细胞介素-8(interleukin-8, IL-8)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)含量;Western blot检测各组大鼠结肠组织中Toll样受体-4(Toll like receptor-4, TLR-4)、核转录因子-κB(nuclear factor-κB, NF-κB)、髓样分化因子88(myeloid differentiation factor 88, MyD88)蛋白表达情况。结果 治疗第14、21、28天,SASP组、芪连结肠宁组体质量及DAI评分均明显低于模型组(P<0.05,P<0.01);芪宁结肠宁组体质量均明显高于SASP组(P<0.05,P<0.01)。模型组结肠组织明显有黏膜损伤;SASP组、芪连结肠宁组结肠组织病理损伤均不同程度恢复,炎性浸润减轻。与空白组比较,模型组IL-1β、IL-6、IL-8、TNF-α含量及TLR-4、NF-κB、MyD88蛋白表达明显升高(P<0.01),IL-2含量明显降低(P<0.01)。与模型组比较,SASP组、芪连结肠宁组IL-1β、IL-6、IL-8、TNF-α含量及TLR-4、NF-κB、MyD88蛋白表达明显降低(P<0.01),IL-2含量明显升高(P<0.01)。与SASP组比较,芪连结肠宁组TLR-4、MyD88蛋白表达明显升高(P<0.01),NF-κB蛋白表达明显降低(P<0.01)。结论 芪连结肠宁可能是通过抑制TLR-4蛋白活性,减少其下游的NF-κB的活化,进而调控促炎和抗炎因子的平衡,减少肠道炎症反应,从而发挥对UC的治疗作用。
〔关键词〕 溃疡性结肠炎;芪连结肠宁;炎症因子;Toll样受体-4;髓样分化因子88;核转录因子-κB
〔中图分类号〕R259 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2022.06.002
Effect of Qilian Jiechangning Decoction on NF-κB related pathway proteins in colon tissue and serum inflammatory factors in UC model rats
HU Jinyang1, WANG Xuan2*, JIANG Shisheng1*
(1. Affiliated Hospital of Hunan Academy of Traditional Chinese Medicine, Changsha, Hunan 410006, China; 2. The Second Affiliated Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410000, China)
〔Abstract〕 Objective To investigate the Qilian Jiechangning Decoction on NF-κB related pathway proteins in colon tissue and serum inflammatory factors in ulcerative colitis (UC) model rats. Methods A total of 36 rats were selected and fed with 3% sodium dextran sulfate to establish UC model, and randomly divided into model group, salicylazosulfapyridine (SASP) group, Qilian Jiechangning group, with 12 rats in each group. Another 12 rats were selected as blank group. After modeling, SASP group was given SASP solution 0.27 g/kg, Qilian Jiechangning group was given Qilian Jiechangning group solution 3.5 g/kg, blank group and model group were given normal saline once a day, for consecutive 28 d. The body weight, stool characteristics and hematochezia of rats were observed before and after treatment, and the disease activity index (DAI) was calculated. After treatment, HE staining was used to observe the pathological changes of colon tissues in each group. The serum levels of interleukin-1β (IL-1β), interleukin-2 (IL-2), interleukin-6 (IL-6), interleukin-8 (IL-8) and tumor necrosis factor-α (TNF-α) in rats were detected by ELISA. Western blot was used to detect the expression of toll-like receptor-4 (TLR-4), nuclear factor-κB (NF-κB) and myeloid differentiation factor 88 (MyD88) in colon tissues of rats in each group. Results On the 14th, 21st and 28th days of treatment, the body weight and DAI score of the SASP group and the Qilian Jiechangning group were significantly decreased than those of the model group (P<0.05, P<0.01); the body weight of Qilian Jiechangning group was significantly increased than the SASP group (P<0.05, P<0.01). The colon tissue of the model group had obvious mucosal damage; the pathological damage of the colon tissue in the SASP group and Qilian Jiechangning group recovered to varying degrees, and the inflammatory infiltration was reduced. Compared with blank group, the levels of IL-1β, IL-6, IL-8, and TNF-α and protein expression of TLR-4, NF-κB and MyD88 in model group were significantly increased (P<0.01), and the level of IL-2 significantly decreased (P<0.01). Compared with model group, the levels of IL-1β, IL-6, IL-8, and TNF-α and protein expression of TLR-4, NF-κB and MyD88 in SASP group and Qilian Jiechangning group were significantly reduced (P<0.01), and the IL-2 content was significantly increased (P<0.01). Compared with SASP group, the expression of TLR-4 and MyD88 protein of Qilian Jiechangning group increased significantly (P<0.01), the expression of NF-κB protein was significantly reduced (P<0.01). Conclusion Qilian Jiechangning Decoction may inhibit the activity of TLR-4 protein and reduce the activation of the downstream NF-κB, thereby regulating the balance of pro-inflammatory and anti-inflammatory factors, reducing intestinal inflammation, thereby treating UC.159D5A1F-9B27-4AC8-8438-D29BA0CFF545
〔Keywords〕 ulcerative colitis; Qilian Jiechangning Decoction; inflammatory factor; Toll like receptor-4; myeloid differentiation factor 88; nuclear factor-κB
溃疡性结肠炎(ulcerative colitis, UC),是一种临床多发的特发性炎性肠病,好发于直肠和乙状结肠的黏膜及黏膜下层,也可累及整段结肠[1-2]。除腹泻、黏液脓血便及腹痛等主要症状外,还可伴有腹胀、恶心呕吐、发热、营养不良等症状,病情轻重不一,病程迁延反复。现代医学认为,其发病机制可能是环境、遗传、感染、肠道微生态及免疫因素相互作用所致[3]。由于其发病機制尚不明确,故无特效治疗方案,临床普遍采取保护肠黏膜、抗炎、清除致病源等对症治疗[4]。芪连结肠宁由黄芪、人参、炒白术、黄连、甘草等12味药组成,实验研究显示其具有促进肠黏膜修复、健脾止泻之功,临床疗效显著[5-6]。本研究旨在探讨芪连结肠宁对溃疡结肠炎模型大鼠结肠组织中Toll样受体-4(Toll like receptor-4, TLR-4)、核转录因子-κB(nuclear factor-κB, NF-κB)、髓样分化因子88(myeloid differentiation factor 88, MyD88)蛋白表达及血清中相关炎症因子的影响,以期为芪连结肠宁治疗UC提供更深层次的科学依据。
1 材料与方法
1.1 动物
健康雄性SD大鼠48只,体质量(160±15) g,
2个月龄,购自湖南斯莱克景达实验动物中心,实验动物许可证号:SCXK(湘)2019-0004。饲养于湖南中医药大学动物实验中心,光照时间12 h/d,室温(25±3) ℃,相对湿度65%,噪音≤60 dB,适应性喂养1周后开始造模。所有关于实验动物的操作均符合湖南中医药大学实验动物伦理委员会规定,伦理审批号:2021-0088。
1.2 药物
芪连结肠宁组成:黄芪15 g,人参15 g,炒白术15 g,陈皮10 g,黄连10 g,干姜6 g,蒲黄10 g,蒲公英15 g,败酱草15 g,椿皮10 g,木香10 g,白芍15 g,甘草5 g。所有中药材均购于湖南省中医药研究院附属医院中药房,药物浸泡于蒸馏水中40 min,第1煎大火煮沸后,文火煎煮30 min;第2煎大火煮沸后,文火煎煮20 min,将2次煎煮汤药混合浓缩制成含生药1.27 g/mL的药液,4 ℃冰箱内保存,使用前预热。水杨酸柳氮磺胺吡啶(salicylazosulfapyridine, SASP),购自上海福达制药有限公司(批号:22210903),用双蒸水将浓度配成50 mg/mL的药液,放入4 ℃冰箱内保存备用。
1.3 主要试剂与仪器
葡聚糖硫酸钠(dextran sulfate sodium, DSS,美国MP生物医学公司,批号:S0849),水合氯醛(上海山浦化工有限公司,批号:20210489);β-actin(北京博奥森生物技术有限公司,批号:AH11297476);HRP-羊抗兔IgG、TLR4抗体、BCA蛋白浓度测定试剂盒、特超敏增强型化学发光液均购自武汉博士德生物工程有限公司(批号分别为BST15H08A27H69、BST20315348、16H18B51、14E22B43);MyD88抗体(英国Abcam公司,批号:ab2058);NF-κB p56抗体(美国CST公司,批号:4612T3);伊红染液、苏木素染液均购自武汉塞维尔生物科技有限公司(批号分别为ZH201285、ZH209148);白细胞介素-1β(interleukin-1β, IL-1β)、白细胞介素-2(interleukin-2, IL-2)、白细胞介素-6(interleukin-6, IL-6)、白细胞介素-8(interleukin-8, IL-8)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)ELISA试剂盒均购自美国R&D Systems公司(批号分别为R20210497、R20210512、R20210751、R20211101、R20210914)。
电泳系统、凝胶成像系统均购自美国Bio-RAD公司(型号分别为1658033、Gel Doc XR+);石蜡切片机(德国徕卡公司,型号:RM2235);BX43光学显微镜(日本Olympus公司,型号:IX73-U);多功能酶标仪(美国Molecular Devices公司,型号:Spectra Max 5);高速冷冻离心机(日本日立公司,型号:CR22G Ⅱ)。
1.4 动物造模及分组
采用随机数字表法将48只大鼠分为空白组、模型组、SASP组、芪连结肠宁组,每组12只。根据文献[7-8],采用3%DSS喂养建立UC大鼠模型。模型组、SASP组、芪连结肠宁组用蒸馏水配制浓度为3%的DSS溶液,放入饮水瓶中自由饮用,连续用药7 d。空白组正常饮用水。按照Cooper评分系统[9]根据大鼠体质量减少、大便性状、便血情况(每个项目根据症状严重程度依次计0~4分,得分越高,症状越严重)评定大鼠结肠组织疾病活动指数(disease activity index, DAI),DAI=(体质量减少分数+大便性状分数+便血情况分数)/3,以DAI升高及大鼠结肠病理性改变视为造模成功。
1.5 干预方法
造模结束后的第2天起开始灌胃给药。根据人临床用量等效剂量和动物体表面积计算[10],SASP组予SASP药液0.27 g/kg,芪连结肠宁组予芪连结肠宁药液3.5 g/kg,空白组和模型组予生理盐水,每天灌胃给药1次,连续28 d。159D5A1F-9B27-4AC8-8438-D29BA0CFF545
1.6 观察指标
1.6.1 DAI评分 分别于治疗前及治疗第7、14、21、28天时观察大鼠体质量变化,进食、活动及粪便情况,根据体质量下降、粪便性状和隐血情况,计算DAI评分。
1.6.2 HE染色法观察结肠组织形态 治疗结束后第2天,大鼠经10%水合氯醛腹腔注射麻醉,立即暴露腹腔及胸腔,以生理盐水行心脏灌注,待肝脏颜色变淡时停止灌注,快速取结肠组织,生理盐水洗净,滤纸吸干水分,一部分放入4%多聚甲醛中固定,石蜡包埋,切片,HE染色,镜下观察结肠组织形态。一部分存于-80 ℃冰箱内用于Western blot检测。
1.6.3 ELISA法测定各组大鼠血清中IL-1β、IL-2、IL-6、IL-8、TNF-α含量 灌胃结束后第2天,各组的大鼠在行心脏灌注之前,先腹主动脉取血,4 ℃静置4 h,
4 ℃、3500 r/min,离心半径13.5 cm,离心10 min,取上清液,按照ELISA试剂盒说明书操作,使用酶标仪在450 nm处读取各孔吸光度,通过标准曲线计算每个样品蛋白水平。
1.6.4 Western blot检测结肠组织中TLR-4、NF-κB、MyD88蛋白表达水平 取适量结肠组织冰上匀浆,裂解30 min,4 ℃、12 000 r/min,离心半径13.5 cm,离心10min,收集上清液冻存于-80 ℃冰箱内备用。BCA法对蛋白定量。适量蛋白样品进行电泳分离,5%浓缩胶60 V,10%分离胶90 V;然后湿转90 min,电流300 mA,5%脱脂牛奶封闭1 h,加一抗TLR-4、NF-κB(1∶1000)、MyD88(1∶500),4 ℃摇床过夜。次日,TBST缓冲液漂洗3次,二抗(1∶5000)室温孵育90 min,TBST缓冲液漂洗3次,添加特超敏增强型化学发光液后在暗室中曝片。用Image J v1.8.0软件分析各条带灰度值,进行定量分析,统计各组与β-actin灰度值的比值。
1.7 统计学方法
采用SPSS 23.0统计软件进行分析。实验数据以“x±s”表示,组间数据比较采用ANOVA方差分析,用LSD法(方差齐)或Dunnetts T3(方差不齐)作组间多重比较。以P<0.05为差异有统计学意义。
2 结果
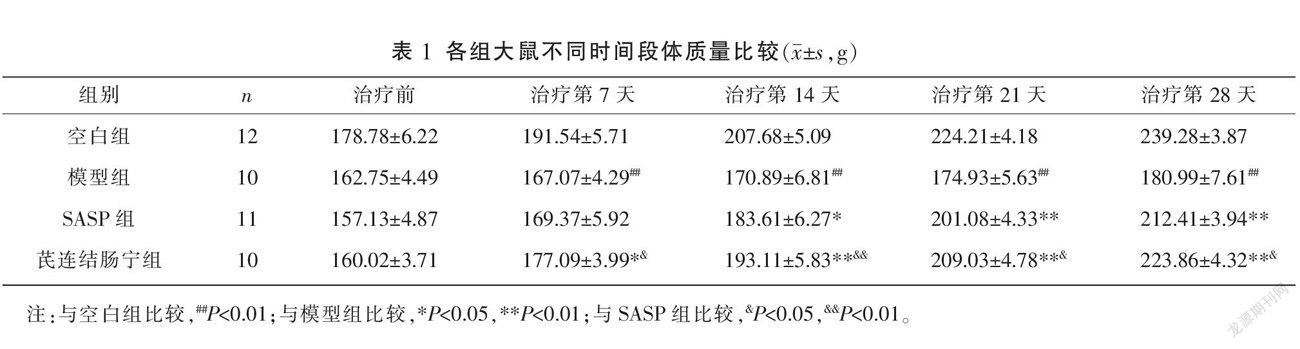
2.1 各组大鼠治疗前后一般情况观察及体质量比较
空白组在治疗前后毛色柔润光泽,无稀便脓血便情况。造模第7天,造模各组少食懒动,抱团蜷缩,毛色枯槁,大便呈黏液狀,重者夹带脓血,造模期间4只大鼠死亡(模型组2只、SASP组1只、芪连结肠宁组2只)。治疗后,SASP组、芪连结肠宁组大便次数逐渐减少,脓血黏液便减少或消失,进食及饮水量增加,毛发逐渐恢复光泽。
治疗前,各组体质量比较,差异均无统计学意义(P>0.05),具有可比性。与空白组比较,模型组在治疗第7、14、21、28天体质量均明显降低(P<0.01)。与模型组比较,SASP组及芪连结肠宁组在治疗第14、21、28天体质量均明显升高(P<0.05,P<0.01)。与SASP组比较,芪连结肠宁组在治疗第7、14、21、28天体质量均明显升高(P<0.05,P<0.01)。治疗第7天,SASP组与芪连结肠宁组体质量比较,差异无统计学意义(P>0.05)。详见表1。
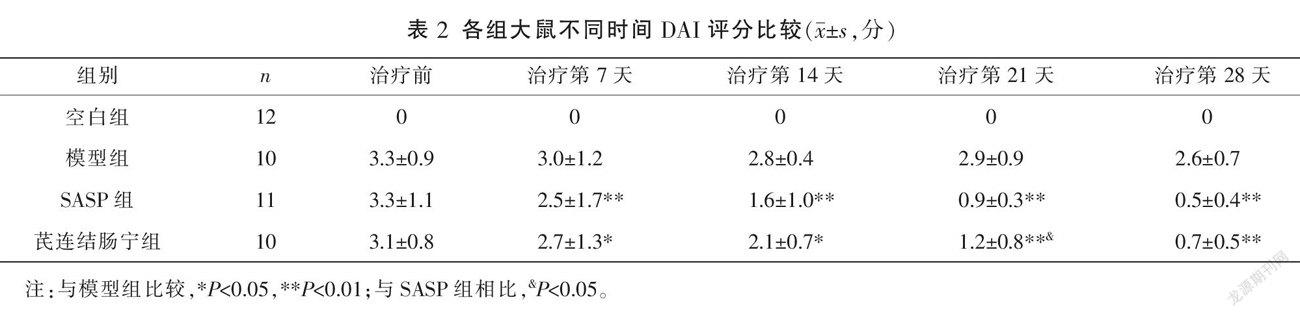
2.2 不同时间段各组大鼠DAI评分比较
治疗前,除空白组外,其余各组大鼠DAI评分比较,差异均无统计学意义(P>0.05),具有可比性。治疗第7、14、21、28天,SASP组和芪连结肠宁组DAI评分均明显低于模型组(P<0.05,P<0.01)。与SASP组比较,芪连结肠宁组在治疗第21天DAI评分明显升高(P<0.05)。治疗第7、14、28天,SASP组与芪连结肠宁组间DAI评分比较,差异均无统计学意义(P>0.05)。详见表2。
2.3 各组大鼠结肠组织形态学观察
光镜下观察发现,模型组大鼠结肠组织出现明显黏膜损伤,局部出现腺体排列紊乱和炎性细胞浸润,肠壁增厚。SASP组及芪连结肠宁组结肠组织病理改变不同程度恢复,黏膜腺体排列较整齐,肠壁基本恢复,肌层病变减轻,炎性浸润减轻。详见图1。
2.4 各组大鼠血清IL-1β、IL-2、IL-6、IL-8、TNF-α含量比较
与空白组比较,模型组IL-1β、IL-6、IL-8、TNF-α含量明显升高(P<0.01),IL-2含量明显降低(P<0.01)。与模型组比较,SASP组、芪连结肠宁组IL-1β、IL-6、IL-8、TNF-α含量明显降低(P<0.01),IL-2含量明显升高(P<0.01)。SASP组与芪连结肠宁组间IL-1β、IL-2、IL-6、IL-8、TNF-α比较,差异均无统计学意义(P>0.05)。详见表3。
2.5 各组大鼠结肠组织TLR-4、NF-κB、MyD88蛋白表达比较
与空白组相比,模型组TLR-4、NF-κB、MyD88蛋白表达均明显升高(P<0.01)。与模型组比较,SASP组、芪连结肠宁组TLR-4、NF-κB、MyD88蛋白表达均明显降低(P<0.01)。与SASP组相比,芪连结肠宁组TLR-4、MyD88蛋白表达均明显升高(P<0.01),NF-κB蛋白表达明显降低(P<0.01)。详见图2。
3 讨论
UC属于难治性疾病之一,目前常用的西药主要有氨基水杨酸制剂、糖皮质激素等,以上药物在单独或结合使用时都存在不同程度的不良反应,且减少或停用药物时有极大的复发或加重病情的风险。相比较而言,传统中医治疗慢性炎性消化系统疾病具有独特优势。UC属中医学“泄泻”“肠澼”“痢疾”“内疡”范畴[11],一般认为素体脾胃虚弱为发病基础,感受外邪和饮食、情志失调为其诱导因素,湿、热、瘀、毒、痰等郁结大肠,气血凝滞,肠络损伤,壅为脓血,遂发此病[12]。经过长期实验和临床研究表明,芪连结肠宁治疗UC确有疗效,方中人参、炒白术、黄芪、陈皮补气健脾祛湿,黄连、干姜辛开苦降、寒温并用,蒲黄、蒲公英、败酱草、椿皮清热活血、涩肠祛瘀,木香调理肠道气机,白芍酸甘敛阴止痛,甘草调和诸药,全方共奏补脾健胃祛湿、活血拔腐生新、收敛固涩止泻之功效[5-6,13-14]。现代药理研究结果显示,芪连结肠宁中某些单味中药对于治疗UC具有重要意义。黄连对于急慢性炎症均有很好的抑制作用,可通过抑制炎性通路的活化,减少炎症因子的表达,起到抗炎作用[15];其中小檗碱类是黄连所含生物碱中最丰富且最具代表性的化合物,它可通过抑制炎症因子IL-1β,TNF-α的增加,抑制回肠TLR-4和NF-κB的活化,从而减轻肠道的炎症反应,还可通过抑制H+-K+-ATP酶活性,抑制胃酸分泌,保护胃黏膜[16]。人参因具有大补元气、补脾益肺等功效而广为人知,人参中的人参皂苷Rg5在机体内代谢成为人参皂苷Rh3,其对于脂多糖刺激的小胶质细胞具有抗炎作用,还具有很好的抗肿瘤、抗氧化及抗凋亡等药理作用[17-18]。通过体内外研究发现,蒲公英通过抑制炎症反应相关的细胞及趋化因子的表达,起到抗炎抗氧化作用,有效预防和缓解自身免疫性炎症疾病[19];在急/慢性胃溃疡大鼠模型中,蒲公英提取物可以缓解肠道炎症状态,保护胃黏膜[20]。总之,基于中医理、法、方、药基本内涵和现代药理学研究进展,芪连结肠宁治疗UC具有完备的理论和科学数据支持。本实验中UC模型大鼠体质量明显下降,DAI评分明显升高且结肠组织发生明显病理改变,提示造模成功。经过4周的干预治疗,SASP组、芪连结肠宁组大鼠一般情况明显好转,体质量明显增加,DAI评分明显降低且结肠组织病理改变明显减轻,提示芪连结肠宁可改善UC模型大鼠的生存质量及肠道的病理性改变,与既往研究结果基本一致[5,14]。159D5A1F-9B27-4AC8-8438-D29BA0CFF545
研究显示,TLR-4/MyD88/NF-κB通路的活化是诱发UC发病的最重要信号通路之一[21]。在TLR-4信号通路传导的过程中,MyD88是重要的接头蛋白,MyD88 C端TIR结构域与TLR-4的TIR结构域相结合,而MyD88的N端的死亡区域与NF-κB相结合,激活NF-κB促使下游相关促炎因子大量释放,从而介导UC肠道黏膜免疫反应[22]。YANG等[23]研究发现,TLR-4/MyD88/NF-κB信号通路是调节UC患者肠道炎症反应的重要通路,抑制TLR-4/MyD88/NF-κB信号通路表达可以降低肠道炎症反应,改善患者预后。本次实验结果显示,模型组大鼠结肠组织TLR-4、NF-κB、MyD88蛋白表达显著升高(P<0.01),SASP组、芪连结肠宁组大鼠结肠组织中TLR-4、NF-κB、MyD88蛋白表达明显降低(P<0.01),提示芪连结肠宁可通过调节NF-κB信号通路而发挥对UC的治疗作用。IL-1β、IL-6、IL-8和TNF-α是重要的促炎症细胞因子,IL-2为抗炎细胞因子,抗炎与促炎因子动态失衡与炎性肠病的发生和发展密切相关[24],通过检测血清中IL-1β、IL-2、IL-6、TNF-α等炎症因子水平可判断病情进展及免疫功能恢复情况[25]。IL-1β、IL-6和IL-8是机体重要的前炎症因子,可以促进T细胞和B细胞活化,诱导多种炎症细胞因子释放,加重UC患者肠道组织损伤[26]。TNF-α是机体最重要的促炎因子之一,可以直接杀伤或抑制靶细胞,还可以激活机体的NF-κB信号通路,增加促炎因子的表达,诱导全身炎症反应,推进疾病恶性进展[27]。IL-2是一种重要的免疫应答调控因子,在缺乏IL-2或其受体(IL-2-/-和CD25-/-)的小鼠,以及缺乏IL-2下游信号分子(JAK3-/-和STAT5-/-)的小鼠中,调节性T细胞不发育,并发生以活化的CD4+T细胞增多、自身抗体产生和炎性肠病等为特点的自身免疫疾病[28]。本研究结果显示,模型组大鼠血清中IL-1β、IL-6、IL-8、TNF-α水平明显升高,抗炎因子IL-2水平明显降低,SASP组、芪连结肠宁大鼠血清中IL-1β、IL-6、IL-8、TNF-α水平均不同程度降低,IL-2水平明显升高,提示芪连结肠宁能一定程度上抑制机体的炎症反应,纠正机体抗炎因子与炎症因子的失衡。
综上所述,芪连结肠宁能显著改善UC模型大鼠结肠组织病理炎症性损伤,降低TLR-4、NF-κB、MyD88蛋白表达,抑制血清促炎症因子IL-1β、IL-6、TNF-α水平,上调抗炎细胞因子IL-2水平,表明芪连结肠宁可能通过调控TLR-4/MyD88/NF-κB炎症信号通路而发挥对UC的治疗作用,其机制可能是通过抑制TLR-4蛋白活性,减少其下游的NF-κB的活化,进而调控促炎和抗炎因子的平衡,减少肠道炎症反应。
参考文献
[1] 杨娇兰,鞠静怡,刘嫦钦,等.急性重症难治性溃疡性结肠炎[J].中华消化杂志,2021,41(7):482-485.
[2] 刘 涛,欧阳林旗,陈 鎮,等.中药调控色氨酸-肠道菌群代谢治疗溃疡性结肠炎的研究进展[J].湖南中医药大学学报,2022,42(2):324-331.
[3] 张娇娇,张 帆,余星星,等.溃疡性结肠炎发病机制及中西医治疗研究进展[J].辽宁中医药大学学报,2021,23(1):70-74.
[4] 阎鹏光,李景南.溃疡性结肠炎的规范诊治[J].中华内科杂志,2021,60(6):567-570.
[5] 蒋士生,李勇敏,朱克俭,等.芪连结肠宁片对大鼠慢性非特异性溃疡性结肠炎的影响[J].中国实验方剂学杂志,2011,17(23):217-219.
[6] 谭华梁,徐 寅,肖 麟,等.芪连结肠宁方治疗腹泻型肠易激综合征脾虚湿热证临床研究[J].中国中医药信息杂志,2021,28(2):92-96.
[7] 陈 婷,卢美琪,高 昂,等.基于网络药理学和分子对接技术研究槐花散治疗溃疡性结肠炎的机制[J].中华中医药杂志,2021,36(4):2071-2076.
[8] 张培培,杨 欣,梁国强,等.加味白头翁汤通过p38 MAPK-MLCK信号通路影响溃疡性结肠炎模型大鼠肠黏膜紧密连接蛋白[J].中国中药杂志,2021,46(21):5719-5726.
[9] 宋 艳,何永恒,杨 芳,等.黄芪多糖调节脂联素/TLR/NF-κB信号通路对溃疡性结肠炎小鼠的治疗作用[J].中国免疫学杂志,2021,37(11):1319-1324.
[10] 黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学,2004(9):1069-1072.
[11] 蒋 峰,刘慧泽,陈玉根.中医辨治溃疡性结肠炎临证撷要[J].江苏中医药,2021,53(10):38-40.
[12] 朱玉梅,董 筠.中医药治疗溃疡性结肠炎研究进展[J].河南中医,2021,41(7):1121-1125.
[13] 王红梅,李勇敏,朱克俭,等.芪连结肠宁片健脾止泻作用研究[J].新中医,2012,44(3):124-125.
[14] 蒋士生,李勇敏,朱克俭,等.芪连结肠宁片对损伤性溃疡性结肠炎模型大鼠的影响[J].新中医,2011,43(10):117-118.
[15] 周 瑞,项昌培,张晶晶,等.黄连化学成分及小檗碱药理作用研究进展[J].中国中药杂志,2020,45(19):4561-4573.159D5A1F-9B27-4AC8-8438-D29BA0CFF545
[16] 胡 茜,张 颖,李 堃,等.黄连主要成分小檗碱的临床药理作用探析[J].中国中医药现代远程教育,2021,19(24):203-205.
[17] 叶安琪,张仔豪,成乐琴.人参皂苷Rg5的研究进展[J].沈阳药科大学学报,2020,37(12):1144-1152.
[18] 嵇再雄,李家祺,王建波.人参皂苷Rh3药理作用的研究现状[J].上海中医药杂志,2021,55(2):97-100.
[19] 岑丽航,肖瑞琳,李 苗,等.蒲公英的抗癌抗炎机制研究进展[J].国际药学研究杂志,2020,47(11):954-961.
[20] 聂文佳,徐帅师,张咏梅.蒲公英有效成分及其药理作用研究进展[J].辽宁中医药大学学报,2020,22(7):140-145.
[21] 乔翠霞,赵 刚,张立泽,等.基于Toll样受体4/髓样分化因子88/核因子-κB通路探讨电针对溃疡性结肠炎大鼠的干预机制[J].针刺研究,2020,45(3):180-187,201.
[22] 孙伟东,张志强,朴大勋.NF-κB信号通路抑制结肠炎及炎症相关结肠癌的研究[J].医学综述,2020,26(8):1521-1525.
[23] YANG Q Y, MA L L, ZHANG C, et al. Exploring the mechanism of indigo naturalis in the treatment of ulcerative colitis based on TLR-4/MyD88/NF-κB signaling pathway and gut microbiota[J]. Frontiers in Pharmacology, 2021, 12:
674416.
[24] 宋亞华,安 苗,秦 赟,等.白细胞介素家族成员对溃疡性结肠炎严重程度及肠道菌群的影响研究[J].现代消化及介入诊疗,2021,26(7):870-873.
[25] 杨显娟,付 尹,王佳俊,等.黄连-厚朴配伍抑制PI3K/Akt信号通路改善TNBS诱导的大鼠溃疡性结肠炎研究[J].中草药,2021,52(15):4587-4597.
[26] 曾微微,麦联任,张 玲.葛根芩连汤联合固肠止泻丸治疗溃疡性结肠炎的疗效及对血清IL-1β、IL-6、TNF-α水平影响[J].中华中医药学刊,2021,39(9):212-215.
[27] 张志坚,陈伟德,张井泉,等.溃疡性结肠炎患者CD4+T细胞中PRMT5表达及其作用[J].现代免疫学,2020,40(4):320-324.
[28] 王二嫚,刘占举.白细胞介素-2新型突变蛋白在炎症性肠病治疗中的价值[J].中华炎性肠病杂志,2022,6(1):79-82.159D5A1F-9B27-4AC8-8438-D29BA0CFF545
猜你喜欢 溃疡性结肠炎结肠 蒙药治疗慢性结肠炎的临床疗效分析中国典型病例大全(2022年9期)2022-04-19左半结肠一期切除术探讨中国典型病例大全(2021年1期)2021-03-30结肠炎的小常识幸福家庭(2021年1期)2021-03-08空腹生吃鱼腥草治结肠炎恋爱婚姻家庭·养生版(2018年5期)2018-05-14久用泻药要警惕结肠黑变病家庭医学·下半月(2017年11期)2017-12-20针灸可治疗溃疡性结肠炎大众健康(2017年7期)2017-07-19一例猫巨结肠症的诊疗中国动物保健(2015年4期)2015-10-21蒙药治疗溃疡性结肠炎46例临床观察中国民族民间医药·下半月(2011年10期)2011-12-27肠疡宁汤治疗溃疡性结肠炎15例结肠镜象观察浙江中医杂志(2004年1期)2004-07-30慢结汤治疗慢性结肠炎105例观察浙江中医杂志(2004年4期)2004-04-26